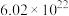1 . 根据所学知识,回答下列问题:
(1)常温常压下,HCl气体溶于水形成的盐酸溶液,其溶质质量分数为
 ,密度为
,密度为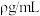 ,该溶液浓度为
,该溶液浓度为 。
。(2)“可燃冰”是由水和甲烷在一定条件下形成的类冰结晶化合物.
 “可燃冰”(
“可燃冰”( )的物质的量与
)的物质的量与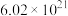 个水分子的物质的量相等,则该“可燃冰”的摩尔质量为
个水分子的物质的量相等,则该“可燃冰”的摩尔质量为(3)过氧化钠可用作呼吸面罩供氧剂,其原理可用方程式
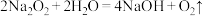 ,
,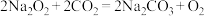 表示。若生成标况下
表示。若生成标况下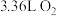 ,转移电子的数目为
,转移电子的数目为(4)现有
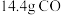 和
和 的混合气体,在标准状况下所占的体积约为
的混合气体,在标准状况下所占的体积约为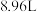 。将混合气体依次通过如图装置,最后收集在气球中,气球中收集到的气体在标况下的体积为
。将混合气体依次通过如图装置,最后收集在气球中,气球中收集到的气体在标况下的体积为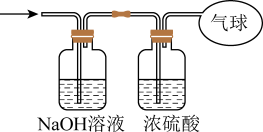
您最近一年使用:0次
名校
解题方法
2 . 填写下列空白:
(1)工业上湿法制备高铁酸钾( )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式___________ ;若反应过程中转移了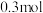 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为___________  。
。
(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)___________ 。
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是___________ g。
(4)将 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
(5)等质量的铝分别与 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:___________ ;铝的质量为___________ g。
(6)将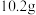 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入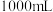 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为___________  。
。
(1)工业上湿法制备高铁酸钾(
 )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式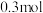 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为 。
。(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的
 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是(4)将
 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为(5)等质量的铝分别与
 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:(6)将
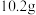 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入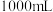 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为 。
。
您最近一年使用:0次
名校
3 . Ⅰ.工业上常用电解 溶液制备
溶液制备 ,反应方程式如下:
,反应方程式如下: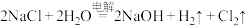 。回答下列问题:
。回答下列问题:
(1)用 的
的 溶液进行电解制备
溶液进行电解制备 。
。
①该 溶液中
溶液中 的物质的量是
的物质的量是_______  ;
;
②标准状况下,理论上最多能产生
_______ L;
③该反应中两种气体产物的质量比是_______ ;
④当 恰好完全反应时,停止电解,把所得溶液稀释到
恰好完全反应时,停止电解,把所得溶液稀释到 ,则所得
,则所得 溶液的物质的量浓度为
溶液的物质的量浓度为_______  。
。
(2)写出该反应的离子方程式_______ 。
Ⅱ.我国科学家用 人工合成淀粉时,第一步需要将
人工合成淀粉时,第一步需要将 转化为甲醇,反应的化学方程式为:
转化为甲醇,反应的化学方程式为: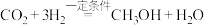 。
。
(3)做还原剂的物质是_______ ;
(4)反应中每生成 ,消耗
,消耗 的物质的量是
的物质的量是_______  ,转移电子的物质的量是
,转移电子的物质的量是_______  。
。
(5)对于反应: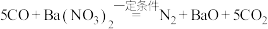 。
。
①发生还原反应的物质为_______ ;
②若有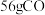 参与反应,则反应中转移的电子的物质的量为
参与反应,则反应中转移的电子的物质的量为_______  。
。
 溶液制备
溶液制备 ,反应方程式如下:
,反应方程式如下: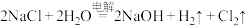 。回答下列问题:
。回答下列问题:(1)用
 的
的 溶液进行电解制备
溶液进行电解制备 。
。①该
 溶液中
溶液中 的物质的量是
的物质的量是 ;
;②标准状况下,理论上最多能产生

③该反应中两种气体产物的质量比是
④当
 恰好完全反应时,停止电解,把所得溶液稀释到
恰好完全反应时,停止电解,把所得溶液稀释到 ,则所得
,则所得 溶液的物质的量浓度为
溶液的物质的量浓度为 。
。(2)写出该反应的离子方程式
Ⅱ.我国科学家用
 人工合成淀粉时,第一步需要将
人工合成淀粉时,第一步需要将 转化为甲醇,反应的化学方程式为:
转化为甲醇,反应的化学方程式为: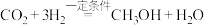 。
。(3)做还原剂的物质是
(4)反应中每生成
 ,消耗
,消耗 的物质的量是
的物质的量是 ,转移电子的物质的量是
,转移电子的物质的量是 。
。(5)对于反应:
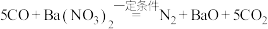 。
。①发生还原反应的物质为
②若有
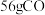 参与反应,则反应中转移的电子的物质的量为
参与反应,则反应中转移的电子的物质的量为 。
。
您最近一年使用:0次
4 . 氧化还原反应原理及物质的量的相关计算在生产、生活中应用广泛。
(1)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,其中一定不可能实现的是(填序号)_______ 。
(2)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为 ,此反应的离子方程式为
,此反应的离子方程式为_______ 。
(3)已知亚硝酸钠(NaNO2)可以与氯化铵(NH4Cl)反应生成氮气、氯化钠及其它产物,写出该反应的化学反应方程式_______ 。
(4)一定条件下,当溶液中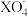 与H2O2物质的量比恰好为2:5时,溶液中
与H2O2物质的量比恰好为2:5时,溶液中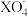 离子被还原为较低价态,则X元素的化合价变为
离子被还原为较低价态,则X元素的化合价变为_______ 。
(5)将不纯的NaOH样品2g(含少量Na2CO3和水),放入50mL2mol/L的盐酸中,充分反应后,溶液呈酸性,中和剩余的酸又用去40mLlmol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______ 。
(6)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压,放电管来制取臭氧:
①在臭氧发生装置中装入氧气100mL,经反应最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是_______ g/L(保留一位小数);
②实验室将氧气和臭氧的混合气体0.896L(标准状况),通入盛有20.0g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6g。则原混合气中臭氧的体积分数_______ 。
(1)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,其中一定不可能实现的是(填序号)
(2)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为
 ,此反应的离子方程式为
,此反应的离子方程式为(3)已知亚硝酸钠(NaNO2)可以与氯化铵(NH4Cl)反应生成氮气、氯化钠及其它产物,写出该反应的化学反应方程式
(4)一定条件下,当溶液中
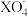 与H2O2物质的量比恰好为2:5时,溶液中
与H2O2物质的量比恰好为2:5时,溶液中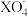 离子被还原为较低价态,则X元素的化合价变为
离子被还原为较低价态,则X元素的化合价变为(5)将不纯的NaOH样品2g(含少量Na2CO3和水),放入50mL2mol/L的盐酸中,充分反应后,溶液呈酸性,中和剩余的酸又用去40mLlmol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为
(6)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压,放电管来制取臭氧:
①在臭氧发生装置中装入氧气100mL,经反应最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是
②实验室将氧气和臭氧的混合气体0.896L(标准状况),通入盛有20.0g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6g。则原混合气中臭氧的体积分数
您最近一年使用:0次
名校
解题方法
5 . 完成下列小题
(1) 溶液含中,含
溶液含中,含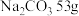 ,则该溶液中
,则该溶液中 的物质的量浓度
的物质的量浓度_____  。
。
(2)对于反应: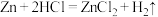 ,现有
,现有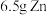 放入
放入 的
的 溶液中充分反应后,溶液中存在的溶质有
溶液中充分反应后,溶液中存在的溶质有_____ 。
(3)对于反应: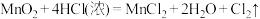 。
。
①用双线桥法表示上述反应电子转移的方向和数目_____ 。
②上述反应中还原剂是_____ ,若该反应有中有 电子转移,实际参加反应的
电子转移,实际参加反应的 质量
质量_____ g,生成氯在气在STP时体积是_____ L。
③若使用浓盐酸的质量分数0.365、密度 ,该浓盐酸物质的量浓度是
,该浓盐酸物质的量浓度是_____  。
。
(1)
 溶液含中,含
溶液含中,含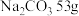 ,则该溶液中
,则该溶液中 的物质的量浓度
的物质的量浓度 。
。(2)对于反应:
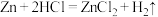 ,现有
,现有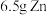 放入
放入 的
的 溶液中充分反应后,溶液中存在的溶质有
溶液中充分反应后,溶液中存在的溶质有(3)对于反应:
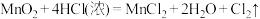 。
。①用双线桥法表示上述反应电子转移的方向和数目
②上述反应中还原剂是
 电子转移,实际参加反应的
电子转移,实际参加反应的 质量
质量③若使用浓盐酸的质量分数0.365、密度
 ,该浓盐酸物质的量浓度是
,该浓盐酸物质的量浓度是 。
。
您最近一年使用:0次
6 . 回答下列问题
(1)①石墨 ②苛性钠 ③石灰乳 ④熔融氯化钾 ⑤盐酸 ⑥氨气 ⑦蔗糖 ⑧铁⑨液态氯化氢 ⑩硫酸溶液,上述物质中能导电且属于电解质的是___________ ,属于混合物的是___________ (填编号)
(2)按要求进行化学计算:
①在同温、同压、同体积的条件下, 与某气体A的质量之比是1:16,则A的摩尔质量为
与某气体A的质量之比是1:16,则A的摩尔质量为___________ 。
②一定量的Al、Mg混合物加入一定物质的量浓度、一定体积的盐酸溶液中恰好完全反应,放出标况下11.2L气体,再向溶液中加入 氢氧化钠溶液恰好使溶液中金属阳离子完全沉淀,则需要氢氧化钠溶液的体积为
氢氧化钠溶液恰好使溶液中金属阳离子完全沉淀,则需要氢氧化钠溶液的体积为___________ mL。
③相同体积的 、
、 、
、 溶液,分别与足量的
溶液,分别与足量的 溶液反应,当生成的
溶液反应,当生成的 质量相同时,则三种溶液的物质的量浓度之比为
质量相同时,则三种溶液的物质的量浓度之比为___________ 。
(3)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为
①配平该反应:_______

②当有32g硫单质完全反应时,生成氧化产物的物质的量是___________ mol。
(1)①石墨 ②苛性钠 ③石灰乳 ④熔融氯化钾 ⑤盐酸 ⑥氨气 ⑦蔗糖 ⑧铁⑨液态氯化氢 ⑩硫酸溶液,上述物质中能导电且属于电解质的是
(2)按要求进行化学计算:
①在同温、同压、同体积的条件下,
 与某气体A的质量之比是1:16,则A的摩尔质量为
与某气体A的质量之比是1:16,则A的摩尔质量为②一定量的Al、Mg混合物加入一定物质的量浓度、一定体积的盐酸溶液中恰好完全反应,放出标况下11.2L气体,再向溶液中加入
 氢氧化钠溶液恰好使溶液中金属阳离子完全沉淀,则需要氢氧化钠溶液的体积为
氢氧化钠溶液恰好使溶液中金属阳离子完全沉淀,则需要氢氧化钠溶液的体积为③相同体积的
 、
、 、
、 溶液,分别与足量的
溶液,分别与足量的 溶液反应,当生成的
溶液反应,当生成的 质量相同时,则三种溶液的物质的量浓度之比为
质量相同时,则三种溶液的物质的量浓度之比为(3)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为

①配平该反应:

②当有32g硫单质完全反应时,生成氧化产物的物质的量是
您最近一年使用:0次
名校
解题方法
7 . 请根据物质的量的相关概念及计算公式,完成下列各题:
(1)请填写下表:
(2)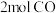 与
与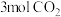 的质量之比
的质量之比__________ ;分子数之比为__________ ;含氧原子的数目之比为__________ 。
(3)将含杂质软锰矿粉末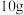 与足量浓盐酸共热(杂质不与盐酸反应),完全反应后,制得
与足量浓盐酸共热(杂质不与盐酸反应),完全反应后,制得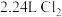 (标准状况下)。请回答下列问题:
(标准状况下)。请回答下列问题:
反应中被氧化的 的物质的量为
的物质的量为__________ mol,软锰矿中 的质量分数为
的质量分数为__________ 。
(1)请填写下表:
物质 | 摩尔质量 | 物质的量 | 质量 | 分子或离子数目 |
|
| |||
|
|
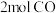 与
与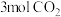 的质量之比
的质量之比(3)将含杂质软锰矿粉末
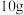 与足量浓盐酸共热(杂质不与盐酸反应),完全反应后,制得
与足量浓盐酸共热(杂质不与盐酸反应),完全反应后,制得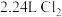 (标准状况下)。请回答下列问题:
(标准状况下)。请回答下列问题:反应中被氧化的
 的物质的量为
的物质的量为 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
8 . 完成下列计算:
(1)已知工业上制取硫酸需要发生以下反应
Ⅰ. ;Ⅱ.
;Ⅱ.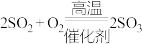 ;Ⅲ.
;Ⅲ.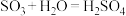
①假设在生产中所有反应完全进行,则每生产1.00吨98%的浓硫酸需要
______ 吨。(保留2位小数)
②实际生产中可能会有损耗(即存在反应物没有发生反应),假设反应Ⅰ中 损耗率为20%,反应Ⅱ中
损耗率为20%,反应Ⅱ中 损耗率为10%,则实际生产1吨98%浓硫酸需要
损耗率为10%,则实际生产1吨98%浓硫酸需要
______ 吨。(保留2位小数)
(2)取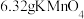 固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为
固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为 。
。
① 分解生成氧气的物质的量
分解生成氧气的物质的量
______ mol
② 分解的百分率为
分解的百分率为______ %;
③第二步反应中生成氯气的物质的量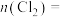
______ mol
(1)已知工业上制取硫酸需要发生以下反应
Ⅰ.
 ;Ⅱ.
;Ⅱ.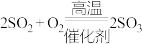 ;Ⅲ.
;Ⅲ.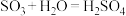
①假设在生产中所有反应完全进行,则每生产1.00吨98%的浓硫酸需要

②实际生产中可能会有损耗(即存在反应物没有发生反应),假设反应Ⅰ中
 损耗率为20%,反应Ⅱ中
损耗率为20%,反应Ⅱ中 损耗率为10%,则实际生产1吨98%浓硫酸需要
损耗率为10%,则实际生产1吨98%浓硫酸需要
(2)取
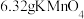 固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为
固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为 。
。①
 分解生成氧气的物质的量
分解生成氧气的物质的量
②
 分解的百分率为
分解的百分率为③第二步反应中生成氯气的物质的量
您最近一年使用:0次
2023-11-06更新
|
175次组卷
|
2卷引用:浙江省杭州第二中学2023-2024学年高一上学期期中考试化学试题
名校
9 . 完成下列有关物质的量的相关计算
(1)等质量的NH3和CH4,分子个数比为___________ ,同温同压下,等体积的CO2和O2密度比为___________ 。
(2)S燃烧时有SO2生成,其原理为:S+O2 SO2,若转移2.408×1024个电子,则生成的SO2的物质的量是
SO2,若转移2.408×1024个电子,则生成的SO2的物质的量是___________ 。
(3)在标准状况下,224mL CO2恰好与20mL NaOH溶液反应生成NaHCO3,则此NaOH溶液中n(NaOH)为___________ 。
(4)氢气是一种清洁能源,甲烷制氢的化学方程式为CH4+O2=CO2+2H2.在标准状况下,CH4与一定量的O2中恰好完全反应,反应后测得生成物的体积是672mL,则生成H2___________ mol,消耗的O2的体积是___________ 。
(1)等质量的NH3和CH4,分子个数比为
(2)S燃烧时有SO2生成,其原理为:S+O2
 SO2,若转移2.408×1024个电子,则生成的SO2的物质的量是
SO2,若转移2.408×1024个电子,则生成的SO2的物质的量是(3)在标准状况下,224mL CO2恰好与20mL NaOH溶液反应生成NaHCO3,则此NaOH溶液中n(NaOH)为
(4)氢气是一种清洁能源,甲烷制氢的化学方程式为CH4+O2=CO2+2H2.在标准状况下,CH4与一定量的O2中恰好完全反应,反应后测得生成物的体积是672mL,则生成H2
您最近一年使用:0次
名校
解题方法
10 . 氮的化合物是化学研究的热点之一,请回答下列问题:
(1)汽车尾气中的 、
、 在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出
在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出 被
被 还原的化学方程式
还原的化学方程式_______ ,并用双线桥法标出电子转移的方向和数目。
(2)氮氧化物是造成雾霾天气的主要原因之一,利用 和
和 的溶液处理氮氧化物的反应过程如下:
的溶液处理氮氧化物的反应过程如下:
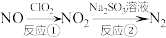
反应①的化学方程式是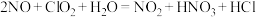 ,反应②的离子方程式是
,反应②的离子方程式是_______ ;若有1.4g 生成,需消耗
生成,需消耗
_______ g。
亚硝酸钠有咸味,有毒。已知: 。
。
(3)上述反应的还原剂为_______ (填化学式);若反应中有1分子 气体生成,则转移电子的数目为
气体生成,则转移电子的数目为_______ 。
(4)在酸性条件下,高锰酸钾可将 氧化为
氧化为 ,所得溶液中锰元素仅以
,所得溶液中锰元素仅以 形式存在,写出此反应的离子方程式:
形式存在,写出此反应的离子方程式:_______ 。
(1)汽车尾气中的
 、
、 在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出
在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出 被
被 还原的化学方程式
还原的化学方程式(2)氮氧化物是造成雾霾天气的主要原因之一,利用
 和
和 的溶液处理氮氧化物的反应过程如下:
的溶液处理氮氧化物的反应过程如下: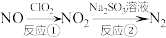
反应①的化学方程式是
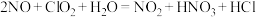 ,反应②的离子方程式是
,反应②的离子方程式是 生成,需消耗
生成,需消耗
亚硝酸钠有咸味,有毒。已知:
 。
。(3)上述反应的还原剂为
 气体生成,则转移电子的数目为
气体生成,则转移电子的数目为(4)在酸性条件下,高锰酸钾可将
 氧化为
氧化为 ,所得溶液中锰元素仅以
,所得溶液中锰元素仅以 形式存在,写出此反应的离子方程式:
形式存在,写出此反应的离子方程式:
您最近一年使用:0次
2023-10-15更新
|
228次组卷
|
2卷引用:陕西省西北工业大学附属中学2023-2024学年高一上学期第一次月考化学试题