名校
1 . 完成下列有关物质的量的相关计算
(1)等质量的NH3和CH4,分子个数比为___________ ,同温同压下,等体积的CO2和O2密度比为___________ 。
(2)S燃烧时有SO2生成,其原理为:S+O2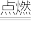 SO2,若转移2.408×1024个电子,则生成的SO2的物质的量是
SO2,若转移2.408×1024个电子,则生成的SO2的物质的量是___________ 。
(3)在标准状况下,224mL CO2恰好与20mL NaOH溶液反应生成NaHCO3,则此NaOH溶液中n(NaOH)为___________ 。
(4)氢气是一种清洁能源,甲烷制氢的化学方程式为CH4+O2=CO2+2H2.在标准状况下,CH4与一定量的O2中恰好完全反应,反应后测得生成物的体积是672mL,则生成H2___________ mol,消耗的O2的体积是___________ 。
(1)等质量的NH3和CH4,分子个数比为
(2)S燃烧时有SO2生成,其原理为:S+O2
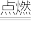 SO2,若转移2.408×1024个电子,则生成的SO2的物质的量是
SO2,若转移2.408×1024个电子,则生成的SO2的物质的量是(3)在标准状况下,224mL CO2恰好与20mL NaOH溶液反应生成NaHCO3,则此NaOH溶液中n(NaOH)为
(4)氢气是一种清洁能源,甲烷制氢的化学方程式为CH4+O2=CO2+2H2.在标准状况下,CH4与一定量的O2中恰好完全反应,反应后测得生成物的体积是672mL,则生成H2
您最近一年使用:0次
名校
解题方法
2 . 氮的化合物是化学研究的热点之一,请回答下列问题:
(1)汽车尾气中的 、
、 在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出
在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出 被
被 还原的化学方程式
还原的化学方程式_______ ,并用双线桥法标出电子转移的方向和数目。
(2)氮氧化物是造成雾霾天气的主要原因之一,利用 和
和 的溶液处理氮氧化物的反应过程如下:
的溶液处理氮氧化物的反应过程如下:
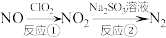
反应①的化学方程式是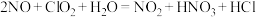 ,反应②的离子方程式是
,反应②的离子方程式是_______ ;若有1.4g 生成,需消耗
生成,需消耗
_______ g。
亚硝酸钠有咸味,有毒。已知: 。
。
(3)上述反应的还原剂为_______ (填化学式);若反应中有1分子 气体生成,则转移电子的数目为
气体生成,则转移电子的数目为_______ 。
(4)在酸性条件下,高锰酸钾可将 氧化为
氧化为 ,所得溶液中锰元素仅以
,所得溶液中锰元素仅以 形式存在,写出此反应的离子方程式:
形式存在,写出此反应的离子方程式:_______ 。
(1)汽车尾气中的
 、
、 在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出
在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出 被
被 还原的化学方程式
还原的化学方程式(2)氮氧化物是造成雾霾天气的主要原因之一,利用
 和
和 的溶液处理氮氧化物的反应过程如下:
的溶液处理氮氧化物的反应过程如下: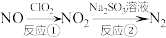
反应①的化学方程式是
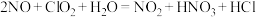 ,反应②的离子方程式是
,反应②的离子方程式是 生成,需消耗
生成,需消耗
亚硝酸钠有咸味,有毒。已知:
 。
。(3)上述反应的还原剂为
 气体生成,则转移电子的数目为
气体生成,则转移电子的数目为(4)在酸性条件下,高锰酸钾可将
 氧化为
氧化为 ,所得溶液中锰元素仅以
,所得溶液中锰元素仅以 形式存在,写出此反应的离子方程式:
形式存在,写出此反应的离子方程式:
您最近一年使用:0次
2023-10-15更新
|
234次组卷
|
2卷引用:陕西省西北工业大学附属中学2023-2024学年高一上学期第一次月考化学试题
名校
解题方法
3 . 移取20.00 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。
已知:
① 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;
② 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化
(1)加入 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为_______ 。
(2)酸化后 歧化发生离子反应方程式为
歧化发生离子反应方程式为_______ 。
(3)加入 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为_______ 。
(4)则溶液中的 的浓度为
的浓度为_______ ; 的浓度为
的浓度为_______ 。
(5)若溶液酸化后将 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将_______ (填“偏大”、“偏小”或“不变”)。
 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。已知:
①
 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;②
 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化(1)加入
 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为(2)酸化后
 歧化发生离子反应方程式为
歧化发生离子反应方程式为(3)加入
 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为(4)则溶液中的
 的浓度为
的浓度为 的浓度为
的浓度为(5)若溶液酸化后将
 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将
您最近一年使用:0次
4 . 工业上通常采用将氯气通入消石灰或石灰乳的方法制取漂白粉。消石灰要含略少于1%(质量分数)的水,因为极为干燥的消石灰是不跟氯气反应的。生产漂白粉的反应过程比较复杂,可发生如下反应:
①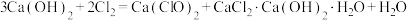 ;
;
②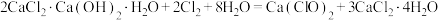 。
。
回答下列问题:
(1) 的摩尔质量为
的摩尔质量为__________ , 中质量分数最大的元素为
中质量分数最大的元素为__________ (填元素符号)。
(2)所含氢原子总数为 的
的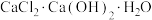 的物质的量为
的物质的量为__________ ,该化合物中Ca元素的物质的量为__________ 。
(3)反应②中,每转移 电子,此时消耗
电子,此时消耗 的体积约为
的体积约为__________ (标准状况下)。
(4)同温同压下,氯化氢与氯气两种气体的密度之比为__________ 。
①
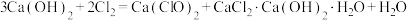 ;
;②
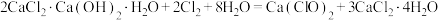 。
。回答下列问题:
(1)
 的摩尔质量为
的摩尔质量为 中质量分数最大的元素为
中质量分数最大的元素为(2)所含氢原子总数为
 的
的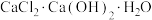 的物质的量为
的物质的量为(3)反应②中,每转移
 电子,此时消耗
电子,此时消耗 的体积约为
的体积约为(4)同温同压下,氯化氢与氯气两种气体的密度之比为
您最近一年使用:0次
5 . 完成下列问题
(1)已知20℃下,饱和食盐水的质量分数为26.5%,密度为1.17 g/mL,则该饱和食盐水的物质的量浓度为___________ mol/L。
(2)向27.2 g由Fe和Fe2O3组成的固体混合物加入2L一定浓度的稀硫酸后固体恰好溶解,可收集到标准状况下气体2.24 L,再向反应后的溶液中滴入KSCN溶液,无明显现象。(忽略反应前后溶液的体积变化),反应后溶液中FeSO4的物质的量浓度为___________ 。
(3) 溶液与1.95g锌粉在量热计中充分反应。已知:反应
溶液与1.95g锌粉在量热计中充分反应。已知:反应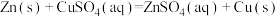 的
的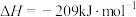 ,反应前后,溶液的比热容均近似为
,反应前后,溶液的比热容均近似为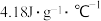 、溶液的密度均近似为
、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为
,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为___________ ℃。
(1)已知20℃下,饱和食盐水的质量分数为26.5%,密度为1.17 g/mL,则该饱和食盐水的物质的量浓度为
(2)向27.2 g由Fe和Fe2O3组成的固体混合物加入2L一定浓度的稀硫酸后固体恰好溶解,可收集到标准状况下气体2.24 L,再向反应后的溶液中滴入KSCN溶液,无明显现象。(忽略反应前后溶液的体积变化),反应后溶液中FeSO4的物质的量浓度为
(3)
 溶液与1.95g锌粉在量热计中充分反应。已知:反应
溶液与1.95g锌粉在量热计中充分反应。已知:反应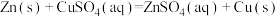 的
的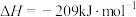 ,反应前后,溶液的比热容均近似为
,反应前后,溶液的比热容均近似为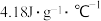 、溶液的密度均近似为
、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为
,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为
您最近一年使用:0次
6 . 钠及其化合物在生产和生活中有广泛的应用。钠钾合金可用作核反应堆的传热介质。 钠钾合金溶于
钠钾合金溶于 水,生成氢气的(在标准状况下)体积为
水,生成氢气的(在标准状况下)体积为 ;
;
(1)该过程中转移的电子数目为_______ 个。
(2)确定该钠钾合金的组成(用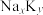 的形式表示):
的形式表示):_______ 。
(3)如果所得溶液的体积仍为 ,则溶液中
,则溶液中 的物质的量浓度为
的物质的量浓度为_______ 。
 钠钾合金溶于
钠钾合金溶于 水,生成氢气的(在标准状况下)体积为
水,生成氢气的(在标准状况下)体积为 ;
;(1)该过程中转移的电子数目为
(2)确定该钠钾合金的组成(用
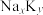 的形式表示):
的形式表示):(3)如果所得溶液的体积仍为
 ,则溶液中
,则溶液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
名校
解题方法
7 . 在空气中灼烧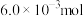 的
的 ,完全转化为
,完全转化为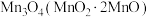 ,将其溶解于
,将其溶解于 溶有
溶有 的稀
的稀 溶液中,锰被还原为+2价。过量的
溶液中,锰被还原为+2价。过量的 需要
需要 的
的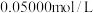 的
的 滴定,计算实验加入的
滴定,计算实验加入的 的质量(注:
的质量(注: 的相对分子质量为392)
的相对分子质量为392) _______ 。
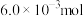 的
的 ,完全转化为
,完全转化为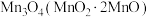 ,将其溶解于
,将其溶解于 溶有
溶有 的稀
的稀 溶液中,锰被还原为+2价。过量的
溶液中,锰被还原为+2价。过量的 需要
需要 的
的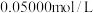 的
的 滴定,计算实验加入的
滴定,计算实验加入的 的质量(注:
的质量(注: 的相对分子质量为392)
的相对分子质量为392)
您最近一年使用:0次
名校
解题方法
8 . 在标准状况下,将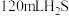 和
和 的混合气体点燃,若原混合气体中
的混合气体点燃,若原混合气体中 为
为 ,反应后得到的气体总体积为
,反应后得到的气体总体积为 ,求:
,求:
(1)当x在不同范围内时,y与x的函数关系是___________ 。
(2)当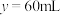 时,原气体中
时,原气体中 可能是
可能是___________ 。
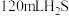 和
和 的混合气体点燃,若原混合气体中
的混合气体点燃,若原混合气体中 为
为 ,反应后得到的气体总体积为
,反应后得到的气体总体积为 ,求:
,求:(1)当x在不同范围内时,y与x的函数关系是
(2)当
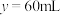 时,原气体中
时,原气体中 可能是
可能是
您最近一年使用:0次
名校
解题方法
9 . 计算
(1)已知酸性条件下, 可将
可将 还原为
还原为 。将标准状况下
。将标准状况下 的
的 气体通入足量酸性
气体通入足量酸性 溶液中,
溶液中,
①写出该反应的离子方程式______ 。
②被还原的 的质量为
的质量为______ 。
(2)为了检验某含有 杂质的
杂质的 样品的纯度,现将
样品的纯度,现将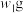 样品充分加热,当固体质量不再变化时,再次称量固体质量为
样品充分加热,当固体质量不再变化时,再次称量固体质量为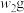 ,则该样品的纯度(质量分数)为
,则该样品的纯度(质量分数)为______ (用含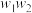 的代数式来表示)。
的代数式来表示)。
(3)有一块表面氧化成氧化钠的金属钠,总质量为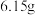 ,投入到足量水中,待充分反应后收集到氢气
,投入到足量水中,待充分反应后收集到氢气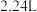 (标准状况下),求未被氧化前金属钠质量是多少?写出计算过程
(标准状况下),求未被氧化前金属钠质量是多少?写出计算过程_____ 。
(1)已知酸性条件下,
 可将
可将 还原为
还原为 。将标准状况下
。将标准状况下 的
的 气体通入足量酸性
气体通入足量酸性 溶液中,
溶液中,①写出该反应的离子方程式
②被还原的
 的质量为
的质量为(2)为了检验某含有
 杂质的
杂质的 样品的纯度,现将
样品的纯度,现将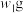 样品充分加热,当固体质量不再变化时,再次称量固体质量为
样品充分加热,当固体质量不再变化时,再次称量固体质量为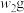 ,则该样品的纯度(质量分数)为
,则该样品的纯度(质量分数)为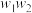 的代数式来表示)。
的代数式来表示)。(3)有一块表面氧化成氧化钠的金属钠,总质量为
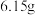 ,投入到足量水中,待充分反应后收集到氢气
,投入到足量水中,待充分反应后收集到氢气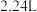 (标准状况下),求未被氧化前金属钠质量是多少?写出计算过程
(标准状况下),求未被氧化前金属钠质量是多少?写出计算过程
您最近一年使用:0次
解题方法
10 . SO2在生产生活中有重要的应用,处理不当会造成环境污染。回答下列问题:
(1)标准状况下16.0gSO2的体积为______ L,与______ molH2O中所含氧原子数相等。
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。
①该反应中被还原的元素是_____ 。
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为______ 。
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为______ g•m-3(用含a的表达式表示,假定样品中其它气体均不参与反应,SO2可被溶液充分吸收)。
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_____ ;需用量筒量取密度为1.84g•cm-3,质量分数为98%的浓硫酸_____ mL;若定容时俯视刻度线,则所配溶液的浓度______ (填“偏高”、“偏低”或“不变”)。
(1)标准状况下16.0gSO2的体积为
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO
 +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。①该反应中被还原的元素是
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
您最近一年使用:0次



