解题方法
1 . 二氯异氰尿酸钠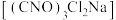 ,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和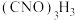 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(1)装置B中试剂为______ ,装置D中,盛放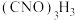 吡啶溶液的仪器名称为
吡啶溶液的仪器名称为______ 。
(2) 的制备步骤如下:
的制备步骤如下:
①检查装置气密性后加入药品。
②关闭 ,打开
,打开 ,向A中滴加足量的浓盐酸,当观察到
,向A中滴加足量的浓盐酸,当观察到______ 时,关闭 ,滴入
,滴入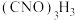 的吡啶溶液,写出
的吡啶溶液,写出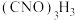 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式______ ,制备过程中要不断通入 ,其目的是
,其目的是______ ,反应完成后需进行的操作为______
③取装置D中溶液,制得产品。操作为______ 、过滤、冷水洗涤、低温干燥得到粗产品
(3)粗产品中 纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml
纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml 溶液(过量),加入几滴稀
溶液(过量),加入几滴稀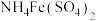 溶液,用
溶液,用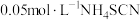 标准溶液滴定至终点,消耗10.00mL标准液。[已知
标准溶液滴定至终点,消耗10.00mL标准液。[已知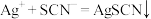 (白色)]
(白色)]
① 的纯度为
的纯度为______ 。
②下列有关上述滴定操作的说法正确的是______ 。
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放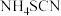 标准溶液的滴定管没有润洗,使测定结果偏大
标准溶液的滴定管没有润洗,使测定结果偏大
c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
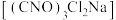 ,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和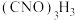 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示: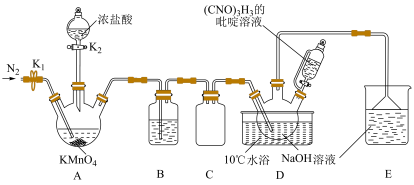
(1)装置B中试剂为
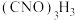 吡啶溶液的仪器名称为
吡啶溶液的仪器名称为(2)
 的制备步骤如下:
的制备步骤如下:①检查装置气密性后加入药品。
②关闭
 ,打开
,打开 ,向A中滴加足量的浓盐酸,当观察到
,向A中滴加足量的浓盐酸,当观察到 ,滴入
,滴入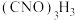 的吡啶溶液,写出
的吡啶溶液,写出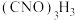 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式 ,其目的是
,其目的是③取装置D中溶液,制得产品。操作为
(3)粗产品中
 纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml
纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml 溶液(过量),加入几滴稀
溶液(过量),加入几滴稀 溶液,用
溶液,用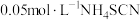 标准溶液滴定至终点,消耗10.00mL标准液。[已知
标准溶液滴定至终点,消耗10.00mL标准液。[已知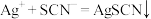 (白色)]
(白色)]①
 的纯度为
的纯度为②下列有关上述滴定操作的说法正确的是
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放
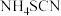 标准溶液的滴定管没有润洗,使测定结果偏大
标准溶液的滴定管没有润洗,使测定结果偏大c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
您最近一年使用:0次
名校
解题方法
2 . 镓、锗都是重要的半导体原材料,利用锌浸出渣(主要成分有ZnO、Ga2O3、GeO2、还有FeO、Fe2O3、Bi2O3等杂质)制备镓和锗的流程如下:
Ⅱ.该工艺条件下,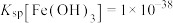 ,
,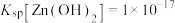
Ⅲ.镓与铝的性质相似,但高纯度的镓难溶于酸或碱。
回答下列问题:
(1)“浸渣”的主要成分为___________ 。
(2)“降铁浓缩”中 为
为 ,则除
,则除 时应控制pH的范围是
时应控制pH的范围是___________ (已知:当溶液中某离子浓度小于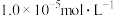 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(3)若用H2R表示单宁酸,“沉锗”的反应原理为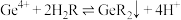 ,该操作中需调节pH为2.5,不能过高或过低,原因是
,该操作中需调节pH为2.5,不能过高或过低,原因是___________ 。
(4)HGaCl4与过量氢氧化钠反应的化学方程式为___________ 。“电解”得到单质镓,阴极的电极反应为___________ 。
(5)步骤①—③目的为___________ ,“还原”过程中参与反应的H2体积为89.6 L(标准状况下),则理论上步骤①中消耗SOCl2物质的量为___________ 。

Ⅱ.该工艺条件下,
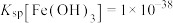 ,
,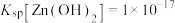
Ⅲ.镓与铝的性质相似,但高纯度的镓难溶于酸或碱。
回答下列问题:
(1)“浸渣”的主要成分为
(2)“降铁浓缩”中
 为
为 ,则除
,则除 时应控制pH的范围是
时应控制pH的范围是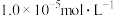 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(3)若用H2R表示单宁酸,“沉锗”的反应原理为
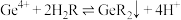 ,该操作中需调节pH为2.5,不能过高或过低,原因是
,该操作中需调节pH为2.5,不能过高或过低,原因是(4)HGaCl4与过量氢氧化钠反应的化学方程式为
(5)步骤①—③目的为
您最近一年使用:0次
2024-05-15更新
|
137次组卷
|
3卷引用:2024届山东省济宁市高三下学期高考二模化学试题
名校
解题方法
3 . 钽(Ta)和铌(Nb)的性质相似,因此常常共生于自然界的矿物中。一种以钽铌伴生矿(主要成分为SiO2、MnO2、Nb2O5、Ta2O5和少量的TiO2、FeO、CaO、MgO)为原料制取钽和铌的流程如下:
已知:①MIBK为甲基异丁基酮;
②KspCaF2=2.510-11,KspMgF2=6.410-9
(1)“浸取”时通常在_____材料的反应器中进行(填标号)。
(2)浸渣的主要成分是_____ ,Ta2O5与氢氟酸反应的离子方程式为_____ 。
(3)“浸取”时,HF的浓度对铌、钽的浸出率的影响如下图所示,则HF的最佳浓度为_____ 。
①流程中钠热还原法制备铌粉的化学方程式为_____ 。
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,电解总化学反应方程式为_____ 。
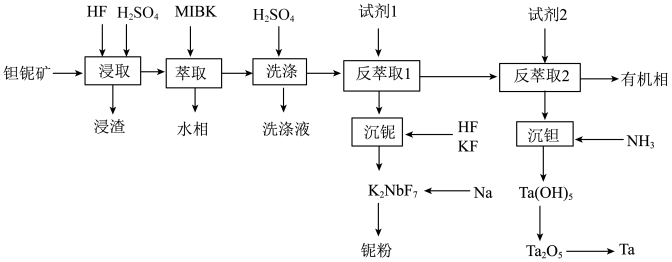
已知:①MIBK为甲基异丁基酮;
②KspCaF2=2.510-11,KspMgF2=6.410-9
(1)“浸取”时通常在_____材料的反应器中进行(填标号)。
| A.陶瓷 | B.玻璃 | C.铅 | D.塑料 |
(2)浸渣的主要成分是
(3)“浸取”时,HF的浓度对铌、钽的浸出率的影响如下图所示,则HF的最佳浓度为

①流程中钠热还原法制备铌粉的化学方程式为
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,电解总化学反应方程式为
您最近一年使用:0次
名校
解题方法
4 . 回收利用废旧锂离子电池正极材料钴酸锂粗品来制备 产品,可实现资源的循环利用。其工艺流程如下。
产品,可实现资源的循环利用。其工艺流程如下。

已知:①氯化胆碱 是铵盐,熔点较低:
是铵盐,熔点较低: 熔点较高。
熔点较高。
② 在溶液中常以
在溶液中常以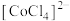 (蓝色)和
(蓝色)和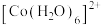 (粉红色)形式存在。
(粉红色)形式存在。
③常温下, 。
。
回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入NaCl溶液中,其目的是___________ 。
(2)“水浸”过程中溶液由蓝色逐渐变为粉红色,则“微波共熔”后获得的含Li、Co的化合物为___________ (填化学式)。“微波共熔”中氯化胆碱的作用是___________ 。
(3)“沉钴”过程发生反应的离子方程式为___________ 。常温下,钴离子恰好沉淀完全时溶液的
___________ [当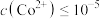 mol⋅L
mol⋅L 时可认为离子沉淀完全]。
时可认为离子沉淀完全]。
(4)“煅烧”过程生成 ,则消耗的
,则消耗的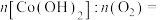
___________ 。
(5)“高温烧结”发生反应的化学方程式为___________ 。
 产品,可实现资源的循环利用。其工艺流程如下。
产品,可实现资源的循环利用。其工艺流程如下。
已知:①氯化胆碱
 是铵盐,熔点较低:
是铵盐,熔点较低: 熔点较高。
熔点较高。②
 在溶液中常以
在溶液中常以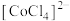 (蓝色)和
(蓝色)和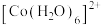 (粉红色)形式存在。
(粉红色)形式存在。③常温下,
 。
。回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入NaCl溶液中,其目的是
(2)“水浸”过程中溶液由蓝色逐渐变为粉红色,则“微波共熔”后获得的含Li、Co的化合物为
(3)“沉钴”过程发生反应的离子方程式为

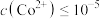 mol⋅L
mol⋅L 时可认为离子沉淀完全]。
时可认为离子沉淀完全]。(4)“煅烧”过程生成
 ,则消耗的
,则消耗的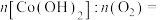
(5)“高温烧结”发生反应的化学方程式为
您最近一年使用:0次
5 . 从废旧磷酸铁锂电极材料(LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图,下列说法错误的是
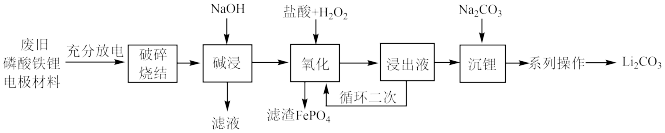
| A.旧电池拆解前进行充分放电是因为放电可使Li+在负极富集 |
| B.“氧化”时,H2O2可用KClO3代替 |
| C.“氧化”时发生的化学反应方程式为:2LiFePO4+H2O2+2HCl=2LiCl+2FePO4+2H2O |
| D.“系列操作”具体包括水浴加热、趁热过滤、洗涤、干燥 |
您最近一年使用:0次
解题方法
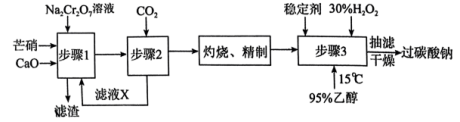
6 . 氧泡泡是一种多功能新型漂白剂,其有效成分是过碳酸钠(xNa2CO3•yH2O2)。
I.以芒硝(Na2SO4•10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如图:
Ⅱ.测定过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
①用电子天平称取两份质量均为mg的样品。
②将一份置于锥形瓶中,加水溶解,加催化剂使H2O2充分快速分解(催化剂不参与其它反应),然后加酚酞作指示剂,用0.0500mol•L-1H2SO4溶液滴定至终点,消耗硫酸V1mL。
③将另一份置于碘量瓶中,加入50mL蒸馏水,并立即加入6mL2.0mol•L-1H3PO4溶液,再加入过量KI固体,摇匀后于暗处放置10min,加入适量指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V2mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
过碳酸钠制备的流程中,下列说法错误的是
I.以芒硝(Na2SO4•10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如图:

Ⅱ.测定过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
①用电子天平称取两份质量均为mg的样品。
②将一份置于锥形瓶中,加水溶解,加催化剂使H2O2充分快速分解(催化剂不参与其它反应),然后加酚酞作指示剂,用0.0500mol•L-1H2SO4溶液滴定至终点,消耗硫酸V1mL。
③将另一份置于碘量瓶中,加入50mL蒸馏水,并立即加入6mL2.0mol•L-1H3PO4溶液,再加入过量KI固体,摇匀后于暗处放置10min,加入适量指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V2mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
过碳酸钠制备的流程中,下列说法错误的是
| A.步骤1中2mol芒硝参与反应时,消耗1molNa2Cr2O7 |
| B.滤渣的主要成分为CaSO4 |
C.步骤2的方程式为2Na2CrO4+2CO2+H2O Na2Cr2O7+2NaHCO3↓ Na2Cr2O7+2NaHCO3↓ |
| D.稳定剂的作用是阻止微量杂质金属离子的催化作用,减少双氧水的分解 |
您最近一年使用:0次
解题方法
7 . NaBH4是常用络合型氢化物,常温下为白色结晶粉末,具有吸湿性,在干燥空气中可以稳定存在,溶于水、液氨、胺类等。制备方法:
步骤1酯化 反应装置内按化学计量加入H3BO3和CH3OH,在54℃回流2h之后,开始收集B(OCH3)3(硼酸三甲酯)与CH3OH的共沸物,控制温度54℃~55℃。共沸液经硫酸酸洗后进行精馏,得到硼酸三甲酯
步骤2氢化 将金属钠分散于石蜡油中,通入氢气合成氢化钠
步骤3缩合 硼酸三甲酯和氢化钠在石蜡油介质中反应合成硼氢化钠,将物料冷却至100℃以下,进行离心分离得到硼氢化钠滤饼粗品。
步骤4水解 将上述硼氢化钠滤饼粗品置于容器中加水,发生反应NaOCH3+H2O=NaOH+CH3OH;将此水溶液离心分离,清液送入分层器,静置1h后分层。得到硼氢化钠碱性水溶液。
(1)已知电负性B<H,硼氢化钠与水反应生成NaBO2,反应的化学方程式为______ 。
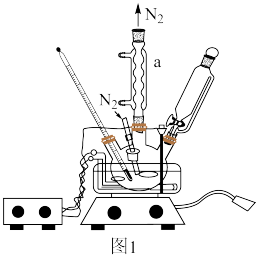
(2)步骤1中,硫酸的作用_______ ,步骤3可在如图1所示装置中进行,仪器a的名称______ ,反应进行前通入氮气的目的是_______ ,步骤4中,硼氢化钠能够稳定存在的原因______ 。
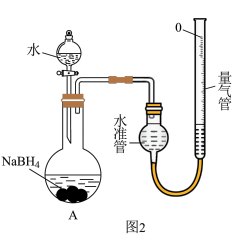
(3)NaBH4溶液浓度可采用如下方法测定(装置如图2所示):25℃,常压下,用移液管移取2.00mL的)NaBH4溶液于烧瓶中,记录量气管起始体积读数V1mL,加入液体,反应结束后调整量气管,记录读数为V2mL。NaBH4的浓度为______ (用含V1、V2的代数式表达)。
注:25℃,常压下气体摩尔体积约为24.5L•mol-1。______ (填“偏大”、“偏小”或“无影响”),需要将量气管慢慢______ 移动(填“向上”或“向下”)。
步骤1酯化 反应装置内按化学计量加入H3BO3和CH3OH,在54℃回流2h之后,开始收集B(OCH3)3(硼酸三甲酯)与CH3OH的共沸物,控制温度54℃~55℃。共沸液经硫酸酸洗后进行精馏,得到硼酸三甲酯
步骤2氢化 将金属钠分散于石蜡油中,通入氢气合成氢化钠
步骤3缩合 硼酸三甲酯和氢化钠在石蜡油介质中反应合成硼氢化钠,将物料冷却至100℃以下,进行离心分离得到硼氢化钠滤饼粗品。
步骤4水解 将上述硼氢化钠滤饼粗品置于容器中加水,发生反应NaOCH3+H2O=NaOH+CH3OH;将此水溶液离心分离,清液送入分层器,静置1h后分层。得到硼氢化钠碱性水溶液。
| pH值 | t/℃ | ||||
| 0 | 25 | 50 | 75 | 100 | |
| 8 | 3.0×10-3 | 4.3×10-5 | 6.0×10-5 | 8.5×10-6 | 1.2×10-6 |
| 10 | 3.0×10-1 | 4.3×10-2 | 6.0×10-3 | 8.5×10-4 | 1.2×10-4 |
| 12 | 3.0×101 | 4.3×100 | 6.0×10-1 | 8.5×10-2 | 1.2×10-2 |
| 14 | 3.0×103 | 4.3×102 | 6.0×101 | 8.5×100 | 1.2×100 |
(1)已知电负性B<H,硼氢化钠与水反应生成NaBO2,反应的化学方程式为
(2)步骤1中,硫酸的作用
(3)NaBH4溶液浓度可采用如下方法测定(装置如图2所示):25℃,常压下,用移液管移取2.00mL的)NaBH4溶液于烧瓶中,记录量气管起始体积读数V1mL,加入液体,反应结束后调整量气管,记录读数为V2mL。NaBH4的浓度为
注:25℃,常压下气体摩尔体积约为24.5L•mol-1。
您最近一年使用:0次
解题方法
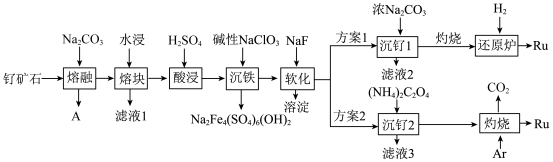
8 . 一种以钌矿石[主要含Ru(CO3)2还含少量的Al2O3、FeO、MgO、SiO2和CaO等]为原料制备钌(Ru)的流程如图,回答下列问题: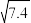 ≈2.7,
≈2.7, ≈3.9
≈3.9
②离子浓度等于或低于1×10-5mol•L-1时,则认为该离子已被完全除去。
(1)气体A的成分为______ ,滤液1中溶质为______ 。
(2)“沉铁”的离子方程式为______ 。
(3)“软化”时,溶液中钙离子和镁离子的浓度分别为0.01mol•L-1和0.02mol•L-1,常温下取2.0L该滤液,使其中Ca2+、Mg2+沉淀完全,则至少需要加入NaF的物质的量为______ 。
(4)“灼烧”时Ar的作用是______ 。
(5)产生相同量的钌,方案1中消耗H2与方案2中产生CO2的物质的量比值为______ ;从安全角度分析,方案2优于方案1,其理由是______ 。
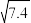 ≈2.7,
≈2.7, ≈3.9
≈3.9②离子浓度等于或低于1×10-5mol•L-1时,则认为该离子已被完全除去。
(1)气体A的成分为
(2)“沉铁”的离子方程式为
(3)“软化”时,溶液中钙离子和镁离子的浓度分别为0.01mol•L-1和0.02mol•L-1,常温下取2.0L该滤液,使其中Ca2+、Mg2+沉淀完全,则至少需要加入NaF的物质的量为
(4)“灼烧”时Ar的作用是
(5)产生相同量的钌,方案1中消耗H2与方案2中产生CO2的物质的量比值为
您最近一年使用:0次
2024-03-21更新
|
387次组卷
|
2卷引用:山东省济宁市2024届高三下学期一模考试化学试题
9 . 工业上常采用铬铁矿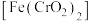 为主要原料制备红矾钠
为主要原料制备红矾钠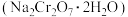 ,实验室模拟红矾钠的制备步骤如下,与相关步骤对应的叙述正确的是
,实验室模拟红矾钠的制备步骤如下,与相关步骤对应的叙述正确的是
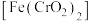 为主要原料制备红矾钠
为主要原料制备红矾钠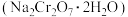 ,实验室模拟红矾钠的制备步骤如下,与相关步骤对应的叙述正确的是
,实验室模拟红矾钠的制备步骤如下,与相关步骤对应的叙述正确的是| 步骤 | 叙述 | |
| A | Ⅰ.煅烧:将难溶于水的铬铁矿在碱性介质中熔融煅烧,生成了可溶性的 | 熔融煅烧可在石英坩埚中进行,该反应中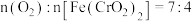 |
| B | Ⅱ.浸取:煅烧后的熟料成分比较复杂,含有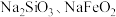 等,其中 等,其中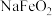 遇水强烈水解生成沉淀,浸取后可获得 遇水强烈水解生成沉淀,浸取后可获得 的浸取液 的浸取液 | 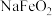 水解的化学方程式为: 水解的化学方程式为: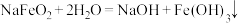 |
| C | Ⅲ.中和除杂、酸化:酸化可以使 转变为 转变为 | 酸化时可选用盐酸 |
| D | Ⅳ.结晶:结晶后得到橙红色晶体红矾钠 | 先蒸发浓缩、后降温结晶获得红矾钠 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 铊是一种有毒有害的重金属元素,对人体有较大的危害。湿法炼锌工业废水中的主要阳离子有 ,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水: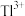 氧化性强于
氧化性强于 ,
, 为两性氧化物,溶液
为两性氧化物,溶液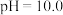 时开始溶解,常温下相关离子开始沉淀和沉淀完全时的
时开始溶解,常温下相关离子开始沉淀和沉淀完全时的 如表所示:
如表所示:
②萃取的反应原理为H++CH3CONR2+TlCl
 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4
请回答下列问题:
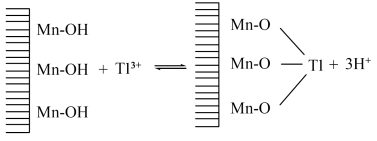
(1)“反应”步骤中总反应的离子方程式为___________ 。
(2)“滤渣”的主要成分是___________ (填化学式),通常在“分步沉淀”时加入絮凝剂,其目的是___________ 。
(3)请从化学平衡的角度解释“反萃取”过程中加入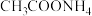 的原理和目的
的原理和目的___________ 。
(4)“分步沉淀”时,沉淀第二种离子时调节溶液 的范围为
的范围为___________ ,当其恰好完全沉淀,则溶液中先沉淀的离子浓度为___________ 。
(5)废水中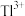 吸附过程如图所示,该树脂为
吸附过程如图所示,该树脂为___________ (填“阳离子”或“阴离子”)交换树脂,若使吸附剂再生,且回收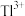 ,可将离子交换树脂浸入
,可将离子交换树脂浸入___________ 溶液。
a. b.
b. c.
c.
 ,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
 氧化性强于
氧化性强于 ,
, 为两性氧化物,溶液
为两性氧化物,溶液 时开始溶解,常温下相关离子开始沉淀和沉淀完全时的
时开始溶解,常温下相关离子开始沉淀和沉淀完全时的 如表所示:
如表所示: | 离子 |  |  | 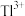 |
开始沉淀的 | 2.7 | 6.4 | 1.4 |
沉淀完全的 | 3.7 | 8.0 | 2.8 |

 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4请回答下列问题:
(1)“反应”步骤中总反应的离子方程式为
(2)“滤渣”的主要成分是
(3)请从化学平衡的角度解释“反萃取”过程中加入
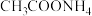 的原理和目的
的原理和目的(4)“分步沉淀”时,沉淀第二种离子时调节溶液
 的范围为
的范围为(5)废水中
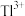 吸附过程如图所示,该树脂为
吸附过程如图所示,该树脂为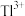 ,可将离子交换树脂浸入
,可将离子交换树脂浸入a.
 b.
b. c.
c.
您最近一年使用:0次
2024-01-13更新
|
849次组卷
|
4卷引用:山东省济宁市2023-2024学年高三上学期1月期末化学试题
山东省济宁市2023-2024学年高三上学期1月期末化学试题(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2024届陕西省西安中学高三下学期三模理综试题-高中化学(已下线)T27-工业流程题



