解题方法
1 . 高纯二硫化钼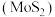 粉体被誉为“固体润滑之王”。由钼精矿(主要成分为
粉体被誉为“固体润滑之王”。由钼精矿(主要成分为 ,还有少量
,还有少量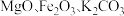 等)制备高纯
等)制备高纯 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)“焙烧”时生成 的化学方程式为
的化学方程式为___________ ;“水洗”的目的是___________ 。
(2)“转化”过程中,存在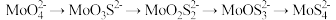 。
。
① 转化为
转化为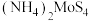 的化学方程式为
的化学方程式为___________ 。
②保持温度为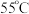 反应
反应 后,冷却至
后,冷却至 并静置
并静置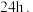 测得
测得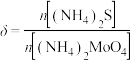 对
对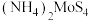 晶体产率的影响如图所示。
晶体产率的影响如图所示。 时,
时,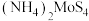 晶体产率为0的原因是
晶体产率为0的原因是___________ ; 时,
时,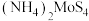 晶体产率继续增大的原因是
晶体产率继续增大的原因是___________ 。
(3)“酸浸”和“高温还原”中产生的气体可通入___________ (填操作单元的名称)中循环使用。
(4) 也可由
也可由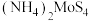 在一定条件下加热分解制得,同时产生
在一定条件下加热分解制得,同时产生 和某种硫单质,且
和某种硫单质,且 与硫单质的物质的量之比为
与硫单质的物质的量之比为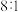 ,则硫单质的分子式为
,则硫单质的分子式为___________ 。
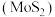 粉体被誉为“固体润滑之王”。由钼精矿(主要成分为
粉体被誉为“固体润滑之王”。由钼精矿(主要成分为 ,还有少量
,还有少量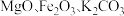 等)制备高纯
等)制备高纯 的一种工艺流程如图所示。
的一种工艺流程如图所示。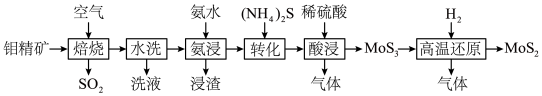
(1)“焙烧”时生成
 的化学方程式为
的化学方程式为(2)“转化”过程中,存在
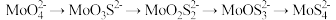 。
。①
 转化为
转化为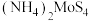 的化学方程式为
的化学方程式为②保持温度为
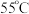 反应
反应 后,冷却至
后,冷却至 并静置
并静置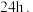 测得
测得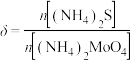 对
对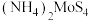 晶体产率的影响如图所示。
晶体产率的影响如图所示。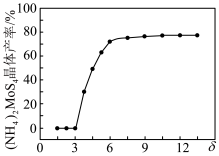
 时,
时,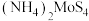 晶体产率为0的原因是
晶体产率为0的原因是 时,
时,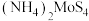 晶体产率继续增大的原因是
晶体产率继续增大的原因是(3)“酸浸”和“高温还原”中产生的气体可通入
(4)
 也可由
也可由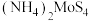 在一定条件下加热分解制得,同时产生
在一定条件下加热分解制得,同时产生 和某种硫单质,且
和某种硫单质,且 与硫单质的物质的量之比为
与硫单质的物质的量之比为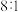 ,则硫单质的分子式为
,则硫单质的分子式为
您最近一年使用:0次
2 . 某小组研究 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。
已知:
ⅰ. 在强酸性溶液中被还原为
在强酸性溶液中被还原为 ,在中性或弱碱性溶液中被还原为
,在中性或弱碱性溶液中被还原为 。
。
ⅱ.单质硫可溶于 溶液,溶液呈淡黄色。
溶液,溶液呈淡黄色。
下列说法正确的是
 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。| 实验序号 | 实验过程 | 实验现象 |
| Ⅰ |
| 紫色变浅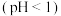 ,生成棕褐色沉淀 ,生成棕褐色沉淀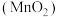 |
| Ⅱ |
| 溶液呈淡黄色 ,生成浅粉色沉淀 ,生成浅粉色沉淀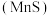 |
ⅰ.
 在强酸性溶液中被还原为
在强酸性溶液中被还原为 ,在中性或弱碱性溶液中被还原为
,在中性或弱碱性溶液中被还原为 。
。ⅱ.单质硫可溶于
 溶液,溶液呈淡黄色。
溶液,溶液呈淡黄色。下列说法正确的是
A.实验Ⅰ中检验出溶液中含有 ,说明 ,说明 被氧化为 被氧化为 |
B.实验Ⅰ中生成 的离子方程式为 的离子方程式为 |
C.实验Ⅱ中 被还原为 被还原为 ,继续与 ,继续与 反应生成 反应生成 |
| D.上述实验表明,试剂的滴加顺序和溶液酸碱性影响物质变化 |
您最近一年使用:0次
名校
解题方法
3 . 废旧电池镍钴锰酸锂三元正极材料的主要成分为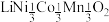 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
②M2+(Co2+或Ni2+)的萃取原理:2HR(有机相)+M2+(水相)⇌MR2(有机相)+2H+(水相)。
回答下列问题:
(1)“高温氢化”时固体产物为Co、Ni、MnO和LiOH,该反应的化学方程式为_______ ;实际生产中还有少量的Li2CO3生成,原因是_______ 。
(2)“酸洗”的目的是_______ ;若“洗液”中c(Li+)=2.0mol•L-1,加入Na2CO3固体后,为使沉淀Li2CO3中Li元素含量不小于Li元素总量的95%,则1.0L“洗液”中至少需要加入Na2CO3的物质的量为______ mol[忽略溶液体积变化,Ksp(Li2CO3)=2.2×10-3]。
(3)“沉锰”过程中pH对金属沉淀率的影响如图所示。_______ 。
②pH=0.5时,有少量钴、镍析出,可能的原因是_______ ;应选择的最佳pH为_______ 。
(4)“反萃取”的目的是将有机层中Co2+、Ni2+转移到水层。
①试剂X为_______ (填试剂名称)。
②为使Co2+、Ni2+尽可能多地转移到水层,应采取的实验操作有_______ 。
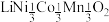 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。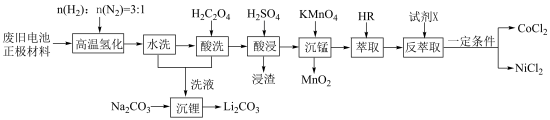
②M2+(Co2+或Ni2+)的萃取原理:2HR(有机相)+M2+(水相)⇌MR2(有机相)+2H+(水相)。
回答下列问题:
(1)“高温氢化”时固体产物为Co、Ni、MnO和LiOH,该反应的化学方程式为
(2)“酸洗”的目的是
(3)“沉锰”过程中pH对金属沉淀率的影响如图所示。
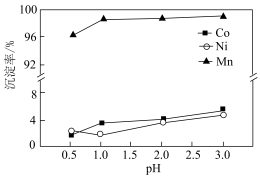
②pH=0.5时,有少量钴、镍析出,可能的原因是
(4)“反萃取”的目的是将有机层中Co2+、Ni2+转移到水层。
①试剂X为
②为使Co2+、Ni2+尽可能多地转移到水层,应采取的实验操作有
您最近一年使用:0次
2024-03-22更新
|
781次组卷
|
3卷引用:山东省临沂市2024届高三一模化学试题
解题方法
4 . 利用含锌废料(主要成分是ZnO,还含有CuO、FeO等)制备ZnCl2•6H2O的一种工艺流程如图所示,下列说法错误的是
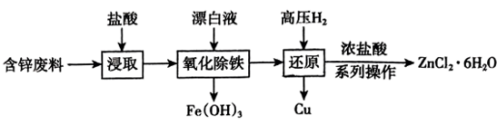
| A.“浸取”操作应在高温下进行 |
| B.“氧化除铁”的反应为ClO—+2Fe2++5H2O=Cl—+2Fe(OH)3↓+4H+ |
| C.“还原”时,增大溶液酸度有利于Cu的生成 |
| D.加入浓盐酸的目的是抑制ZnCl2水解 |
您最近一年使用:0次
解题方法
5 . 硝酸铈(Ⅳ)铵的化学式为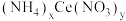 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
步骤一:NH4HCO3溶液与CeCl3溶液反应制备Ce2(CO3)3。
已知:①氮化钙遇水可迅速产生NH3;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。___________ ,装置C的作用是___________ 。该实验以氮化钙和水制备NH3应选择装置___________ (填“A”或“D”)。
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为___________ 。装置B中发生反应的离子方程式为___________ 。
(3)该实验装置存在的一处缺陷为___________ 。
步骤二:制备硝酸铈(Ⅳ)铵___________ 。
(5)“烘干”采取自然干燥的原因为___________ 。
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO2mg。
②另称取相同质量的硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V1mL水吸收。将吸收液滴入甲基橙,用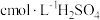 标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
(6)计算y=___________ (用上述字母表示)。
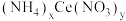 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。步骤一:NH4HCO3溶液与CeCl3溶液反应制备Ce2(CO3)3。
已知:①氮化钙遇水可迅速产生NH3;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。
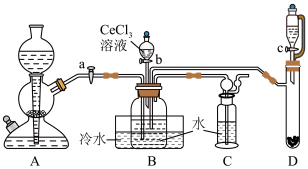
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为
(3)该实验装置存在的一处缺陷为
步骤二:制备硝酸铈(Ⅳ)铵

(5)“烘干”采取自然干燥的原因为
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO2mg。
②另称取相同质量的硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V1mL水吸收。将吸收液滴入甲基橙,用
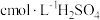 标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。(6)计算y=
您最近一年使用:0次
2024-02-02更新
|
256次组卷
|
3卷引用:山东省临沂市郯城县美澳学校2023-2024学年高三下学期开学考试化学试题
6 . 综合处理含SO2的尾气工艺流程如图。下列说法正确的是

A.“吸收”过程发生的反应为 |
B.可用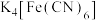 溶液检验“氧化”是否完全 溶液检验“氧化”是否完全 |
C.综合处理的总反应为 |
| D.向煤中加入石灰石可实现脱硫减排,该过程存在氧化还原反应 |
您最近一年使用:0次
2024-02-02更新
|
359次组卷
|
3卷引用:山东省临沂市郯城县美澳学校2023-2024学年高三下学期开学考试化学试题
名校
解题方法
7 . 工业上以软锰矿(主要成分为 ,还含有少量
,还含有少量 )和辉钼矿(主要成分为为
)和辉钼矿(主要成分为为 ,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体
,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体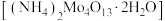 和硫酸锰晶体的工艺流程如下。
和硫酸锰晶体的工艺流程如下。

已知: ,常温下,NiS和MnS的
,常温下,NiS和MnS的 分别为19.4和12.6;
分别为19.4和12.6; 。
。
回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有___________ (写一条即可);“高温焙烧”时 、
、 转化为
转化为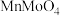 、
、 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(2)“酸浸”时,硫酸浓度对Mo、Mn浸出率的影响如图所示。

“酸浸”时硫酸的最佳浓度为___________  ,理由是
,理由是___________ 。
(3)黄钠铁矾的化学式为 ,生成黄钠铁矾的离子方程式为
,生成黄钠铁矾的离子方程式为___________ ;“除铁”后的溶液中 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度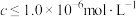 时,可认为已除尽,则“除镍”应控制溶液pH的范围是
时,可认为已除尽,则“除镍”应控制溶液pH的范围是___________ [已知 ,该溶液中
,该溶液中 和pH的关系为
和pH的关系为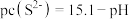 ;忽略溶液体积变化]。
;忽略溶液体积变化]。
(4)“萃取”的原理为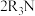 (叔胺)
(叔胺)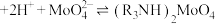 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用___________ (填标号)。
a.稀硫酸 b. 溶液 c.NaOH溶液 d.氨水
溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是___________ (填名称)。
 ,还含有少量
,还含有少量 )和辉钼矿(主要成分为为
)和辉钼矿(主要成分为为 ,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体
,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体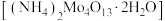 和硫酸锰晶体的工艺流程如下。
和硫酸锰晶体的工艺流程如下。
已知:
 ,常温下,NiS和MnS的
,常温下,NiS和MnS的 分别为19.4和12.6;
分别为19.4和12.6; 。
。回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有
 、
、 转化为
转化为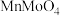 、
、 ,写出该反应的化学方程式
,写出该反应的化学方程式(2)“酸浸”时,硫酸浓度对Mo、Mn浸出率的影响如图所示。

“酸浸”时硫酸的最佳浓度为
 ,理由是
,理由是(3)黄钠铁矾的化学式为
 ,生成黄钠铁矾的离子方程式为
,生成黄钠铁矾的离子方程式为 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度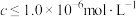 时,可认为已除尽,则“除镍”应控制溶液pH的范围是
时,可认为已除尽,则“除镍”应控制溶液pH的范围是 ,该溶液中
,该溶液中 和pH的关系为
和pH的关系为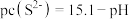 ;忽略溶液体积变化]。
;忽略溶液体积变化]。(4)“萃取”的原理为
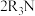 (叔胺)
(叔胺)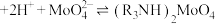 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用a.稀硫酸 b.
 溶液 c.NaOH溶液 d.氨水
溶液 c.NaOH溶液 d.氨水从“母液”中回收的副产品主要是
您最近一年使用:0次
2023-05-12更新
|
594次组卷
|
2卷引用:山东省临沂市2023届高三二模考试化学试题
解题方法
8 . 实验室以活性炭为催化剂,由 制备三氯化六氨合钴(Ⅲ)
制备三氯化六氨合钴(Ⅲ)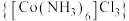 的装置如图所示:
的装置如图所示:

已知: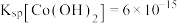 ;
; 具有较强还原性,
具有较强还原性, 不易被氧化。
不易被氧化。
回答下列问题:
(1)仪器c的名称是___________ ;d中无水 的作用是
的作用是___________ 。
(2)向混合液中先加入浓氨水,目的是___________ ,混合液中 的作用是
的作用是___________ ;充分反应后再加入双氧水,水浴加热,控制温度为55℃的原因是___________ 。
(3) 制备
制备 的化学方程式为
的化学方程式为___________ ;将反应后的混合物趁热过滤,待滤液冷却后加入适量浓盐酸,冰水冷却、抽滤、乙醇洗涤、干燥,得到 晶体,抽滤的优点是
晶体,抽滤的优点是___________ 。
(4)为测定产品中钴的含量,进行下列实验:
Ⅰ.称取3.5400g产品,加入足量NaOH溶液蒸出 ,再加入稀硫酸,使
,再加入稀硫酸,使 全部转化为
全部转化为 ,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入过量的KI溶液,用
,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入过量的KI溶液,用 标准溶液滴定至终点,消耗标准溶液13.30mL。
标准溶液滴定至终点,消耗标准溶液13.30mL。
Ⅱ.另取与步骤Ⅰ中等量的KI溶液于锥形瓶中,用上述标准溶液进行滴定,消耗 标准溶液1.30mL。
标准溶液1.30mL。
①样品中钴元素的质量分数为___________ 。
②若步骤Ⅱ滴定前滴定管内无气泡,滴定后有气泡,会使测定结果___________ (填“偏大”“偏小”或“不变”)。
 制备三氯化六氨合钴(Ⅲ)
制备三氯化六氨合钴(Ⅲ)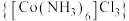 的装置如图所示:
的装置如图所示:
已知:
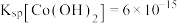 ;
; 具有较强还原性,
具有较强还原性, 不易被氧化。
不易被氧化。回答下列问题:
(1)仪器c的名称是
 的作用是
的作用是(2)向混合液中先加入浓氨水,目的是
 的作用是
的作用是(3)
 制备
制备 的化学方程式为
的化学方程式为 晶体,抽滤的优点是
晶体,抽滤的优点是(4)为测定产品中钴的含量,进行下列实验:
Ⅰ.称取3.5400g产品,加入足量NaOH溶液蒸出
 ,再加入稀硫酸,使
,再加入稀硫酸,使 全部转化为
全部转化为 ,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入过量的KI溶液,用
,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入过量的KI溶液,用 标准溶液滴定至终点,消耗标准溶液13.30mL。
标准溶液滴定至终点,消耗标准溶液13.30mL。Ⅱ.另取与步骤Ⅰ中等量的KI溶液于锥形瓶中,用上述标准溶液进行滴定,消耗
 标准溶液1.30mL。
标准溶液1.30mL。①样品中钴元素的质量分数为
②若步骤Ⅱ滴定前滴定管内无气泡,滴定后有气泡,会使测定结果
您最近一年使用:0次
9 . 镍电池的电极活性材料为多组分合金(主要成分为镍、钴,还含有铝、铁等),可重新回收利用。利用废镍电池资源化生产醋酸钴晶体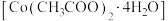 的工艺流程如下。
的工艺流程如下。

已知:①浸取母液中除铝元素外,其他金属元素的化合价均为+2价。
②部分金属阳离子沉淀的pH如下表。
请回答下列问题:
(1)“浸取”时可以提高浸取率的操作有___________ (任写1条)。
(2)“调pH”时溶液的pH范围是___________ ,所得滤渣1的主要成分为___________ (填化学式)。
(3)“氧化分离”操作控制溶液pH=2,加入NaClO发生反应的离子方程式为___________ 。
(4)“溶解1”操作中加入H2O2的作用为___________ ,“沉钴”操作过程中发生反应的离子方程式为___________ 。
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为___________ 。
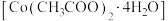 的工艺流程如下。
的工艺流程如下。
已知:①浸取母液中除铝元素外,其他金属元素的化合价均为+2价。
②部分金属阳离子沉淀的pH如下表。
| 沉淀物 |  |  | 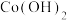 | Co(OH)3 |  |  |
| 开始沉淀pH | 2.2 | 7.4 | 7.6 | 0.1 | 4.0 | 7.6 |
| 完全沉淀pH | 3.2 | 8.9 | 9.2 | 1.1 | 5.2 | 9.2 |
(1)“浸取”时可以提高浸取率的操作有
(2)“调pH”时溶液的pH范围是
(3)“氧化分离”操作控制溶液pH=2,加入NaClO发生反应的离子方程式为
(4)“溶解1”操作中加入H2O2的作用为
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为
您最近一年使用:0次
名校
10 . 钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。工业上利用固体废料“赤泥”(含FeO、Fe2O3、SiO2、Sc2O3、TiO2等)回收Sc2O3的工艺流程如图。

已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)为提高“酸浸”速率,对“赤泥”的处理方式为_____ ;滤渣I的主要成分是_____ (填化学式)。
(2)“氧化”时加入足量H2O2的目的是______ ;氧化后溶液中Fe3+浓度为0.001mol•L-1,常温下“调pH”时,若控制pH=3,则Fe3+的去除率为______ (忽略调pH前后溶液的体积变化)。
(3)已知25℃时,Kh1(C2O )=a,Kh2(C2O
)=a,Kh2(C2O )=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4
)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4 Sc2(C2O4)3↓+6H+,该反应的平衡常数K=
Sc2(C2O4)3↓+6H+,该反应的平衡常数K=______ (用含a、b、c的代数式表示)。
(4)Sc2(C2O4)3·6H2O在空气中加热分解时, 随温度变化如图所示。已知:M[Sc2(C2O4)3·6H2O]=462g·mol-1。
随温度变化如图所示。已知:M[Sc2(C2O4)3·6H2O]=462g·mol-1。

250℃时固体的主要成分是_____ (填化学式);550~850℃时反应的化学方程式为______ 。

已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)为提高“酸浸”速率,对“赤泥”的处理方式为
(2)“氧化”时加入足量H2O2的目的是
(3)已知25℃时,Kh1(C2O
 )=a,Kh2(C2O
)=a,Kh2(C2O )=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4
)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4 Sc2(C2O4)3↓+6H+,该反应的平衡常数K=
Sc2(C2O4)3↓+6H+,该反应的平衡常数K=(4)Sc2(C2O4)3·6H2O在空气中加热分解时,
 随温度变化如图所示。已知:M[Sc2(C2O4)3·6H2O]=462g·mol-1。
随温度变化如图所示。已知:M[Sc2(C2O4)3·6H2O]=462g·mol-1。
250℃时固体的主要成分是
您最近一年使用:0次
2023-02-22更新
|
1070次组卷
|
3卷引用:山东省临沂市2023届高三一模考试化学试题





