解题方法
1 . 某化学实验小组为了探究氨气的还原性设计了如下实验:
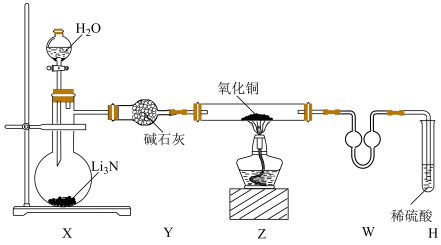
已知:Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+ CuSO4+H2O。
(1)装置X中发生反应的化学方程式为____________ ,装置W的作用是____________ 。
(2)随着反应的进行,装置Z中的固体逐渐变成红色,为了探究红色固体的成分,充分反应后进行了如下实验:
(3)为了测定该红色固体的定量组成,该化学实验小组又进行了如下实验:称量20.8 g该红色固体,加入足量稀硫酸,充分搅拌,将反应后的混合物过滤、洗涤、干燥、称重,得固体12.8 g。则20.8 g红色固体中的成分及质量为________ 。
(4)由(3)可知,装置Z中发生反应的化学方程式为_________ 。

已知:Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+ CuSO4+H2O。
(1)装置X中发生反应的化学方程式为
(2)随着反应的进行,装置Z中的固体逐渐变成红色,为了探究红色固体的成分,充分反应后进行了如下实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 无现象 | ①红色固体为 |
| 溶液变蓝 | ②红色固体中肯定含有 |
(4)由(3)可知,装置Z中发生反应的化学方程式为
您最近一年使用:0次
2020-11-06更新
|
228次组卷
|
2卷引用:广东省清远市2021届高三上学期摸底考试(11月) 化学试题
名校
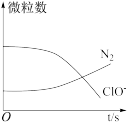
2 . 某离子反应涉及 H2O、ClO-、 NH 、OH-、N2、Cl- 等微粒,其中 N2、ClO- 的数目随时间变化的曲线如图所示,下列说法错误的是
、OH-、N2、Cl- 等微粒,其中 N2、ClO- 的数目随时间变化的曲线如图所示,下列说法错误的是
 、OH-、N2、Cl- 等微粒,其中 N2、ClO- 的数目随时间变化的曲线如图所示,下列说法错误的是
、OH-、N2、Cl- 等微粒,其中 N2、ClO- 的数目随时间变化的曲线如图所示,下列说法错误的是
| A.该反应中Cl-为还原产物 | B.消耗1个还原剂微粒,转移6 个电子 |
C.NH 被ClO- 氧化成N2 被ClO- 氧化成N2 | D.反应后溶液的碱性减弱 |
您最近一年使用:0次
2023-11-01更新
|
153次组卷
|
3卷引用:广东省清远市名校2023-2024学年高一上学期期中调研联考化学试题
名校
解题方法
3 . 氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,并比较其氧化性。
已知:氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO 和Cl-
和Cl-

回答下列问题:
(1)甲中盛放浓盐酸的仪器名称是___________ ,甲中发生的反应的化学方程式是___________ ;
(2)乙中的试剂为___________ ;
(3)丙中发生反应的化学方程式是___________ ;
(4)丁采用冰水浴冷却的目的是___________ ;
(5)戊的作用是尾气吸收,可选用试剂 ___________(填字母)。
(6)反应结束后,取出丙中试管,经冷却结晶、___________ 、洗涤、干燥,得到KClO3晶体。
(7)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。可知该条件下KClO3的氧化能力___________ NaClO(填“大于”或“小于”)。
已知:氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO
 和Cl-
和Cl-
回答下列问题:
(1)甲中盛放浓盐酸的仪器名称是
(2)乙中的试剂为
(3)丙中发生反应的化学方程式是
(4)丁采用冰水浴冷却的目的是
(5)戊的作用是尾气吸收,可选用试剂 ___________(填字母)。
| A.H2SO4 | B.NaOH | C.NaCl | D.Ca(OH)2 |
(6)反应结束后,取出丙中试管,经冷却结晶、
(7)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。可知该条件下KClO3的氧化能力
您最近一年使用:0次
名校
4 . 硫化氢(H2S)是一种无色、有臭鸡蛋气味的有毒气体。处理某废气中的 H2S,是将废气与空气混合通入 FeCl2,CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是
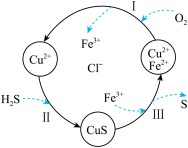

| A.转化过程中参与循环的离子只有 Cu2+、Fe2+ |
| B.转化过程有两种元素的化合价发生了变化 |
| C.氧化性由强到弱的顺序:S>Fe3+>O2 |
| D.过程Ⅲ中发生反应的离子方程式为 CuS+2Fe3+=S+2Fe2++Cu2+ |
您最近一年使用:0次
2023-11-01更新
|
452次组卷
|
12卷引用:广东省清远市名校2023-2024学年高一上学期期中调研联考化学试题
广东省清远市名校2023-2024学年高一上学期期中调研联考化学试题重庆市2021-2022学年高一上学期期末联合检测化学试题广东省广州市第五中学2022-2023学年高一上学期段考试化学试题陕西省西安市铁一中2022-2023学年高一上学期第一次月考化学试题广东省广州市第五中学2022-2023学年高一上学期期中考试化学试题湖北省麻城市实验高级中学2021-2022学年高一下学期2月迎春考化学试题四川省达州天立学校2022-2023学年高一上学期第一次月考选科摸底测试学试题【2022】【高一上】【长河高级中学】【期中考】【高中化学】吉林省长春市第二实验中学2023-2024学年高一上学期期中考试化学试题安徽省阜阳市临泉第一中学2023-2024学年高一上学期10月月考化学试题云南会泽县实验高级中学校2023-2024学年高一上学期10月月考化学试题安徽省合肥市第三中学2023-2024学年高一上学期12月份学情调研化学试题
5 . 镍是一种常用的有机催化剂,且在电磁领域应用广泛。某工厂以含镍废料(主要含NiO、Fe2O3、FeO、Al2O3、SiO2、CaO)为原料制备镍单质的流程如下:
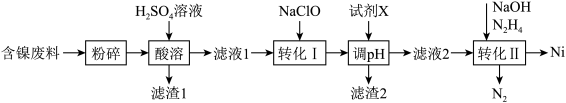
已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是____________ ;“滤渣1”的主要成分为____________ 。
(2)“转化Ⅰ”的目的为___________________ (用离子方程式表示)。
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为__________________ 。
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,________ (选填“能”或“不能”)达到目的,“试剂X”可以是________ (填选项字母)。
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为___________ ;“转化Ⅱ”中发生反应的离子方程式为________ 。
(6)工业上也可取“滤液2”,利用电沉积法制取金属Ni,电解装置如下。电解过程中镍棒上可能发生的电极反应式为______________ 。


已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是
(2)“转化Ⅰ”的目的为
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为
(6)工业上也可取“滤液2”,利用电沉积法制取金属Ni,电解装置如下。电解过程中镍棒上可能发生的电极反应式为

您最近一年使用:0次
名校
6 . 下列关于氮及其化合物的说法错误 的是
| A.N2化学性质稳定,可用作保护气 |
| B.NO、NO2均为大气污染气体,在大气中可稳定存在 |
| C.可用浓盐酸检测输送NH3的管道是否发生泄漏 |
| D.HNO3具有强氧化性,可溶解铜、银等不活泼金属 |
您最近一年使用:0次
2019-05-04更新
|
405次组卷
|
8卷引用:广东省清远市博爱学校2021-2022学年高一下学期第一次教学质量检测化学试题
7 . 根据下列实验设计,回答问题:
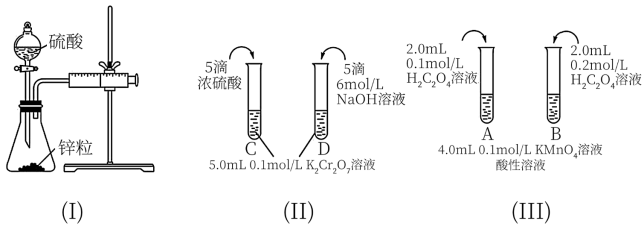
(1)利用实验(Ⅰ)探究锌与0.1 硫酸和2
硫酸和2 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:___________ 。
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知: (橙色)
(橙色) (黄色)
(黄色) 推测D试管中实验现象为
推测D试管中实验现象为___________ ,用平衡移动原理解释原因:___________ 。
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为___________ ,推测该实验设计能否达到实验目的并描述判断理由:___________ 。
(4)某小组也用酸性KMnO4溶液和草酸( )溶液进行实验,实验操作及现象如下表:
)溶液进行实验,实验操作及现象如下表:
①实验i、实验ii可得出的结论是___________ 。
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
提供试剂:0.01 酸性
酸性 溶液,0.1
溶液,0.1 草酸溶液,3
草酸溶液,3 硫酸,
硫酸, 溶液,
溶液, 固体,蒸馏水。
固体,蒸馏水。
补全实验iii的操作:向试管中先加入5 0.01
0.01 酸性
酸性 溶液,
溶液,___________ ,最后加入5 0.1
0.1 草酸溶液。
草酸溶液。

(1)利用实验(Ⅰ)探究锌与0.1
 硫酸和2
硫酸和2 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:
 (橙色)
(橙色) (黄色)
(黄色) 推测D试管中实验现象为
推测D试管中实验现象为(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为
(4)某小组也用酸性KMnO4溶液和草酸(
 )溶液进行实验,实验操作及现象如下表:
)溶液进行实验,实验操作及现象如下表:| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入5 0.01 0.01 酸性 酸性 溶液,再加入1滴3 溶液,再加入1滴3 硫酸和9滴蒸馏水,最后加入5 硫酸和9滴蒸馏水,最后加入5 0.1 0.1 草酸溶液 草酸溶液 | 前10 内溶液紫色无明显变化,后颜色逐渐变浅,30 内溶液紫色无明显变化,后颜色逐渐变浅,30 后几乎变为无色 后几乎变为无色 |
| ii | 向另一支试管中先加入5 0.01 0.01 酸性 酸性 溶液,再加入10滴3 溶液,再加入10滴3 硫酸,最后加入5 硫酸,最后加入5 0.1m 0.1m 草酸溶液 草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
 对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。提供试剂:0.01
 酸性
酸性 溶液,0.1
溶液,0.1 草酸溶液,3
草酸溶液,3 硫酸,
硫酸, 溶液,
溶液, 固体,蒸馏水。
固体,蒸馏水。补全实验iii的操作:向试管中先加入5
 0.01
0.01 酸性
酸性 溶液,
溶液, 0.1
0.1 草酸溶液。
草酸溶液。
您最近一年使用:0次
2021-11-05更新
|
379次组卷
|
4卷引用:广东省清远市四校联盟2022-2023学年高二上学期期中考试化学试题



