解题方法
1 .  具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、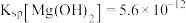 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:___________ ;加入 的目的是
的目的是___________ 。
(2)滤渣1的主要成分为___________ 、___________ 及不溶于酸、碱的杂质;加入 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
___________ 。
(3)若通入过量 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为___________ 。
(4)写出洗去固体A表面杂质的简要操作:___________ 。
(5)“煅烧”固体A反应的化学方程式为___________ 。
 具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、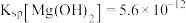 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:
 的目的是
的目的是(2)滤渣1的主要成分为
 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
(3)若通入过量
 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为(4)写出洗去固体A表面杂质的简要操作:
(5)“煅烧”固体A反应的化学方程式为
您最近一年使用:0次
2024-04-25更新
|
180次组卷
|
3卷引用:2024届陕西省商洛市高三上学期第二次模拟考试理综试题-高中化学
解题方法
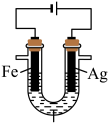
2 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制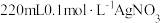 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: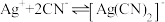 ,
,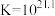 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是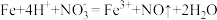 和
和___________ (用离子方程式表示,已知氧化性: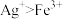 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中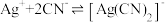 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为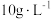 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由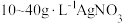 溶液和
溶液和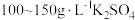 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: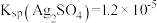 。
。
I.实验准备。
(1)用
 固体配制
固体配制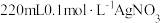 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
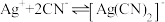 ,
,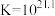 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的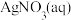 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
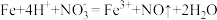 和
和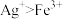 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
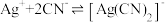 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(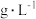 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为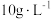 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
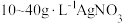 溶液和
溶液和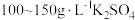 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
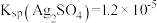 。
。
您最近一年使用:0次
2024-04-16更新
|
278次组卷
|
5卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
3 .  是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体
是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体 具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性
具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性 。回答下列问题:
。回答下列问题:
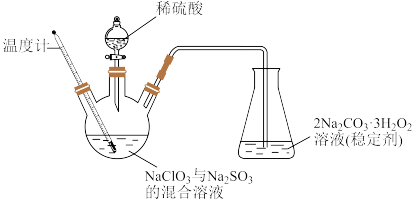
(1)盛装稀硫酸的仪器名称为___________ ;控制温度为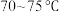 ,缓慢滴加稀硫酸,则该过程中适宜的加热方式为
,缓慢滴加稀硫酸,则该过程中适宜的加热方式为___________ ;写出生成 反应的化学方程式:
反应的化学方程式:___________ 。
(2)长导管的作用为___________ 。
(3)使用过碳酸钠( ,在水中转化为
,在水中转化为 和
和 )溶液作稳定剂时,
)溶液作稳定剂时, 被还原成较稳定的
被还原成较稳定的 ,可较长时间保存,写出锥形瓶中
,可较长时间保存,写出锥形瓶中 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(4)稳定液中的 并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使
并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使 转化成
转化成 释放出来。
释放出来。 活化率与不同活化剂(浓度均为
活化率与不同活化剂(浓度均为 )用量的关系如表。
)用量的关系如表。
①请分析盐酸活化效果最好的原因:___________ 。
②使用盐酸作活化剂时发生反应的离子方程式为___________ 。
 是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体
是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体 具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性
具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性 。回答下列问题:
。回答下列问题:
(1)盛装稀硫酸的仪器名称为
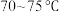 ,缓慢滴加稀硫酸,则该过程中适宜的加热方式为
,缓慢滴加稀硫酸,则该过程中适宜的加热方式为 反应的化学方程式:
反应的化学方程式:(2)长导管的作用为
(3)使用过碳酸钠(
 ,在水中转化为
,在水中转化为 和
和 )溶液作稳定剂时,
)溶液作稳定剂时, 被还原成较稳定的
被还原成较稳定的 ,可较长时间保存,写出锥形瓶中
,可较长时间保存,写出锥形瓶中 与
与 反应的离子方程式:
反应的离子方程式:(4)稳定液中的
 并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使
并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使 转化成
转化成 释放出来。
释放出来。 活化率与不同活化剂(浓度均为
活化率与不同活化剂(浓度均为 )用量的关系如表。
)用量的关系如表。活化剂用量 活化率 活化剂 | 5mL | 10mL | 15mL | 20mL | 25mL |
盐酸 | 29.32% | 58.02% | 86.91% | 99.57% | 100.00% |
醋酸 | 26.75% | 55.52% | 79.01% | 97.22% | 97.53% |
柠檬酸 | 20.03% | 41.22% | 52.13% | 53.76% | 59.80% |
②使用盐酸作活化剂时发生反应的离子方程式为
您最近一年使用:0次
2024-03-31更新
|
113次组卷
|
2卷引用:2024届陕西省商洛市高三上学期第二次模拟考试理综试题-高中化学
4 . 连二亚硫酸钠( )也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取
)也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取 。
。
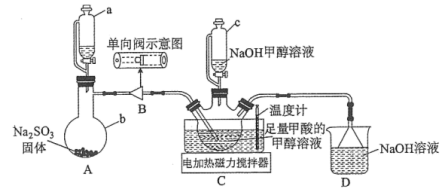
回答下列问题:
(1)仪器a的名称是___________ ,用装置A制备 时所选用的酸,你认为下列最适宜选用的是
时所选用的酸,你认为下列最适宜选用的是___________ (填字母)。
A.浓盐酸 B.质量分数为70%的
C.稀硝酸 D.质量分数为10%的稀硫酸
(2)单向阀的作用是___________ ,制备保险粉前先打开仪器a的活塞的目的是___________ 。
(3)已知三颈烧瓶中的甲酸转化为 ,写出生成
,写出生成 的化学方程式:
的化学方程式:___________ 。
(4) 是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:
是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:___________ 。
(5) 固体隔绝空气加热使之完全分解得到固体产物
固体隔绝空气加热使之完全分解得到固体产物 、
、 和
和 气体,设计实验方案检验产物中含有的
气体,设计实验方案检验产物中含有的 :
:___________ (写出实验操作、现象及结论)。
(6)称取粗产品 加水溶解,用NaOH溶液碱化后,加入一定量的
加水溶解,用NaOH溶液碱化后,加入一定量的 溶液恰好完全反应(
溶液恰好完全反应( ),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到
),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到 银,则粗产品中连二亚硫酸钠的纯度为
银,则粗产品中连二亚硫酸钠的纯度为___________ (含 、
、 的表达式)。
的表达式)。
 )也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取
)也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取 。
。
回答下列问题:
(1)仪器a的名称是
 时所选用的酸,你认为下列最适宜选用的是
时所选用的酸,你认为下列最适宜选用的是A.浓盐酸 B.质量分数为70%的

C.稀硝酸 D.质量分数为10%的稀硫酸
(2)单向阀的作用是
(3)已知三颈烧瓶中的甲酸转化为
 ,写出生成
,写出生成 的化学方程式:
的化学方程式:(4)
 是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:
是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:(5)
 固体隔绝空气加热使之完全分解得到固体产物
固体隔绝空气加热使之完全分解得到固体产物 、
、 和
和 气体,设计实验方案检验产物中含有的
气体,设计实验方案检验产物中含有的 :
:(6)称取粗产品
 加水溶解,用NaOH溶液碱化后,加入一定量的
加水溶解,用NaOH溶液碱化后,加入一定量的 溶液恰好完全反应(
溶液恰好完全反应( ),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到
),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到 银,则粗产品中连二亚硫酸钠的纯度为
银,则粗产品中连二亚硫酸钠的纯度为 、
、 的表达式)。
的表达式)。
您最近一年使用:0次
5 . 门捷列夫认为氮、碳、氧、氢是“四大天王”元素,它们与宇宙和生命的形成都有密切联系,可以相互结合成很多化合物。
(1)四种元素中,核外未成对电子数目相同的元素有___________ (填写元素符号,下同);四种元素的原子半径由大到小的顺序为___________ 。
(2)HCN是生命演化过程中的基础物质之一。已知HCN中C、N都满足8电子稳定结构,则HCN的电子式为___________ ;其中C、N之间的共用电子对偏向的元素是___________ ,从原子结构角度解释其原因___________ 。
(3)N2O是医学上的一-种麻醉剂,可以通过反应NH3+O2→N2O+H2O制得,配平该反应的化学方程式___________ ,若生成1.8g水,转移的电子数目为___________ 个(结构保留两位有效数字)。
(1)四种元素中,核外未成对电子数目相同的元素有
(2)HCN是生命演化过程中的基础物质之一。已知HCN中C、N都满足8电子稳定结构,则HCN的电子式为
(3)N2O是医学上的一-种麻醉剂,可以通过反应NH3+O2→N2O+H2O制得,配平该反应的化学方程式
您最近一年使用:0次
名校
6 . 下列反应的离子方程式书写正确的是
A.硫代硫酸钠与氯水反应: |
B.四氧化三铁与氢碘酸溶液反应: |
C.向 溶液中加入 溶液中加入 溶液: 溶液: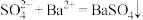 |
D.硫化钠溶液久置在空气中变浑浊: |
您最近一年使用:0次
2023-09-06更新
|
67次组卷
|
2卷引用:陕西省商洛市部分学校联考2023-2024学年高三上学期10月月考化学试题
解题方法
7 . 科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。
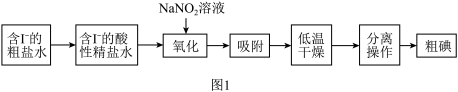
Ⅰ.活性炭纤维吸附法是工业提取碘单质的方法之一,其流程如图1所示:
已知:a. 溶液只能将
溶液只能将 氧化成
氧化成 ,同时生成NO气体。
,同时生成NO气体。
b.酸性条件下, 会与
会与 反应生成
反应生成 和
和 。
。
(1)粗盐水中还含有 、
、 、
、 ,制成精盐水时所加试剂的顺序是___________(填标号)。
,制成精盐水时所加试剂的顺序是___________(填标号)。
(2)“氧化”过程中发生反应的离子方程式是___________ 。
(3)酸性 溶液是常用的氧化剂,但此过程中选择价格更贵的
溶液是常用的氧化剂,但此过程中选择价格更贵的 的原因是
的原因是___________ 。
(4)根据碘单质的特性,分离操作是___________ ,冷凝得粗碘。
Ⅱ.以金红石(主要成分为TiO₂)为原料制取海绵钛的工艺流程如图2所示:
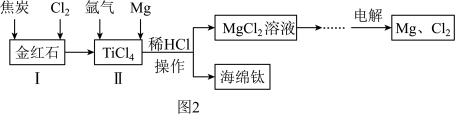
(5)高温条件下,反应1可生成一种可燃性气体,反应1的化学方程式是___________ 。
(6)上述流程中可循环利用的物质是___________ (填化学式),电解熔融 的化学方程式是
的化学方程式是___________ 。
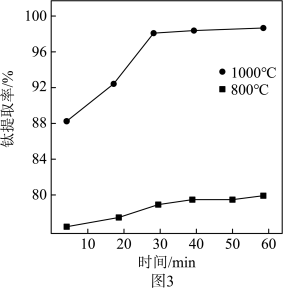
(7)反应2中钛的提取率在不同温度下随时间变化的曲线如图3,则反应最适宜的条件是___________ 。
Ⅰ.活性炭纤维吸附法是工业提取碘单质的方法之一,其流程如图1所示:

已知:a.
 溶液只能将
溶液只能将 氧化成
氧化成 ,同时生成NO气体。
,同时生成NO气体。b.酸性条件下,
 会与
会与 反应生成
反应生成 和
和 。
。(1)粗盐水中还含有
 、
、 、
、 ,制成精盐水时所加试剂的顺序是___________(填标号)。
,制成精盐水时所加试剂的顺序是___________(填标号)。A. 溶液、NaOH溶液、 溶液、NaOH溶液、 溶液、稀盐酸 溶液、稀盐酸 |
B.NaOH溶液、 溶液、 溶液、 溶液、稀盐酸 溶液、稀盐酸 |
C.NaOH溶液、 溶液、 溶液、 溶液、稀盐酸 溶液、稀盐酸 |
D. 溶液、 溶液、 溶液、NaOH溶液、稀盐酸 溶液、NaOH溶液、稀盐酸 |
(3)酸性
 溶液是常用的氧化剂,但此过程中选择价格更贵的
溶液是常用的氧化剂,但此过程中选择价格更贵的 的原因是
的原因是(4)根据碘单质的特性,分离操作是
Ⅱ.以金红石(主要成分为TiO₂)为原料制取海绵钛的工艺流程如图2所示:

(5)高温条件下,反应1可生成一种可燃性气体,反应1的化学方程式是
(6)上述流程中可循环利用的物质是
 的化学方程式是
的化学方程式是(7)反应2中钛的提取率在不同温度下随时间变化的曲线如图3,则反应最适宜的条件是

您最近一年使用:0次
名校
解题方法
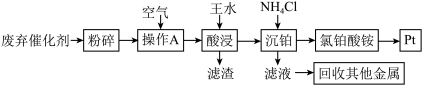
8 . 汽车废弃催化剂中含有Pt,还含有少量的Fe2O3、MgO、Al2O3、SiO2。一种从汽车废弃催化剂中回收铂的流程如下:
有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
(1)长期使用的催化剂,表面会覆盖积碳和有机物,粉碎废弃催化剂后,需进行预处理操作A,操作A的名称为_______ 。
(2)酸浸工序中Pt溶于王水生成NO和氯铂酸(H2PtCl6),该反应的化学方程式为_______ 。有同学提议,将王水换成盐酸和过氧化氢的混合溶液,其优点是_______ 。
(3)铂的浸出率与不同加热方式、不同固液比的关系如下图所示:
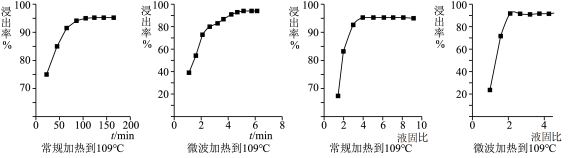
由图可知,Pt 浸出的最佳条件为_______ 。
(4)酸浸温度不宜过高的原因为_______ 。
(5)沉铂时,加入适当过量NH4Cl的目的是_______ 。
(6)通过调节滤液的pH以回收其他金属,依次析出的金属离子为_______ ,当Al3+开始沉淀时,溶液中的Fe3+浓度为_______ mol/L。

有关金属离子开始沉淀和沉淀完全的pH见下表:
| 金属离子 | Al3+ | Mg2+ | Fe3+ |
| 开始沉淀的pH | 3.5 | 9.5 | 2.2 |
| 沉淀完全(c=1.0× 10-5mol/L)的pH | 4.7 | 11.1 | 3.2 |
(1)长期使用的催化剂,表面会覆盖积碳和有机物,粉碎废弃催化剂后,需进行预处理操作A,操作A的名称为
(2)酸浸工序中Pt溶于王水生成NO和氯铂酸(H2PtCl6),该反应的化学方程式为
(3)铂的浸出率与不同加热方式、不同固液比的关系如下图所示:

由图可知,Pt 浸出的最佳条件为
(4)酸浸温度不宜过高的原因为
(5)沉铂时,加入适当过量NH4Cl的目的是
(6)通过调节滤液的pH以回收其他金属,依次析出的金属离子为
您最近一年使用:0次
2023-06-15更新
|
259次组卷
|
2卷引用:2024届陕西省商洛市柞水中学高三下学期理科综合能力测试6-高中化学
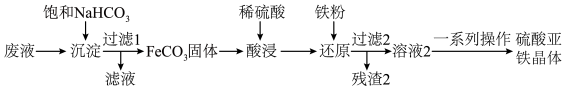
9 . 硫酸亚铁是一种补铁剂,某兴趣小组利用经过初步处理的含有 的废液制备硫酸亚铁晶体,其流程如下:
的废液制备硫酸亚铁晶体,其流程如下:
回答下列问题:
(1)配制250 mL 0.5 mol∙L−1 溶液时主要用到的玻璃仪器有250 mL容量瓶、烧杯、玻璃棒、量筒和
溶液时主要用到的玻璃仪器有250 mL容量瓶、烧杯、玻璃棒、量筒和_______ ,玻璃棒的作用为_______ 。
(2) 和
和 反应生成
反应生成 ,该反应为非氧化还原反应,反应的离子方程式为
,该反应为非氧化还原反应,反应的离子方程式为_______ 。
(3)“酸浸”时通常将 固体进行粉碎,原因为
固体进行粉碎,原因为_______ 。
(4)酸性条件下, 能被
能被 氧化,该反应的氧化产物与还原产物的物质的量之比为
氧化,该反应的氧化产物与还原产物的物质的量之比为_______ 。
(5)酸化的重铬酸钾溶液与 可发生反应:_______
可发生反应:_______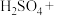 _______
_______ _______
_______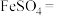 _______
_______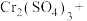 _______
_______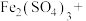 _______
_______ _______
_______ (未配平)。
(未配平)。
①配平上述化学方程式:_______ 。
②用单线桥法表示出电子转移的过程:_______ 。
 的废液制备硫酸亚铁晶体,其流程如下:
的废液制备硫酸亚铁晶体,其流程如下:
回答下列问题:
(1)配制250 mL 0.5 mol∙L−1
 溶液时主要用到的玻璃仪器有250 mL容量瓶、烧杯、玻璃棒、量筒和
溶液时主要用到的玻璃仪器有250 mL容量瓶、烧杯、玻璃棒、量筒和(2)
 和
和 反应生成
反应生成 ,该反应为非氧化还原反应,反应的离子方程式为
,该反应为非氧化还原反应,反应的离子方程式为(3)“酸浸”时通常将
 固体进行粉碎,原因为
固体进行粉碎,原因为(4)酸性条件下,
 能被
能被 氧化,该反应的氧化产物与还原产物的物质的量之比为
氧化,该反应的氧化产物与还原产物的物质的量之比为(5)酸化的重铬酸钾溶液与
 可发生反应:_______
可发生反应:_______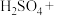 _______
_______ _______
_______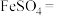 _______
_______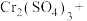 _______
_______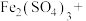 _______
_______ _______
_______ (未配平)。
(未配平)。①配平上述化学方程式:
②用单线桥法表示出电子转移的过程:
您最近一年使用:0次
2023-03-17更新
|
260次组卷
|
2卷引用:陕西省商洛市洛南中学2022-2023学年高一上学期期末考试化学试题
10 . 实验室常用 固体和浓盐酸反应制取氯气,反应的化学方程式为a
固体和浓盐酸反应制取氯气,反应的化学方程式为a bHCl(浓)=cKCl+d
bHCl(浓)=cKCl+d e
e 。下列说法正确的是
。下列说法正确的是
 固体和浓盐酸反应制取氯气,反应的化学方程式为a
固体和浓盐酸反应制取氯气,反应的化学方程式为a bHCl(浓)=cKCl+d
bHCl(浓)=cKCl+d e
e 。下列说法正确的是
。下列说法正确的是| A.该反应中HCl(浓)只体现还原性 |
B. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
C.该反应中, 中的氯全部转化为KCl中的氯 中的氯全部转化为KCl中的氯 |
| D.d+e=1.2b |
您最近一年使用:0次
2023-03-17更新
|
174次组卷
|
2卷引用:陕西省商洛市洛南中学2022-2023学年高一上学期期末考试化学试题