解题方法
1 .  具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、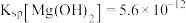 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:___________ ;加入 的目的是
的目的是___________ 。
(2)滤渣1的主要成分为___________ 、___________ 及不溶于酸、碱的杂质;加入 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
___________ 。
(3)若通入过量 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为___________ 。
(4)写出洗去固体A表面杂质的简要操作:___________ 。
(5)“煅烧”固体A反应的化学方程式为___________ 。
 具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、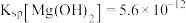 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:
 的目的是
的目的是(2)滤渣1的主要成分为
 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
(3)若通入过量
 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为(4)写出洗去固体A表面杂质的简要操作:
(5)“煅烧”固体A反应的化学方程式为
您最近一年使用:0次
2024-04-25更新
|
181次组卷
|
3卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
解题方法
2 . 用零价铁去除酸性水体中的 是地下水修复研究的热点之一、下列说法错误的是
是地下水修复研究的热点之一、下列说法错误的是
 是地下水修复研究的热点之一、下列说法错误的是
是地下水修复研究的热点之一、下列说法错误的是
|
|
|
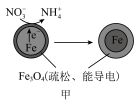
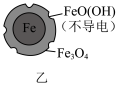
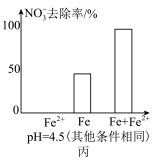
铁粉还原水体中 的反应原理示意图(已知:形成了原电池) 的反应原理示意图(已知:形成了原电池) | 足量铁粉还原水体中的 后,铁表面最终的形态示意图 后,铁表面最终的形态示意图 | 初始 的水体中,分别加入 的水体中,分别加入 、Fe(足量)、Fe(足量)和 、Fe(足量)、Fe(足量)和 时 时 去除率(%)的对比图像 去除率(%)的对比图像 |
| A.图甲中电极Fe发生氧化反应 |
B.图甲中正极发生的电极反应式为 |
C.当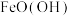 附着在Fe表面后会阻碍零价铁还原水体中的 附着在Fe表面后会阻碍零价铁还原水体中的 |
D.由图丙可知,去除 时,若只加入适量 时,若只加入适量 ,就可直接还原 ,就可直接还原 ,从而提高 ,从而提高 的去除率 的去除率 |
您最近一年使用:0次
解题方法
3 . 铋酸钠( ,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为
,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为 ,含
,含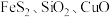 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图。
的工艺流程如图。
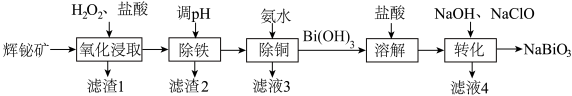
已知:“氧化浸取”时,铋元素转化为 ,硫元素转化为硫单质。回答下列问题:
,硫元素转化为硫单质。回答下列问题:
(1) 中铋元素的化合价为
中铋元素的化合价为___________ 价;“氧化浸取”时温度不能过高的原因是___________ ;“氧化浸取”时 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(2)“滤渣1”的主要成分为硫单质和___________ (写化学式)。
(3)“除铜”时,发生反应 ,该反应的平衡常数
,该反应的平衡常数
___________ 。{已知
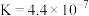 }
}
(4)在酸性介质中, 可将
可将 氧化为
氧化为 ,反应后
,反应后 元素呈
元素呈 价,则向足量稀硫酸和
价,则向足量稀硫酸和 稀溶液的混合溶液中加入
稀溶液的混合溶液中加入 时,反应中n(氧化剂):n(还原剂)=
时,反应中n(氧化剂):n(还原剂)=___________ 。
(5)“转化”时生成 反应的离子方程式为
反应的离子方程式为___________ 。
 ,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为
,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为 ,含
,含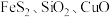 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图。
的工艺流程如图。
已知:“氧化浸取”时,铋元素转化为
 ,硫元素转化为硫单质。回答下列问题:
,硫元素转化为硫单质。回答下列问题:(1)
 中铋元素的化合价为
中铋元素的化合价为 发生反应的化学方程式为
发生反应的化学方程式为(2)“滤渣1”的主要成分为硫单质和
(3)“除铜”时,发生反应
 ,该反应的平衡常数
,该反应的平衡常数

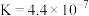 }
}(4)在酸性介质中,
 可将
可将 氧化为
氧化为 ,反应后
,反应后 元素呈
元素呈 价,则向足量稀硫酸和
价,则向足量稀硫酸和 稀溶液的混合溶液中加入
稀溶液的混合溶液中加入 时,反应中n(氧化剂):n(还原剂)=
时,反应中n(氧化剂):n(还原剂)=(5)“转化”时生成
 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
解题方法
4 .  是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体
是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体 具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性
具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性 。回答下列问题:
。回答下列问题:
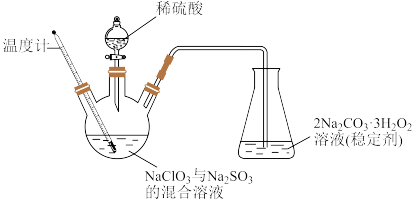
(1)盛装稀硫酸的仪器名称为___________ ;控制温度为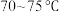 ,缓慢滴加稀硫酸,则该过程中适宜的加热方式为
,缓慢滴加稀硫酸,则该过程中适宜的加热方式为___________ ;写出生成 反应的化学方程式:
反应的化学方程式:___________ 。
(2)长导管的作用为___________ 。
(3)使用过碳酸钠( ,在水中转化为
,在水中转化为 和
和 )溶液作稳定剂时,
)溶液作稳定剂时, 被还原成较稳定的
被还原成较稳定的 ,可较长时间保存,写出锥形瓶中
,可较长时间保存,写出锥形瓶中 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(4)稳定液中的 并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使
并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使 转化成
转化成 释放出来。
释放出来。 活化率与不同活化剂(浓度均为
活化率与不同活化剂(浓度均为 )用量的关系如表。
)用量的关系如表。
①请分析盐酸活化效果最好的原因:___________ 。
②使用盐酸作活化剂时发生反应的离子方程式为___________ 。
 是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体
是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体 具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性
具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性 。回答下列问题:
。回答下列问题:
(1)盛装稀硫酸的仪器名称为
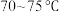 ,缓慢滴加稀硫酸,则该过程中适宜的加热方式为
,缓慢滴加稀硫酸,则该过程中适宜的加热方式为 反应的化学方程式:
反应的化学方程式:(2)长导管的作用为
(3)使用过碳酸钠(
 ,在水中转化为
,在水中转化为 和
和 )溶液作稳定剂时,
)溶液作稳定剂时, 被还原成较稳定的
被还原成较稳定的 ,可较长时间保存,写出锥形瓶中
,可较长时间保存,写出锥形瓶中 与
与 反应的离子方程式:
反应的离子方程式:(4)稳定液中的
 并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使
并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使 转化成
转化成 释放出来。
释放出来。 活化率与不同活化剂(浓度均为
活化率与不同活化剂(浓度均为 )用量的关系如表。
)用量的关系如表。活化剂用量 活化率 活化剂 | 5mL | 10mL | 15mL | 20mL | 25mL |
盐酸 | 29.32% | 58.02% | 86.91% | 99.57% | 100.00% |
醋酸 | 26.75% | 55.52% | 79.01% | 97.22% | 97.53% |
柠檬酸 | 20.03% | 41.22% | 52.13% | 53.76% | 59.80% |
②使用盐酸作活化剂时发生反应的离子方程式为
您最近一年使用:0次
2024-03-31更新
|
113次组卷
|
2卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
解题方法
5 . 一种锂离子电池的正极材料中含钴酸锂( )。某离子反应涉及
)。某离子反应涉及 、
、 、
、 、
、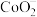 、
、 、
、 等微粒,溶液中
等微粒,溶液中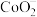 、
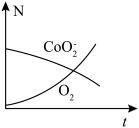
、 的粒子数目随时间变化的曲线如图所示。下列说法错误的是
的粒子数目随时间变化的曲线如图所示。下列说法错误的是
 )。某离子反应涉及
)。某离子反应涉及 、
、 、
、 、
、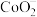 、
、 、
、 等微粒,溶液中
等微粒,溶液中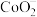 、
、 的粒子数目随时间变化的曲线如图所示。下列说法错误的是
的粒子数目随时间变化的曲线如图所示。下列说法错误的是
A.反应中的还原剂是 |
B.氧化性: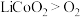 |
| C.反应配平后氧化剂与还原剂的化学计量数之比为2:1 |
D.每生成2分子 转移8个电子 转移8个电子 |
您最近一年使用:0次
解题方法
6 . 羰基硫( ,沸点:
,沸点: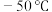 )又称氧硫化碳,其结构与
)又称氧硫化碳,其结构与 类似.回答下列问题:
类似.回答下列问题:
(1)实验室中通常用粉状硫氰化钾、水和浓硫酸反应制备 ,同时生成两种硫酸氢盐。写出该反应的化学方程式:
,同时生成两种硫酸氢盐。写出该反应的化学方程式:__________________________________ .
(2)以 为原料制备其他含硫物质的流程如下(部分产物已略去):
为原料制备其他含硫物质的流程如下(部分产物已略去):
 溶液
溶液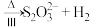
①反应Ⅰ中另一种产物是_____________ 。
②写出反应Ⅲ的离子方程式:_____________________________________________ 。
(3) 和
和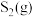 反应是制备
反应是制备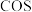 的另一种方法。恒温下,向体积为
的另一种方法。恒温下,向体积为 密闭容器中分别充入
密闭容器中分别充入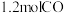 和
和 ,发生反应:
,发生反应: 后达到平衡状态,测得混合体系中含
后达到平衡状态,测得混合体系中含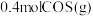 。
。
①平衡时, 的浓度为
的浓度为_____________  ;
; 内用
内用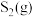 表示的化学反应速率
表示的化学反应速率_____________  。
。
②下列描述中能说明上述反应已达平衡状态的是_____________ (填字母)。
a.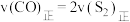
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器内气体压强保持不变
 ,沸点:
,沸点: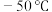 )又称氧硫化碳,其结构与
)又称氧硫化碳,其结构与 类似.回答下列问题:
类似.回答下列问题:(1)实验室中通常用粉状硫氰化钾、水和浓硫酸反应制备
 ,同时生成两种硫酸氢盐。写出该反应的化学方程式:
,同时生成两种硫酸氢盐。写出该反应的化学方程式:(2)以
 为原料制备其他含硫物质的流程如下(部分产物已略去):
为原料制备其他含硫物质的流程如下(部分产物已略去): 溶液
溶液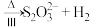
①反应Ⅰ中另一种产物是
②写出反应Ⅲ的离子方程式:
(3)
 和
和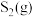 反应是制备
反应是制备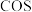 的另一种方法。恒温下,向体积为
的另一种方法。恒温下,向体积为 密闭容器中分别充入
密闭容器中分别充入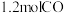 和
和 ,发生反应:
,发生反应: 后达到平衡状态,测得混合体系中含
后达到平衡状态,测得混合体系中含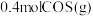 。
。①平衡时,
 的浓度为
的浓度为 ;
; 内用
内用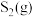 表示的化学反应速率
表示的化学反应速率 。
。②下列描述中能说明上述反应已达平衡状态的是
a.
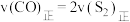
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器内气体压强保持不变
您最近一年使用:0次
名校
解题方法
7 . 每年夏天是菠萝上市的季节,有不少的消费者因为菠萝“扎嘴”的口感而放弃这一酸酸甜甜独具风味的水果。菠萝“扎嘴”的原因之一是菠萝中含有一种难溶于水的草酸钙针晶。隔绝空气条件下,16.4g草酸钙晶体(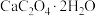 )受热分解过程的热重曲线(剩余固体质量随温度变化的曲线)如图所示,下列说法错误的是
)受热分解过程的热重曲线(剩余固体质量随温度变化的曲线)如图所示,下列说法错误的是
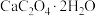 )受热分解过程的热重曲线(剩余固体质量随温度变化的曲线)如图所示,下列说法错误的是
)受热分解过程的热重曲线(剩余固体质量随温度变化的曲线)如图所示,下列说法错误的是
| A.草酸钙晶体中碳元素的化合价为+3价 |
B.物质M的化学式为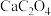 |
C.温度由200~520℃阶段,反应的化学方程式为 |
| D.温度高于940℃,所得物质X的俗名为熟石灰 |
您最近一年使用:0次
2023-10-08更新
|
183次组卷
|
3卷引用:陕西省榆林市靖边县靖边中学、绥德中学、府谷中学联考2023-2024学年高三上学期10月月考化学试题
名校
解题方法
8 . 以含钴废料(主要成分 ,难溶于水,还含有少量
,难溶于水,还含有少量 、
、 、PbO杂质)为原料,制备
、PbO杂质)为原料,制备 工艺流程如图所示。
工艺流程如图所示。

流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)滤渣1为___________ (填化学式,下同);滤渣2为___________ 。
(2)“浸取”时, 发生反应的化学方程式为
发生反应的化学方程式为___________ ( 中Co转化为
中Co转化为 )。
)。
(3)“氧化”时加入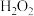 的作用是
的作用是___________ (用离子方程式表示),“沉锂”时加入NaF的作用是___________ 。
(4)“调pH”时,pH的范围为___________ 。
(5)“沉钴”时, 溶液滴加过快会导致产品不纯,其原因是
溶液滴加过快会导致产品不纯,其原因是___________ 。
 ,难溶于水,还含有少量
,难溶于水,还含有少量 、
、 、PbO杂质)为原料,制备
、PbO杂质)为原料,制备 工艺流程如图所示。
工艺流程如图所示。
流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 |
(1)滤渣1为
(2)“浸取”时,
 发生反应的化学方程式为
发生反应的化学方程式为 中Co转化为
中Co转化为 )。
)。(3)“氧化”时加入
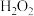 的作用是
的作用是(4)“调pH”时,pH的范围为
(5)“沉钴”时,
 溶液滴加过快会导致产品不纯,其原因是
溶液滴加过快会导致产品不纯,其原因是
您最近一年使用:0次
2023-08-15更新
|
203次组卷
|
2卷引用:陕西省榆林市“府、米、绥、横、靖”五校联考2022-2023学年高二下学期期末考试化学试题
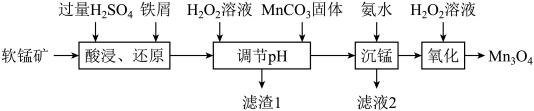
9 .  可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
25℃时,相关金属离子 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“酸浸、还原”时,为提高酸浸速率,可采取的措施有_______ (举1例)。
(2)“酸浸、还原”后溶液中含有的金属阳离子有 、
、_______ (填离子符号),铁屑、 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
(3)“调节pH”时,加入 溶液的目的是
溶液的目的是_______ ,“调节pH”的范围为_______ 。滤渣1的主要成分是 、
、 和
和_______ 。
(4)“沉锰”时发生反应的离子方程式为_______ 。
(5)“氧化”时一般控制温度在80℃~85℃,可采取的加热方法是_______ 。
 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
25℃时,相关金属离子
 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.3 | 3.4 | 8.1 |
| 沉淀完全的pH | 2.8 | 8.3 | 4.7 | 10.1 |
(1)“酸浸、还原”时,为提高酸浸速率,可采取的措施有
(2)“酸浸、还原”后溶液中含有的金属阳离子有
 、
、 与
与 反应的离子方程式为
反应的离子方程式为(3)“调节pH”时,加入
 溶液的目的是
溶液的目的是 、
、 和
和(4)“沉锰”时发生反应的离子方程式为
(5)“氧化”时一般控制温度在80℃~85℃,可采取的加热方法是
您最近一年使用:0次
10 . 亚硝酸钠(NaNO2)主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用NOx制备亚硝酸钠,简易流程如图。
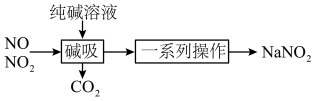
已知:NO2 + NO+ Na2CO3=2NaNO2 + CO2,2NO2 + Na2CO3= NaNO2 + NaNO3 +CO2。

(1)N2的结构式为___________ ;利用饱和NH4Cl溶液和饱和NaNO2溶液在加热条件下反应可制得N2,该反应的化学方程式为___________ 。
(2)装置C中盛装饱和Na2CO3溶液的仪器的名称是___________ ;NO不能单独被纯碱溶液吸收,为了使NOx完全被碱液吸收且产品纯度高,x=___________ 。
(3)装置D的作用是___________ ,采用“倒置漏斗”措施的目的是___________ 。
(4)实验完毕后,从装置C中分离出NaNO2固体产品(不含Na2CO3杂质)。设计实验探究NaNO2的性质。取少量NaNO2固体产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如表。
上述实验___________ (填标号 )的结论不可靠,理由是___________ 。以上经实验测得实验丙反应后的溶液中氮元素仅以 的形式存在,酸性KMnO4溶液与
的形式存在,酸性KMnO4溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
(5)吸光光度法是借助分光光度计测定溶液的吸光度,根据朗伯一比耳定律确定物质溶液的浓度。亚硝酸钠标准曲线数据如表所示。(已知:稀溶液的吸光度与浓度成正比)
取0.001gNaNO2样品溶于蒸馏水配成1000mL稀溶液,取4.00mL该稀溶液测得吸光度为2.7000,对比标准曲线数据可知,该亚硝酸钠产品纯度为___________ (结果保留三位有效数字,已知1 μg=10-6 g)。

已知:NO2 + NO+ Na2CO3=2NaNO2 + CO2,2NO2 + Na2CO3= NaNO2 + NaNO3 +CO2。

(1)N2的结构式为
(2)装置C中盛装饱和Na2CO3溶液的仪器的名称是
(3)装置D的作用是
(4)实验完毕后,从装置C中分离出NaNO2固体产品(不含Na2CO3杂质)。设计实验探究NaNO2的性质。取少量NaNO2固体产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如表。
| 实验 | 实验操作及现象 | 结论 |
| 甲 | 滴入无色酚酞溶液中,无色酚酞溶液变红 | HNO2是弱酸 |
| 乙 | 滴入少量酸性KI-淀粉溶液中,振荡,酸性KI-淀粉溶液变蓝 | 酸性条件下,  具有氧化性 具有氧化性 |
| 丙 | 滴入少量酸性KMnO4溶液中,振荡,酸性KMnO4溶液褪色 | 酸性条件下 ,  具有还原性 具有还原性 |
 的形式存在,酸性KMnO4溶液与
的形式存在,酸性KMnO4溶液与 反应的离子方程式为
反应的离子方程式为(5)吸光光度法是借助分光光度计测定溶液的吸光度,根据朗伯一比耳定律确定物质溶液的浓度。亚硝酸钠标准曲线数据如表所示。(已知:稀溶液的吸光度与浓度成正比)
| 标准使用液浓度/(μg·mL−1) | 取标准液体积/mL | 相当于亚硝酸钠的质量/μg | 吸光度A |
| 1 | 4 | 4 | 2.7045 |
您最近一年使用:0次