名校
1 . “钛合金材料”被称为“二十一世纪金属材料”,某科研探究小组利用钛铁矿(主要成分为FeO-TiO2)提取金属钛,其主要流程如图所示。
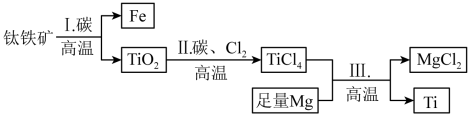
已知:①常温下钛( )与酸、碱均不反应,高温下能被空气氧化;
)与酸、碱均不反应,高温下能被空气氧化;
② 极为活泼,易水解,在空气中会与水蒸气形成烟雾。
极为活泼,易水解,在空气中会与水蒸气形成烟雾。
下列有关叙述错误的是

已知:①常温下钛(
 )与酸、碱均不反应,高温下能被空气氧化;
)与酸、碱均不反应,高温下能被空气氧化;②
 极为活泼,易水解,在空气中会与水蒸气形成烟雾。
极为活泼,易水解,在空气中会与水蒸气形成烟雾。下列有关叙述错误的是
| A.步骤I中粉碎钛铁矿和碳可使反应物充分接触以加速反应 |
B.步骤II中发生反应的化学方程式: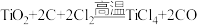 |
C.步骤III为镁粉与 溶液发生反应: 溶液发生反应: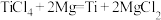 |
| D.可用稀硫酸或稀盐酸除去金属钛中的少量镁单质 |
您最近一年使用:0次
2022-08-06更新
|
245次组卷
|
5卷引用:宁夏银川市贺兰县景博中学2022-2023学年高三上学期第二次月考化学试题
解题方法
2 . 含氯消毒剂和过氧化物消毒剂均可有效灭杀新冠病毒。
Ⅰ.二氧化氯(ClO2) 是目前国际上公认的第四代高效、无毒的广谱消毒剂。制备ClO2常见的方法有:
方法 1: 2NaClO3+2NaCl+2H2SO4 = 2ClO2↑+Cl2↑+2Na2SO4+2H2O
方法2:在酸性条件下,由NaClO3和双氧水反应制备ClO2。
(1)ClO2中氯元素的化合价是_______ ,H2O2的电子式是_______ 。
(2)方法1的反应中,氧化产物与还原产物的物质的量之比是_______ 。
(3)方法2发生反应的离子方程式是_______ 。
(4)和方法2比较,方法1的不足之处是_______ ( 写出一点即可)。
Ⅱ.过碳酸钠(2Na2CO3·3H2O2),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:2Na2CO3 (aq) +3H2O2 (aq) = 2Na2CO3·3H2O2 (aq) ΔH<0。
(5)已知过氧化氢受热易分解,则碳酸钠与过氧化氢的物质的量之比应_______ (填“>”、“<”或“=”)2: 3,且加入Na2CO3溶液速度不能过快,原因是 _______ 。
Ⅰ.二氧化氯(ClO2) 是目前国际上公认的第四代高效、无毒的广谱消毒剂。制备ClO2常见的方法有:
方法 1: 2NaClO3+2NaCl+2H2SO4 = 2ClO2↑+Cl2↑+2Na2SO4+2H2O
方法2:在酸性条件下,由NaClO3和双氧水反应制备ClO2。
(1)ClO2中氯元素的化合价是
(2)方法1的反应中,氧化产物与还原产物的物质的量之比是
(3)方法2发生反应的离子方程式是
(4)和方法2比较,方法1的不足之处是
Ⅱ.过碳酸钠(2Na2CO3·3H2O2),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:2Na2CO3 (aq) +3H2O2 (aq) = 2Na2CO3·3H2O2 (aq) ΔH<0。
(5)已知过氧化氢受热易分解,则碳酸钠与过氧化氢的物质的量之比应
您最近一年使用:0次
名校
3 . 高铜酸钾是一种难溶于水的黑色粉末状固体,与高铁酸钾性质相似。可以由四羟基合铜酸钾和次溴酸在冰水浴中合成:①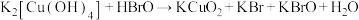 (未配平)。高铜酸钾在酸性条件下不稳定:②
(未配平)。高铜酸钾在酸性条件下不稳定:② (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是
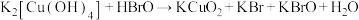 (未配平)。高铜酸钾在酸性条件下不稳定:②
(未配平)。高铜酸钾在酸性条件下不稳定:② (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是| A.①中氧化剂和还原剂的物质的量之比为1:2 |
B.②若有标况下5.6L 生成,转移电子 生成,转移电子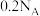 |
C.②中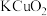 既表现氧化性,又表现还原性 既表现氧化性,又表现还原性 |
D.由①②可知氧化性强弱顺序为: |
您最近一年使用:0次
2022-06-07更新
|
965次组卷
|
6卷引用:宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题
宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题山东省德州市2022届高考三模化学试题(已下线)1.3.2 氧化性、还原性强弱的判断(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)(已下线)第03讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题
名校
4 . 硫化氢的转化是资源利用的研究课题。将H2S和空气的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化历程如图所示。下列说法正确的是
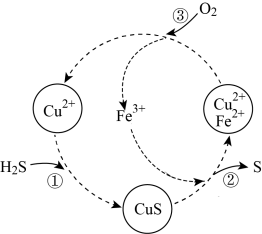
| A.历程①发生反应的离子方程式为S2-+Cu2+= CuS↓ | B.历程②中CuS作氧化剂 |
| C.历程③中n(Fe2+):n(O2)=4 :1 | D.转化的总反应为H2S=H2+ S |
您最近一年使用:0次
2022-05-29更新
|
1628次组卷
|
8卷引用:宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题
宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题安徽师范大学附属中学2022届高三适应性考试理综化学试题(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第06讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(全国通用)陕西省西安中学 2023 届高三上学期第二次质量检测化学试题辽宁省沈阳市重点高中联盟2022-2023学年高三上学期期中检测化学试题湖南省郴州市2022-2023学年高一下学期期末考试(选择考)化学试题福建省厦门大学附属实验中学2023—2024学年高一上学期第二次月考化学试卷
名校
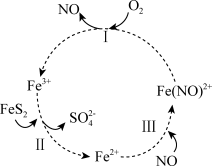
5 . 在酸性条件下,黄铁矿( )催化氧化的反应方程式为
)催化氧化的反应方程式为 。实现该反应的物质间转化如图所示。下列分析错误的是
。实现该反应的物质间转化如图所示。下列分析错误的是
 )催化氧化的反应方程式为
)催化氧化的反应方程式为 。实现该反应的物质间转化如图所示。下列分析错误的是
。实现该反应的物质间转化如图所示。下列分析错误的是
A.反应Ⅰ的离子方程式为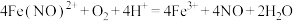 |
B.反应Ⅱ的氧化剂是 |
C.反应Ⅲ的离子方程式为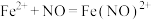 ,该反应是氧化还原反应 ,该反应是氧化还原反应 |
| D.在酸性条件下,黄铁矿催化氧化中NO作催化剂 |
您最近一年使用:0次
2022-05-28更新
|
2165次组卷
|
11卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题
宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题江苏省徐州市沛县2021-2022学年高一下学期第二次学情调研化学试题(已下线)第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)(已下线)1.3.3 氧化还原反应方程式配平(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)安徽省舒城中学2022-2023学年高一上学期第二次月考化学试题湖北省襄阳市第一中学2022-2023学年高一上学期10月月考化学试题山西省晋城市第一中学(丹河校区)2022-2023学年高一上学期第二次调研考试化学试题山西省实验中学2022-2023学年高一上学期第一次月考化学试题辽宁省葫芦岛市普通高中2022-2023学年高一上学期学业质量监测(期末)考试化学试题江西省万载中学创新班2022-2023学年高一下学期期中考试化学试题四川省成都市成华区某校2023-2024学年高一上学期12月月考化学试题
名校
6 . 科学家研究了钒系 催化剂催化脱硝机理,部分反应机理如下图所示。有关该过程的叙述不正确的是(注:V和O元素右上角符号表示其元素化合价)
催化剂催化脱硝机理,部分反应机理如下图所示。有关该过程的叙述不正确的是(注:V和O元素右上角符号表示其元素化合价)
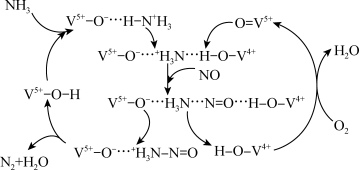
 催化剂催化脱硝机理,部分反应机理如下图所示。有关该过程的叙述不正确的是(注:V和O元素右上角符号表示其元素化合价)
催化剂催化脱硝机理,部分反应机理如下图所示。有关该过程的叙述不正确的是(注:V和O元素右上角符号表示其元素化合价)
A. 是反应中间体 是反应中间体 | B.反应过程中V的成键数目发生变化 |
C.反应过程中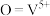 被还原 被还原 | D.脱硝反应为: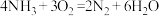 |
您最近一年使用:0次
2022-05-20更新
|
1275次组卷
|
4卷引用:宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题(尖子班)
宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题(尖子班)广东省2022届高三综合能力测试(三)化学试题(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)新疆维吾尔自治区乌鲁木齐市实验学校2023-2024学年高三上学期1月月考化学试题
7 . 黄铁矿(主要成分为 )因其呈浅黄铜色,且具有明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。在酸性条件和催化剂的作用下
)因其呈浅黄铜色,且具有明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。在酸性条件和催化剂的作用下 可发生如图所示的转化。下列分析错误的是
可发生如图所示的转化。下列分析错误的是
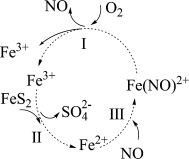
 )因其呈浅黄铜色,且具有明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。在酸性条件和催化剂的作用下
)因其呈浅黄铜色,且具有明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。在酸性条件和催化剂的作用下 可发生如图所示的转化。下列分析错误的是
可发生如图所示的转化。下列分析错误的是 
| A.反应Ⅰ、Ⅱ为氧化还原反应 |
B.反应Ⅰ的离子方程式: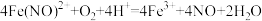 |
C.反应Ⅱ中,每消耗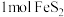 ,转移电子的物质的量为 ,转移电子的物质的量为 |
D.在酸性条件下,黄铁矿催化氧化中 和 和 均作催化剂 均作催化剂 |
您最近一年使用:0次
2022-04-20更新
|
371次组卷
|
5卷引用:宁夏固原市第一中学2023届高三上学期第二次月考化学试题
宁夏固原市第一中学2023届高三上学期第二次月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高三上学期期中考试化学试题辽宁省沈阳市同泽高级中学2020--2021 学年高一下学期4月月考化学试卷(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)江西省宜春市丰城市东煌学校2022-2023学年高三上学期期中考试化学试卷
名校
8 . 一种海水提溴的部分工艺流程如图所示。下列说法错误的是
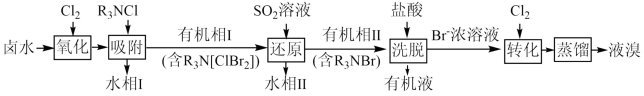

A.“氧化”和“转化”工序中 的主要作用相同 的主要作用相同 |
B.水相Ⅰ和水相Ⅱ中均含有 和 和 |
C.“洗脱”工序可完成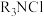 的再生 的再生 |
| D.保存液溴时加适量水的主要作用是防止溴单质被氧化 |
您最近一年使用:0次
2022-04-16更新
|
2360次组卷
|
9卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题
宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题湖南省隆回县第二中学2021-2022学年高三4月模拟考试化学试题(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编(已下线)微专题02 化学与STSE-备战2023年高考化学一轮复习考点微专题(已下线)微专题19 海水资源的综合利用(提取溴和碘)-备战2023年高考化学一轮复习考点微专题江苏省灌南高级中学2023-2024学年高三上学期暑期检测(二)化学试题江苏省靖江高级中学、华罗庚中学2023-2024学年高三上学期第一次阶段考试化学试题江苏省扬州中学2022-2023学年高三上学期11月月考化学试题江苏省南京师范大学苏州实验学校2023-2024学年高三上学期零模考试热身练化学试题
名校
9 . 实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平)KClO3+HCl—KCl+Cl2↑+H2O。
(1)配平上述反应化学方程式:______ 。
(2)若产生0.1molCl2,则转移电子的物质的量为_______ mol。
(3)在该反应中,如有6molCl2生成,被氧化的HCl的物质的量是_____ mol,转移电子是______ mol。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与 物质的量之比为1∶1的混合液,反应的化学方程式是
物质的量之比为1∶1的混合液,反应的化学方程式是_____ 。
(5)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_____ 。
(1)配平上述反应化学方程式:
(2)若产生0.1molCl2,则转移电子的物质的量为
(3)在该反应中,如有6molCl2生成,被氧化的HCl的物质的量是
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与
 物质的量之比为1∶1的混合液,反应的化学方程式是
物质的量之比为1∶1的混合液,反应的化学方程式是(5)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题:
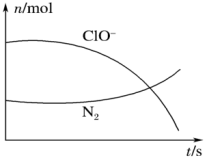
(1)某反应体系中有H2O、ClO-、NH 、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式
、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式_______ ,消耗1 mol还原剂,转移电子数为_______ 。
(2)Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是_______ ,相关反应的离子方程式是_______ 。
(3)根据反应8NH3+3Cl2=6NH4Cl+N2,当有68 g NH3参加反应时,被氧化的物质为_______ ,生成的还原产物的质量为_______ g。
(4)K2FeO4(铁元素为+6价)可用作水处理剂,它可由以下反应制得,请配平下列离子方程式_____ 。
_______Cl2 + _______ Fe(OH)3+_______ OH- = _______ FeO + _______ Cl- +_______ H2O
+ _______ Cl- +_______ H2O
(1)某反应体系中有H2O、ClO-、NH
 、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式
、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式
(2)Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是
(3)根据反应8NH3+3Cl2=6NH4Cl+N2,当有68 g NH3参加反应时,被氧化的物质为
(4)K2FeO4(铁元素为+6价)可用作水处理剂,它可由以下反应制得,请配平下列离子方程式
_______Cl2 + _______ Fe(OH)3+_______ OH- = _______ FeO
 + _______ Cl- +_______ H2O
+ _______ Cl- +_______ H2O
您最近一年使用:0次



