1 . 下列反应的离子反应方程式正确的是
A.二氧化碳通入饱和碳酸钠溶液中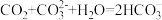 |
B.氯气通入冷的氢氧化钠溶液中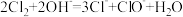 |
C.硫酸亚铁溶液中加入过氧化氢溶液 |
D. 使酸性 使酸性 溶液褪色: 溶液褪色: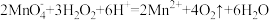 |
您最近一年使用:0次
2021-11-19更新
|
117次组卷
|
2卷引用:宁夏银川市景博中学2021-2022学年高三上学期第二次月考化学试题
2 . 高锰酸钾是一种强氧化剂,为紫黑色、细长的棱形结晶或颗粒,带蓝色的金属光泽,可溶于水。根据所学知识,回答下列问题:
(1)酸性条件下,高锰酸钾可与草酸( )溶液发生反应,其反应为
)溶液发生反应,其反应为 。
。
①补上产物,配平化学方程式___________ 。
②上述反应中 表现的性质有
表现的性质有___________ 。
(2)若将 通入硫酸酸化的
通入硫酸酸化的 溶液中,溶液褪色,生成
溶液中,溶液褪色,生成 ,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:
,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:___________ ,该反应中作还原剂的是___________ (填化学式)。
(3)高锰酸钾还可与浓盐酸反应,写出其化学方程式___________ ,其中浓盐酸表现酸性与还原性的物质的量之比为:___________ 。
(1)酸性条件下,高锰酸钾可与草酸(
 )溶液发生反应,其反应为
)溶液发生反应,其反应为 。
。①补上产物,配平化学方程式
②上述反应中
 表现的性质有
表现的性质有(2)若将
 通入硫酸酸化的
通入硫酸酸化的 溶液中,溶液褪色,生成
溶液中,溶液褪色,生成 ,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:
,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:(3)高锰酸钾还可与浓盐酸反应,写出其化学方程式
您最近一年使用:0次
3 . 水体中过量氨氮(以NH3表示)或总氮(溶液中所有可溶性的含氮化合物中氮元素总量)含量过高会导致水体富营养化。用次氯酸钠除去氨氮的一种原理如下图所示,下列说法正确的是
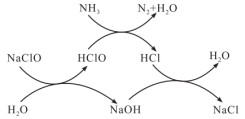

| A.NaClO除去氨氮的总反应化学方程式2NH3+3NaClO=N2+3NaCl+3H2O |
| B.整个过程中发生的反应都是氧化还原反应 |
| C.在较高温度下,氨氮去除率会升高 |
| D.NaClO投入过多,总氮去除率可能会升高 |
您最近一年使用:0次
2021-11-01更新
|
144次组卷
|
2卷引用:宁夏北方民族大学附属中学2022-2023学年高三上学期月考(一)理科综合化学试题
名校
解题方法
4 . 交警通常用一种“酒精检测仪”检查司机呼出气体中的酒精含量,其反应原理为C2H5OH+4CrO3+6H2SO4=2R+2CO2↑+9H2O,反应中红色的CrO3转变为绿色的化合物R,则R的化学式应为
| A.Cr2O3 | B.CrSO3 | C.Cr2(SO4)3 | D.CrS |
您最近一年使用:0次
2021-10-11更新
|
111次组卷
|
2卷引用:宁夏银川唐徕回民中学2021-2022学年高一10月月考化学试题
名校
5 . Ⅰ.磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采用的措施为_______ (写一条即可)
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、 ,请写出主要反应的离子方程式
,请写出主要反应的离子方程式_______ 。
(3)溶浸后的溶液中含有少量Fe2+、Cu2+、Ca2+,则“氧化除铁”过程中加入适量的软锰矿的目的是_______ 。
(4)“净化”工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要成分是_______ (填化学式)和CaF2
(5)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是_______ 。
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:
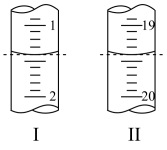
(6)消耗Na2S2O3标准溶液的体积为_______ mL。
(7)原样品中高铁酸钾的质量分数为_______ 。[M(K2FeO4)=198g/mol]
(8)若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数_______ (填“偏高”、“偏低”或“无影响”)。

回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采用的措施为
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、
 ,请写出主要反应的离子方程式
,请写出主要反应的离子方程式(3)溶浸后的溶液中含有少量Fe2+、Cu2+、Ca2+,则“氧化除铁”过程中加入适量的软锰矿的目的是
(4)“净化”工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要成分是
(5)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:

(6)消耗Na2S2O3标准溶液的体积为
(7)原样品中高铁酸钾的质量分数为
(8)若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数
您最近一年使用:0次
名校
6 . 为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合溶液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② Na2FeO2+
Na2FeO2+ NaNO2+
NaNO2+ H2O→
H2O→ Na2Fe2O4+
Na2Fe2O4+ NH3↑+
NH3↑+ NaOH
NaOH
③Na2FeO2+Na2Fe2O4+2H2O⇌Fe3O4+4NaOH
请回答下列问题:
(1)配平化学方程式②:_______
(2)上述反应①中被氧化的物质是_______ 。若有2mol Na2FeO2生成,则反应①中有_______ mol电子发生转移。
(3)关于“发蓝”的过程,下列说法不正确的是_______(填字母)。
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是_______ 。
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②
 Na2FeO2+
Na2FeO2+ NaNO2+
NaNO2+ H2O→
H2O→ Na2Fe2O4+
Na2Fe2O4+ NH3↑+
NH3↑+ NaOH
NaOH③Na2FeO2+Na2Fe2O4+2H2O⇌Fe3O4+4NaOH
请回答下列问题:
(1)配平化学方程式②:
(2)上述反应①中被氧化的物质是
(3)关于“发蓝”的过程,下列说法不正确的是_______(填字母)。
| A.该过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
您最近一年使用:0次
名校
7 . 某小组探究三草酸合铁酸钾(K3[Fe(C2O4)3]·3H2O)的热分解产物,按图所示装置进行实验。
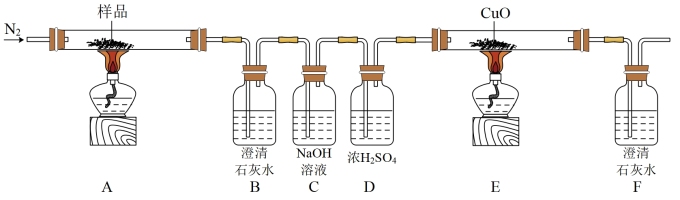
(1)通入N2的目的是___________ 。
(2)实验中观察到装置B变浑浊、E中固体变为红色、F变浑浊,由此可判断分解产物一定有___________ ,___________ 。
(3)样品完全分解后,装置A中的残留固体有FeO,Fe2O3和K2O,且FeO与Fe2O3的物质的量之比为2:1.再结合以上信息,写出三草酸合铁酸钾完全分解的化学方程式___________ 。
(4)为测定Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应,再用0.1000mol∙L-1硫代硫酸钠标准液滴定至终点,消耗标准液20.00mL(已知I2+2 =2I-+
=2I-+ )。
)。
①加热除去过量H2O2的目的是___________ 。
②加入KI溶液发生的离子方程式___________ 。
③溶液中铁元素的总含量为___________ g·L-1

(1)通入N2的目的是
(2)实验中观察到装置B变浑浊、E中固体变为红色、F变浑浊,由此可判断分解产物一定有
(3)样品完全分解后,装置A中的残留固体有FeO,Fe2O3和K2O,且FeO与Fe2O3的物质的量之比为2:1.再结合以上信息,写出三草酸合铁酸钾完全分解的化学方程式
(4)为测定Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应,再用0.1000mol∙L-1硫代硫酸钠标准液滴定至终点,消耗标准液20.00mL(已知I2+2
 =2I-+
=2I-+ )。
)。①加热除去过量H2O2的目的是
②加入KI溶液发生的离子方程式
③溶液中铁元素的总含量为
您最近一年使用:0次
2021-10-01更新
|
361次组卷
|
3卷引用:宁夏银川一中2022届高三第二次月考理科综合化学试题
宁夏银川一中2022届高三第二次月考理科综合化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)甘肃省会宁县第三中学2021-2022学年高三上学期第三次月考化学试题
8 . 已知硫酸酸化的K2Cr2O7溶液能与KI反应:aH2SO4+bK2Cr2O7+cKI=mK2SO4+nI2+pCr2(SO4)3+qH2O,下列说法错误的是
| A.a=7 |
| B.K2Cr2O7也可用盐酸酸化 |
| C.每生成1molCr2(SO4)3,转移6mole- |
| D.由上述反应可知,I-的还原性强于Cr3+的还原性 |
您最近一年使用:0次
2021-10-01更新
|
274次组卷
|
4卷引用:宁夏银川一中2022届高三第二次月考理科综合化学试题
名校
解题方法
9 . 完成下列填空
(1)某Fe2(SO4)3样品含有少量FeSO4杂质,将其配成溶液。
①若要检验溶液中的Fe3+,可加入___________ 试剂(填化学式),观察溶液呈血红色。
②若要检验溶液中的Fe2+,下列方法可行的是:___________ 。
A.取少量溶液于试管中,滴入几滴酸性高锰酸钾溶液,若紫红色褪去,则含有Fe2+
B.取少量溶液于试管中,加入新制氯水,再滴入硫氰化钾,若呈血红色,则含有Fe2+
C.取少量溶液于试管中,滴入NaOH溶液,看到白色沉淀迅速变为灰绿再变为红褐色,则含有Fe2+
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,某学习小组设计如图方案制备高铁酸钾:
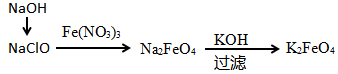
①高铁酸钾中铁元素的化合价为___________ ,据此推测它具有的化学性质是___________ 。
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,温度保持0℃反应1h,则采用的合适控温方式是___________ 。发生的离子反应为:___________ 。
③高铁酸钾和水发生反应,生成一种胶体能吸附杂质净水,同时还产生气体,写出反应的离子方程式:___________ 。
(1)某Fe2(SO4)3样品含有少量FeSO4杂质,将其配成溶液。
①若要检验溶液中的Fe3+,可加入
②若要检验溶液中的Fe2+,下列方法可行的是:
A.取少量溶液于试管中,滴入几滴酸性高锰酸钾溶液,若紫红色褪去,则含有Fe2+
B.取少量溶液于试管中,加入新制氯水,再滴入硫氰化钾,若呈血红色,则含有Fe2+
C.取少量溶液于试管中,滴入NaOH溶液,看到白色沉淀迅速变为灰绿再变为红褐色,则含有Fe2+
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,某学习小组设计如图方案制备高铁酸钾:
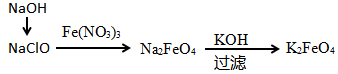
①高铁酸钾中铁元素的化合价为
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,温度保持0℃反应1h,则采用的合适控温方式是
③高铁酸钾和水发生反应,生成一种胶体能吸附杂质净水,同时还产生气体,写出反应的离子方程式:
您最近一年使用:0次
2021-09-19更新
|
284次组卷
|
2卷引用:宁夏海原第一中学2022届高三上学期第一次月考化学试题
名校
10 . 利用FeSO4制备还原铁粉的工艺流程如图:

下列说法错误的是

下列说法错误的是
A.转化过程发生反应的离子方程式为:Fe2++2HCO =FeCO3↓+H2O+CO2↑ =FeCO3↓+H2O+CO2↑ |
| B.可用NaOH溶液,检验沉淀是否洗涤干净 |
| C.干燥过程应在真空干燥器中进行,防止FeCO3被氧化 |
| D.“焙烧”时,若生成n(CO)∶n(CO2)=2∶1的混合气体,则参加反应的n(FeCO3)∶n(C)=4∶5 |
您最近一年使用:0次
2021-09-11更新
|
464次组卷
|
3卷引用:宁夏长庆高级中学 2021-2022学年高三上学期第一次月考化学试题
宁夏长庆高级中学 2021-2022学年高三上学期第一次月考化学试题河北省玉田县一中2022届高三上学期摸底考试化学试题(已下线)第二单元 化学物质及其变化(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)



