1 . 高锰酸钾是一种强氧化剂,为紫黑色、细长的棱形结晶或颗粒,带蓝色的金属光泽,可溶于水。根据所学知识,回答下列问题:
(1)酸性条件下,高锰酸钾可与草酸( )溶液发生反应,其反应为
)溶液发生反应,其反应为 。
。
①补上产物,配平化学方程式___________ 。
②上述反应中 表现的性质有
表现的性质有___________ 。
(2)若将 通入硫酸酸化的
通入硫酸酸化的 溶液中,溶液褪色,生成
溶液中,溶液褪色,生成 ,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:
,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:___________ ,该反应中作还原剂的是___________ (填化学式)。
(3)高锰酸钾还可与浓盐酸反应,写出其化学方程式___________ ,其中浓盐酸表现酸性与还原性的物质的量之比为:___________ 。
(1)酸性条件下,高锰酸钾可与草酸(
 )溶液发生反应,其反应为
)溶液发生反应,其反应为 。
。①补上产物,配平化学方程式
②上述反应中
 表现的性质有
表现的性质有(2)若将
 通入硫酸酸化的
通入硫酸酸化的 溶液中,溶液褪色,生成
溶液中,溶液褪色,生成 ,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:
,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:(3)高锰酸钾还可与浓盐酸反应,写出其化学方程式
您最近一年使用:0次
名校
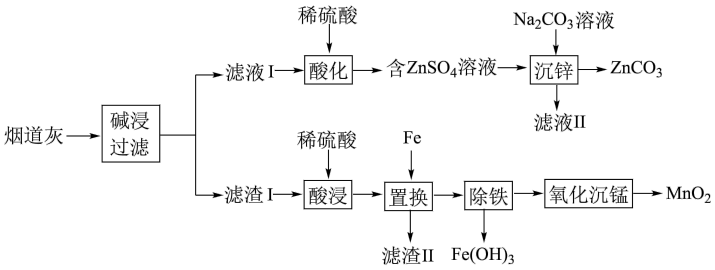
2 . 某炼铜厂烟道灰的主要成分为锌、锰、铁、铜的单质及氧化物,一种回收利用烟道灰的工艺流程如图所示:
②离子浓度小于等于10-5mol/L时认为沉淀完全;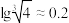 。
。
回答下列问题:
(1)“碱浸”时,Zn被浸出转化为Na2Zn(OH)4,Na2Zn(OH)4中Zn元素的化合价为_______ 。
(2)“沉锌”时防止碱性过强生成Zn(OH)2,可采取的措施为_______ (任写一条)。
(3)滤渣II的主要成分为_______ (填化学式)。
(4)“除铁”时先加入过量的H2O2溶液将Fe2+氧化为Fe3+,发生反应的离子方程式为_______ ;然后再调节溶液的pH为b,若此时c(Mn2+)=0.2 mol/L,则b的取值范围为_______ 。
(5)“氧化沉锰”过程中,MnSO4经O2氧化转化为MnO2,该反应中氧化剂和还原剂的物质的量之比为_______ ;基态锰原子的价层电子排布式为_______ 。
②离子浓度小于等于10-5mol/L时认为沉淀完全;
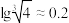 。
。回答下列问题:
(1)“碱浸”时,Zn被浸出转化为Na2Zn(OH)4,Na2Zn(OH)4中Zn元素的化合价为
(2)“沉锌”时防止碱性过强生成Zn(OH)2,可采取的措施为
(3)滤渣II的主要成分为
(4)“除铁”时先加入过量的H2O2溶液将Fe2+氧化为Fe3+,发生反应的离子方程式为
(5)“氧化沉锰”过程中,MnSO4经O2氧化转化为MnO2,该反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
2023-07-25更新
|
196次组卷
|
3卷引用:宁夏银川市贺兰一中2023-2024学年高二上学期第三阶段考试化学试题
名校
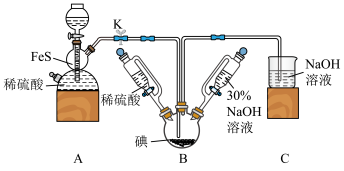
3 . 碘化钠可用于医学和摄影。实验室制备NaI的基本实验步骤为:①检查装置气密性;②关闭K,向B中滴入30%NaOH溶液3;③打开K,通入H2S至饱和制得NaI,同时有黄色沉淀产生;④关闭K,水浴加热,充分逸出H2S;⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸
(1)A装置中的仪器名称为_______ ,利用此装置还可以制取 _______ (任写一种合理即可)。
(2)盛稀硫酸和30%NaOH溶液的仪器与分液漏斗相比,其优点是_______ 。
(3)A装置中发生反应的化学方程式为_______ 。
(4)通入H2S至饱和,与NaIO3反应制得NaI的离子方程式为_______ 。
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、_______ 等操作。
(6)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为_______ 。
(1)A装置中的仪器名称为
(2)盛稀硫酸和30%NaOH溶液的仪器与分液漏斗相比,其优点是
(3)A装置中发生反应的化学方程式为
(4)通入H2S至饱和,与NaIO3反应制得NaI的离子方程式为
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、
(6)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为
您最近一年使用:0次
2023-09-26更新
|
167次组卷
|
2卷引用:宁夏六盘山高级中学2023-2024学年高三一模考试化学试题
名校
解题方法
4 . 以太阳能为热源分解 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。下列说法错误的是
的过程如图所示。下列说法错误的是
 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。下列说法错误的是
的过程如图所示。下列说法错误的是
| A.过程Ⅰ、Ⅱ发生的反应均属于氧化还原反应 |
| B.该制氢过程中,固体的颜色不会发生变化 |
C.过程Ⅰ中每消耗116g ,理论上转移2mol电子 ,理论上转移2mol电子 |
D.过程Ⅱ的化学方程式为 |
您最近一年使用:0次
2023-12-31更新
|
154次组卷
|
5卷引用:宁夏回族自治区石嘴山市第一中学2023-2024学年高一下学期7月期末化学试题
解题方法
5 . 用软锰矿(主要成分为MnO2,所含杂质为质量分数约8%Fe3O4和约5%Al2O3)和BaS制备高纯MnCO3,同时制得Ba(OH)2,工艺流程如下:
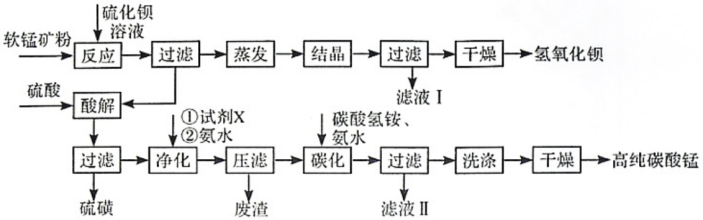
已知:25℃时相关物质的Ksp见下表
回答下列问题:
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为___________ ,能否通过加热的方式加快该反应的速率,___________ (填“能”或“否”)
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是___________ 。
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为___________ 。
(4)净化时需先加入的试剂X为___________ (填化学式) 。再使用氨水调溶液的pH,则pH的理论最小值为___________ (当溶液中某离子浓度小于1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为___________ 。

已知:25℃时相关物质的Ksp见下表
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 |
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为
(4)净化时需先加入的试剂X为
(5)碳化过程中发生反应的离子方程式为
您最近一年使用:0次
2021-03-14更新
|
453次组卷
|
3卷引用:宁夏石嘴山市2021届高三下学期3月高考质量监测(一模) 化学试题
名校
解题方法
6 . 含有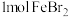 的溶液中,通入
的溶液中,通入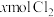 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是
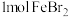 的溶液中,通入
的溶液中,通入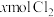 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是A.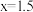 , ,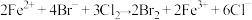 |
B.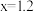 , ,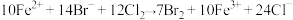 |
C. , ,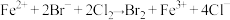 |
D. , ,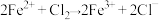 |
您最近一年使用:0次
2021-04-08更新
|
674次组卷
|
4卷引用:宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题
宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题上海市金山区2021届高三二模化学试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)陕西省西安市铁一中学2023-2024学年高一上学期第二次月考化学试题
7 . 黄铁矿(主要成分为 )因其呈浅黄铜色,且具有明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。在酸性条件和催化剂的作用下
)因其呈浅黄铜色,且具有明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。在酸性条件和催化剂的作用下 可发生如图所示的转化。下列分析错误的是
可发生如图所示的转化。下列分析错误的是
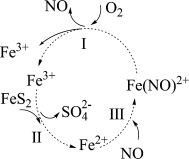
 )因其呈浅黄铜色,且具有明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。在酸性条件和催化剂的作用下
)因其呈浅黄铜色,且具有明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。在酸性条件和催化剂的作用下 可发生如图所示的转化。下列分析错误的是
可发生如图所示的转化。下列分析错误的是 
| A.反应Ⅰ、Ⅱ为氧化还原反应 |
B.反应Ⅰ的离子方程式: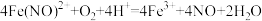 |
C.反应Ⅱ中,每消耗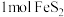 ,转移电子的物质的量为 ,转移电子的物质的量为 |
D.在酸性条件下,黄铁矿催化氧化中 和 和 均作催化剂 均作催化剂 |
您最近一年使用:0次
2022-04-20更新
|
382次组卷
|
5卷引用:宁夏固原市第一中学2023届高三上学期第二次月考化学试题
宁夏固原市第一中学2023届高三上学期第二次月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高三上学期期中考试化学试题辽宁省沈阳市同泽高级中学2020--2021 学年高一下学期4月月考化学试卷(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)江西省宜春市丰城市东煌学校2022-2023学年高三上学期期中考试化学试卷
名校
8 . O3具有强氧化性,将O3通入KI溶液中发生反应: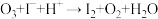 (未配平),下列说法正确的是
(未配平),下列说法正确的是
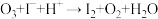 (未配平),下列说法正确的是
(未配平),下列说法正确的是A.配平后的离子方程式为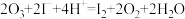 |
| B.每生成1分子I2,转移2个电子 |
| C.O2是还原产物之一 |
| D.该反应能说明O2的氧化性强于I2 |
您最近一年使用:0次
2020-09-04更新
|
655次组卷
|
7卷引用:2017届宁夏六盘山高级中学高三上第一次月考化学试卷
2017届宁夏六盘山高级中学高三上第一次月考化学试卷(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【押题专练】(已下线)衔接点09 氧化还原反应的表示-2020年【衔接教材·暑假作业】初高中衔接化学安徽省亳州市涡阳县育萃高级中学2019-2020学年高二下学期摸底考试化学试题人教版(2019)高一必修第一册第一章 物质及其变化 素养拓展区新疆伊犁奎屯市第一高级中学2020-2021学年高一上学期期末考试化学试题(已下线)衔接点09 氧化还原反应的表示-2021年初升高化学无忧衔接
名校
9 . 在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是


| A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O |
| B.反应Ⅱ的氧化剂是Fe3+ |
| C.反应Ⅲ是氧化还原反应 |
| D.黄铁矿催化氧化中NO作催化剂 |
您最近一年使用:0次
2019-09-04更新
|
806次组卷
|
16卷引用:宁夏回族自治区青铜峡市高级中学2021届高三上学期第二次月考化学试题
宁夏回族自治区青铜峡市高级中学2021届高三上学期第二次月考化学试题宁夏青铜峡市高级中学2021-2022学年高三上学期11月测试化学试题四川省成都市2020届高三高中毕业班摸底测试化学试题河北省衡水市衡水中学2019-2020学年高三上学期期中考试化学试题(已下线)考点03 氧化还原反应-2020年高考化学命题预测与模拟试题分类精编四川省成都南开为明学校2019-2020学年高二上学期期中考试化学试题广东省韶关市田家炳中学2020-2021学年高一上学期期中考试化学试题四川省绵阳市南山中学双语学校2020-2021学年高二下学期6月月考化学试题广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题(已下线)第4周 晚练题-备战2022年高考化学周测与晚练(新高考专用)江西省景德镇市2022届高三第一次模拟化学试题黑龙江省哈尔滨市德强高中2021-2022学年高一上学期期中考试化学试题黑龙江省大庆铁人中学2021-2022学年高一下学期第一次月考化学试题陕西省汉中中学2021-2022学年高二下学期6月月考化学试题辽宁省大连市金普新区省示范性高中联合体2021-2022学年高三上学期第二阶段考试化学试题(已下线)题型7 氧化还原反应原理在实际生产中的应用
名校
10 . 某小组探究三草酸合铁酸钾(K3[Fe(C2O4)3]·3H2O)的热分解产物,按图所示装置进行实验。
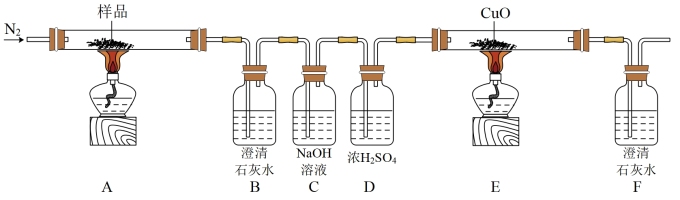
(1)通入N2的目的是___________ 。
(2)实验中观察到装置B变浑浊、E中固体变为红色、F变浑浊,由此可判断分解产物一定有___________ ,___________ 。
(3)样品完全分解后,装置A中的残留固体有FeO,Fe2O3和K2O,且FeO与Fe2O3的物质的量之比为2:1.再结合以上信息,写出三草酸合铁酸钾完全分解的化学方程式___________ 。
(4)为测定Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应,再用0.1000mol∙L-1硫代硫酸钠标准液滴定至终点,消耗标准液20.00mL(已知I2+2 =2I-+
=2I-+ )。
)。
①加热除去过量H2O2的目的是___________ 。
②加入KI溶液发生的离子方程式___________ 。
③溶液中铁元素的总含量为___________ g·L-1

(1)通入N2的目的是
(2)实验中观察到装置B变浑浊、E中固体变为红色、F变浑浊,由此可判断分解产物一定有
(3)样品完全分解后,装置A中的残留固体有FeO,Fe2O3和K2O,且FeO与Fe2O3的物质的量之比为2:1.再结合以上信息,写出三草酸合铁酸钾完全分解的化学方程式
(4)为测定Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应,再用0.1000mol∙L-1硫代硫酸钠标准液滴定至终点,消耗标准液20.00mL(已知I2+2
 =2I-+
=2I-+ )。
)。①加热除去过量H2O2的目的是
②加入KI溶液发生的离子方程式
③溶液中铁元素的总含量为
您最近一年使用:0次
2021-10-01更新
|
361次组卷
|
3卷引用:宁夏银川一中2022届高三第二次月考理科综合化学试题
宁夏银川一中2022届高三第二次月考理科综合化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)甘肃省会宁县第三中学2021-2022学年高三上学期第三次月考化学试题



