1 . 化学基本概念和研究方法要准确掌握,下列是某同学对有关物质进行分类的列表:
(1)上述三组分类中的错误物质有______ 种。
(2)砷是与磷相邻同主族元素,则其在周期表的位置是______ ;砷化氢的电子式:______ ,它是一种有剧毒恶臭的无色气体,还原性极强,能与硝酸银反应生成Ag和砒霜(As2O3),反应的离子方程式为______ 。
(3)已知: ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出______ 克I2(小数点后保留2位)。
(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是______ 。
(5)依据化学方程式,回答下列问题: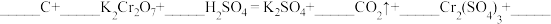
①配平完善化学方程式:_______________ 。
②H2SO4在上述反应中表现出来的性质是______ 。
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为______ L。
| 组序号 | 单质 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| ① | 灰砷(α-As) | Na2CO3 | H2C2O4 | K2SO4 | Na2O2 | SO3 |
| ② | 臭氧 | Fe(OH)3胶体 | H37Cl | KAl(SO4)2 | CaO | As2O3 |
| ③ | I2 | Al(OH)3 | CH3OH | K2Cr2O7 | Al2O3 | NO2 |
(2)砷是与磷相邻同主族元素,则其在周期表的位置是
(3)已知:
 ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是
(5)依据化学方程式,回答下列问题:
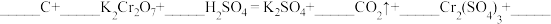
①配平完善化学方程式:
②H2SO4在上述反应中表现出来的性质是
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
2 . 对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
Ⅰ.现有以下物质:①H2O、②Al、③Fe3O4、④Fe(OH)3胶体、⑤FeBr2溶液、⑥干冰、⑦稀硫酸、⑧酒精、⑨Cl2。
(1)以上物质中属于混合物的是___________ (填序号,下同),既不属于电解质也不属于非电解质的是___________ 。
(2)向④中逐滴滴加⑦,可观察到的现象是___________ 。
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
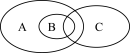
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是___________ (填字母)。
(4)写出物质③和⑦发生反应的离子方程式:___________ 。
(5)写出上述物质用于焊接钢轨的化学方程式:___________ 。
(6)向⑤中通入⑨,至Cl2与FeBr2物质的量相等时的离子方程式:___________ 。
Ⅰ.现有以下物质:①H2O、②Al、③Fe3O4、④Fe(OH)3胶体、⑤FeBr2溶液、⑥干冰、⑦稀硫酸、⑧酒精、⑨Cl2。
(1)以上物质中属于混合物的是
(2)向④中逐滴滴加⑦,可观察到的现象是
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(4)写出物质③和⑦发生反应的离子方程式:
(5)写出上述物质用于焊接钢轨的化学方程式:
(6)向⑤中通入⑨,至Cl2与FeBr2物质的量相等时的离子方程式:
您最近一年使用:0次
2023-08-10更新
|
138次组卷
|
2卷引用:山东省实验中学2022-2023学年高一上学期12月月考化学试题
解题方法
3 .  是一种常见的氧化剂和消毒剂,以软锰矿(主要成分为
是一种常见的氧化剂和消毒剂,以软锰矿(主要成分为 )为原料制备
)为原料制备 的方法如图所示:
的方法如图所示:
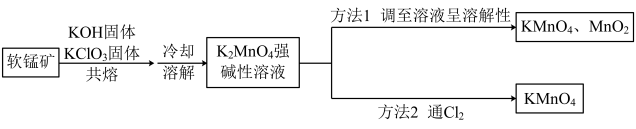
回答下列问题:
(1)共熔时能否用瓷坩埚做反应器___________ (填“能”或“否”)。
(2)方法1调至溶液呈弱碱性时反应的离子方程式为___________ 。
(3)方法2通 制备
制备 的装置如下图所示(夹持装置略):
的装置如下图所示(夹持装置略):
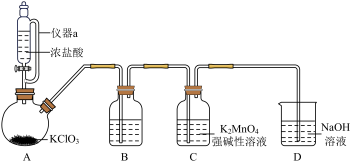
①仪器a的名称为___________ 。
②装置B中盛放的试剂为___________ (填试剂名称)。
③强碱性条件下,氧化性:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
④D中反应的离子方程式为___________ 。
 是一种常见的氧化剂和消毒剂,以软锰矿(主要成分为
是一种常见的氧化剂和消毒剂,以软锰矿(主要成分为 )为原料制备
)为原料制备 的方法如图所示:
的方法如图所示:
回答下列问题:
(1)共熔时能否用瓷坩埚做反应器
(2)方法1调至溶液呈弱碱性时反应的离子方程式为
(3)方法2通
 制备
制备 的装置如下图所示(夹持装置略):
的装置如下图所示(夹持装置略):
①仪器a的名称为
②装置B中盛放的试剂为
③强碱性条件下,氧化性:

 (填“
(填“ ”或“
”或“ ”)。
”)。④D中反应的离子方程式为
您最近一年使用:0次
名校
4 . 某工业脱硫过程如图所示。下列说法错误的是
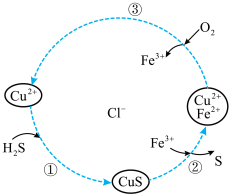

| A.过程①发生复分解反应 |
| B.过程②中发生反应的离子方程式为S2-+2Fe3+=S↓+2Fe2+ |
| C.过程③中每有标准状况下11.2LO2参加反应,转移2mol电子 |
| D.脱硫过程总反应为2H2S+O2=2H2O+2S |
您最近一年使用:0次
2023-02-10更新
|
378次组卷
|
2卷引用:山东省济南市2022-2023学年高一上学期期末考试化学试题
名校
5 . 某化学兴趣小组制取氯酸钾 和氯水并进行有关探究实验。利用下图所示的实验装置进行实验。
和氯水并进行有关探究实验。利用下图所示的实验装置进行实验。

(1)写出实验室制取 的化学方程式
的化学方程式_______ 。
(2)浓盐酸除了做还原剂还有_______ 作用。
(3) 与热的KOH溶液反应除了
与热的KOH溶液反应除了 和H2O外,还会生成
和H2O外,还会生成_______ (写化学式)。
(4)写出用NaOH溶液吸收尾气 的离子方程式
的离子方程式_______ 。
 和氯水并进行有关探究实验。利用下图所示的实验装置进行实验。
和氯水并进行有关探究实验。利用下图所示的实验装置进行实验。
(1)写出实验室制取
 的化学方程式
的化学方程式(2)浓盐酸除了做还原剂还有
(3)
 与热的KOH溶液反应除了
与热的KOH溶液反应除了 和H2O外,还会生成
和H2O外,还会生成(4)写出用NaOH溶液吸收尾气
 的离子方程式
的离子方程式
您最近一年使用:0次
名校
解题方法
6 .  具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。下列是制备
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。下列是制备 的一种流程:
的一种流程:

已知: 饱和溶液在低于
饱和溶液在低于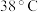 时析出
时析出 ,高于
,高于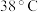 时析出
时析出 。
。
(1)写出“合成”中发生反应的离子方程式:___________ ,若生成 时,电子转移的数目是
时,电子转移的数目是___________ 。
(2)“转化”过程中, 的作用是
的作用是___________ (选填“氧化剂”或“还原剂”)。
(3)由 溶液得到
溶液得到 的操作为:蒸发浓缩,
的操作为:蒸发浓缩,___________ ,过滤洗涤,得到 产品。
产品。
 具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。下列是制备
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。下列是制备 的一种流程:
的一种流程:
已知:
 饱和溶液在低于
饱和溶液在低于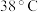 时析出
时析出 ,高于
,高于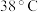 时析出
时析出 。
。(1)写出“合成”中发生反应的离子方程式:
 时,电子转移的数目是
时,电子转移的数目是(2)“转化”过程中,
 的作用是
的作用是(3)由
 溶液得到
溶液得到 的操作为:蒸发浓缩,
的操作为:蒸发浓缩, 产品。
产品。
您最近一年使用:0次
名校
7 . 海水提碘实验中,提取后可用“反萃取法”萃取、富集碘单质,下列说法错误的是
已知:
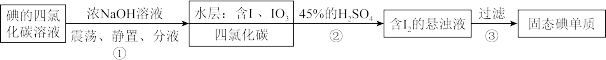
已知:

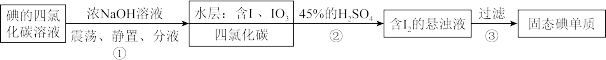
A.步骤①除 ,还可以用酒精作萃取剂 ,还可以用酒精作萃取剂 |
| B.分液时水层从分液漏斗下口放出 |
C.步骤②中发生反应的离子方程式为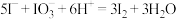 |
| D.步骤③操作中需要的玻璃仪器为漏斗、烧杯和玻璃棒 |
您最近一年使用:0次
2022-03-18更新
|
357次组卷
|
4卷引用:山东省济南市章丘区第四中学2021-2022学年高一下学期第一次质量检测化学试题
名校
解题方法
8 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

(1)质量相同的a和b,物质的量之比为_______ 。将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为_______ 。
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为_______ 。
(3)将足量的a通入BaCl2溶液中,下列说法正确的是_______ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2Ag2S + 2H2O。H2S在该反应中_______(填标号)。
(5)已知e为正盐,且能被酸性K2Cr2O7氧化为Na2SO4,Cr2O 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:_______ 。

(1)质量相同的a和b,物质的量之比为
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为
(3)将足量的a通入BaCl2溶液中,下列说法正确的是
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2Ag2S + 2H2O。H2S在该反应中_______(填标号)。
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂也是还原剂 | D.既不是氧化剂也不是还原剂 |
 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:
您最近一年使用:0次
2022-02-22更新
|
930次组卷
|
3卷引用:山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题
山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题(已下线)第03讲 硫酸根离子的检验 含硫物质的转化(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册) 辽宁省朝阳市建平县实验中学2021-2022学年高一下学期期中考试化学试题
名校
9 . 下列有关Fe3+、Fe2+的性质及应用的说法正确的是
①向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液,黄色逐渐消失,加KSCN后溶液颜色不变
②将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
③向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
④将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
⑤向Fe2(SO4)3溶液中加入过量铁粉的离子方程式:Fe3++Fe=2Fe2+
⑥Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
①向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液,黄色逐渐消失,加KSCN后溶液颜色不变
②将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
③向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
④将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
⑤向Fe2(SO4)3溶液中加入过量铁粉的离子方程式:Fe3++Fe=2Fe2+
⑥Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
| A.①②⑥ | B.①②③ | C.①④⑤ | D.②④⑥ |
您最近一年使用:0次
2021-12-18更新
|
4233次组卷
|
10卷引用:山东省济南第三中学2022-2023学年高一上学期12月月考化学试题
山东省济南第三中学2022-2023学年高一上学期12月月考化学试题吉林省洮南市第一中学2021-2022学年高一上学期第三次月考化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期12月月考化学试题江西省景德镇一中2022-2023学年高一上学期期中考试(19班)化学试题天津市南开区崇化中学2022-2023学年高一上学期期末质量检测化学试题江西省南昌市豫章中学20212-2022学年高一下学期第一次月考化学试题广东省汕尾华大实验学校2022-2023学年高一上学期12月月考化学试题新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题新疆乌鲁木齐市高级中学2023-2024学年高一上学期1月期末化学试题山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题
10 . 污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。利用软锰矿(主要成分为 ,含少量铁、铝、铜、镍等金属化合物)作脱硫剂,脱除燃煤尾气中的
,含少量铁、铝、铜、镍等金属化合物)作脱硫剂,脱除燃煤尾气中的 并制得
并制得 的流程如下:
的流程如下:

回答下列问题:
(1)过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、_______ ;其中玻璃棒的作用是________ 。
(2)下列各组试剂中,能检验“尾气”中SO2是否除尽的是_______ (填序号)。
a.氯化钡溶液 b.稀硫酸酸化的KMnO4溶液时 c.碘水和淀粉的混合溶液 d.NaOH溶液
(3)步骤II中所加碳酸盐最好为___________ (填化学式)。
(4)步骤IV中发生反应的离子方程式为___________ 。
(5)已知“含SO2的尾气”中 ,若软锰矿浆对SO2的有效吸收率为90%,处理1000m3含SO2的尾气,步骤Ⅰ得到硫酸锰的质量为
,若软锰矿浆对SO2的有效吸收率为90%,处理1000m3含SO2的尾气,步骤Ⅰ得到硫酸锰的质量为___________ kg。
 ,含少量铁、铝、铜、镍等金属化合物)作脱硫剂,脱除燃煤尾气中的
,含少量铁、铝、铜、镍等金属化合物)作脱硫剂,脱除燃煤尾气中的 并制得
并制得 的流程如下:
的流程如下:
回答下列问题:
(1)过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、
(2)下列各组试剂中,能检验“尾气”中SO2是否除尽的是
a.氯化钡溶液 b.稀硫酸酸化的KMnO4溶液时 c.碘水和淀粉的混合溶液 d.NaOH溶液
(3)步骤II中所加碳酸盐最好为
(4)步骤IV中发生反应的离子方程式为
(5)已知“含SO2的尾气”中
 ,若软锰矿浆对SO2的有效吸收率为90%,处理1000m3含SO2的尾气,步骤Ⅰ得到硫酸锰的质量为
,若软锰矿浆对SO2的有效吸收率为90%,处理1000m3含SO2的尾气,步骤Ⅰ得到硫酸锰的质量为
您最近一年使用:0次
2021-10-11更新
|
859次组卷
|
6卷引用:山东省济南市2021-2022学年高三上学期10月阶段性检测化学试题
山东省济南市2021-2022学年高三上学期10月阶段性检测化学试题山东省潍坊市2022届高三10月份阶段性检测化学试题山东省潍坊市五县市2022届高三上学期第一次联考化学试题(已下线)2022年新高考化学时事热点情境化考题---化工流程云南省弥勒市第一中学2021-2022学年高二下学期第四次月考化学试题(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)



