1 .  又称百毒净,可用于水的净化和纸张、纺织品的漂白等。用如图所示装置(夹持装置和加热装置省略)制备
又称百毒净,可用于水的净化和纸张、纺织品的漂白等。用如图所示装置(夹持装置和加热装置省略)制备 并探究
并探究 的某些性质,已知
的某些性质,已知 浓度较大时易分解爆炸。
浓度较大时易分解爆炸。
回答下列问题:
(1)通入空气的目的为_______ 。
(2)补充并配平实验中制备 的化学方程式:
的化学方程式:_______ 。
_______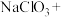 _______
_______ _______
_______ _______
_______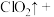 _______
_______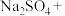 _______+_______
_______+_______
工业上也可用 氧化
氧化 溶液制取
溶液制取 ,写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:
,写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:_______ 。
(3)关闭止水夹②,打开止水夹①③,通入空气一段时间后,装置C中生成了 和气体,反应中
和气体,反应中 表现出
表现出_______ (填“氧化”或“还原”)性;若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______ 。
(4)D装置的作用是_______ 、_______ 。
(5) 和
和 在水处理过程中分别被还原为
在水处理过程中分别被还原为 和
和 。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么
。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么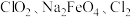 三种消毒杀菌剂的消毒效率由高到低的顺序是
三种消毒杀菌剂的消毒效率由高到低的顺序是_______ (填化学式)。
 又称百毒净,可用于水的净化和纸张、纺织品的漂白等。用如图所示装置(夹持装置和加热装置省略)制备
又称百毒净,可用于水的净化和纸张、纺织品的漂白等。用如图所示装置(夹持装置和加热装置省略)制备 并探究
并探究 的某些性质,已知
的某些性质,已知 浓度较大时易分解爆炸。
浓度较大时易分解爆炸。
回答下列问题:
(1)通入空气的目的为
(2)补充并配平实验中制备
 的化学方程式:
的化学方程式:_______
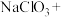 _______
_______ _______
_______ _______
_______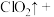 _______
_______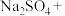 _______+_______
_______+_______
工业上也可用
 氧化
氧化 溶液制取
溶液制取 ,写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:
,写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:(3)关闭止水夹②,打开止水夹①③,通入空气一段时间后,装置C中生成了
 和气体,反应中
和气体,反应中 表现出
表现出(4)D装置的作用是
(5)
 和
和 在水处理过程中分别被还原为
在水处理过程中分别被还原为 和
和 。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么
。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么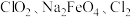 三种消毒杀菌剂的消毒效率由高到低的顺序是
三种消毒杀菌剂的消毒效率由高到低的顺序是
您最近一年使用:0次
名校
2 .  常温常压下为橙黄色气体,易溶于水,可用于水的净化和纸张、纺织品的漂白。
常温常压下为橙黄色气体,易溶于水,可用于水的净化和纸张、纺织品的漂白。 可在酸性条件下用
可在酸性条件下用 氧化
氧化 (二元弱酸)的反应原理来制备,现实验室用如图所示装置(部分夹持装置和加热装置省略)制取少量
(二元弱酸)的反应原理来制备,现实验室用如图所示装置(部分夹持装置和加热装置省略)制取少量 并探究其某些性质。
并探究其某些性质。

回答下列问题:
(1)简述对发生装置A进行气密性检查的过程:___________ 。
(2)E装置的作用是___________ 。
(3)若 的氧化产物为
的氧化产物为 ,则A中反应里,氧化剂与还原剂的物质的量之比为
,则A中反应里,氧化剂与还原剂的物质的量之比为___________ 。
(4)关闭弹簧夹②,打开弹簧夹①③,反应产生的 与装置C中物质反应生成了
与装置C中物质反应生成了 、水和某气体,写出该反应的化学方程式:
、水和某气体,写出该反应的化学方程式:___________ ,反应中若打开弹簧夹①②,关闭弹簧夹③,B中可观察到的现象为___________ 。
(5)NaOH溶液是化学实验室广泛使用的试剂,现有某瓶NaOH溶液的信息说明如下:质量分数为20%、密度为1.20g·cm-3、250mL、请稀释后使用。
①该“NaOH溶液”的物质的量浓度为___________ mol·L-1。(保留至小数点后一位)
②某同学要使用85mL1.5mol/L的NaOH稀溶液来进行某实验,实验员用上述的浓溶液来配制时,选用了规格为100mL的容量瓶,应用量筒量取浓碱液___________ mL。
③配制时,玻璃仪器除了容量瓶、烧杯、量筒外,还需要___________ 。
④实验配制中的下列情况,会导致所配溶液物质的量浓度偏低的是___________ (填标号)。
A.容量瓶底部有少量蒸馏水未进行处理 B.量取浓溶液时,仰视量筒刻度线
C.稀释、移液后的烧杯及玻璃棒未洗涤 D.移液时有少量洗涤液滴落到瓶外
E.定容时俯视容量瓶刻度线 F.摇匀后发现液面低于刻度线后未做处理
 常温常压下为橙黄色气体,易溶于水,可用于水的净化和纸张、纺织品的漂白。
常温常压下为橙黄色气体,易溶于水,可用于水的净化和纸张、纺织品的漂白。 可在酸性条件下用
可在酸性条件下用 氧化
氧化 (二元弱酸)的反应原理来制备,现实验室用如图所示装置(部分夹持装置和加热装置省略)制取少量
(二元弱酸)的反应原理来制备,现实验室用如图所示装置(部分夹持装置和加热装置省略)制取少量 并探究其某些性质。
并探究其某些性质。
回答下列问题:
(1)简述对发生装置A进行气密性检查的过程:
(2)E装置的作用是
(3)若
 的氧化产物为
的氧化产物为 ,则A中反应里,氧化剂与还原剂的物质的量之比为
,则A中反应里,氧化剂与还原剂的物质的量之比为(4)关闭弹簧夹②,打开弹簧夹①③,反应产生的
 与装置C中物质反应生成了
与装置C中物质反应生成了 、水和某气体,写出该反应的化学方程式:
、水和某气体,写出该反应的化学方程式:(5)NaOH溶液是化学实验室广泛使用的试剂,现有某瓶NaOH溶液的信息说明如下:质量分数为20%、密度为1.20g·cm-3、250mL、请稀释后使用。
①该“NaOH溶液”的物质的量浓度为
②某同学要使用85mL1.5mol/L的NaOH稀溶液来进行某实验,实验员用上述的浓溶液来配制时,选用了规格为100mL的容量瓶,应用量筒量取浓碱液
③配制时,玻璃仪器除了容量瓶、烧杯、量筒外,还需要
④实验配制中的下列情况,会导致所配溶液物质的量浓度偏低的是
A.容量瓶底部有少量蒸馏水未进行处理 B.量取浓溶液时,仰视量筒刻度线
C.稀释、移液后的烧杯及玻璃棒未洗涤 D.移液时有少量洗涤液滴落到瓶外
E.定容时俯视容量瓶刻度线 F.摇匀后发现液面低于刻度线后未做处理
您最近一年使用:0次
名校
解题方法
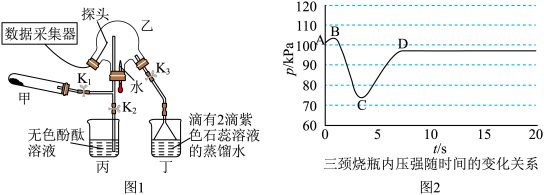
3 . 某化学兴趣小组利用图1装置(加热和夹持装置已省略)制备氨气并进行喷泉实验.
i.氨气的制备:打开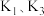 ,关闭
,关闭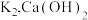 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.
ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备 ,关闭
,关闭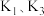 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
请回答下列问题:___________________ ;丁处倒置漏斗的作用是______________ ;氨水中含有的分子有 、
、______________ .
(2)C→D过程中,三颈烧瓶中的现象为_____________ ; 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为_____________ .
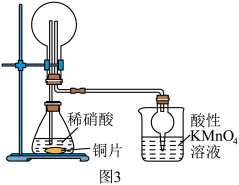
(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.__________________________ .
②烧杯中发生反应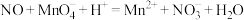 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为__________ (填化学式),氧化产物和还原产物的物质的量之比为__________ (填最简整数比).
i.氨气的制备:打开
 ,关闭
,关闭 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备
 ,关闭
,关闭 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.请回答下列问题:
 、
、(2)C→D过程中,三颈烧瓶中的现象为
 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.
②烧杯中发生反应
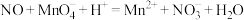 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为
您最近一年使用:0次
2024-06-06更新
|
107次组卷
|
3卷引用:甘肃省白银市2023-2024学年高一下学期期中考试化学试题
名校
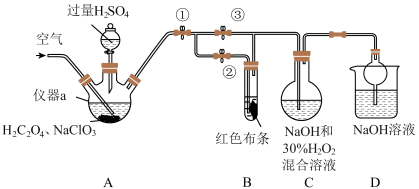
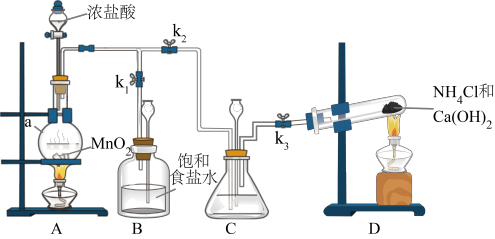
4 . 亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应
(1)仪器a的名称为___________ ,仪器b的作用是___________ 。
(2)装置A中生成NaClO2的离子方程式为___________ 。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(3)B中现象为___________ 。
(4)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,___________ 。

Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应
(1)仪器a的名称为
(2)装置A中生成NaClO2的离子方程式为
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(3)B中现象为
(4)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,
您最近一年使用:0次
解题方法
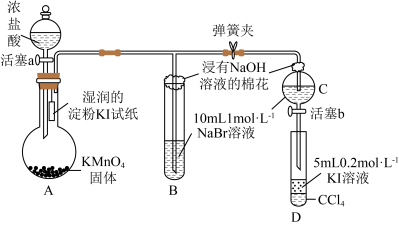
5 . 为证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
已知:①溴水呈黄色,而且颜色随浓度增大而加深。
② 容易从水中转移到
容易从水中转移到 中,导致下层(
中,导致下层( 层)因溶有
层)因溶有 显紫色。
显紫色。
实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液黄色加深时关闭活塞a。
④……
(1)NaOH的电子式为___________ 。
(2)A装置中制备氯气的离子方程式为___________ ,HCl的作用是做___________ 。
(3)B装置中主要反应的化学方程式为___________ 。
(4)为验证溴的氧化性强于碘,过程④的操作和现象分别是___________ 。
(5)过程③的实验目的是___________ 。
(6)结合元素周期表,从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:___________ 。
(7)下列事实能说明元素Y的非金属性比硫元素强的是___________ 。
a.Y单质通入 溶液中,溶液出现淡黄色浑浊
溶液中,溶液出现淡黄色浑浊
b.与 反应时,1mol Y单质得到的电子比1mol S多
反应时,1mol Y单质得到的电子比1mol S多
c.Y和S的简单氢化物受热时,前者的分解温度较高
d.Y元素的氧化物对应水化物的酸性比S强
已知:①溴水呈黄色,而且颜色随浓度增大而加深。
②
 容易从水中转移到
容易从水中转移到 中,导致下层(
中,导致下层( 层)因溶有
层)因溶有 显紫色。
显紫色。实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液黄色加深时关闭活塞a。
④……
(1)NaOH的电子式为
(2)A装置中制备氯气的离子方程式为
(3)B装置中主要反应的化学方程式为
(4)为验证溴的氧化性强于碘,过程④的操作和现象分别是
(5)过程③的实验目的是
(6)结合元素周期表,从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:
(7)下列事实能说明元素Y的非金属性比硫元素强的是
a.Y单质通入
 溶液中,溶液出现淡黄色浑浊
溶液中,溶液出现淡黄色浑浊b.与
 反应时,1mol Y单质得到的电子比1mol S多
反应时,1mol Y单质得到的电子比1mol S多c.Y和S的简单氢化物受热时,前者的分解温度较高
d.Y元素的氧化物对应水化物的酸性比S强
您最近一年使用:0次
名校
解题方法
6 . 铁有两种氯化物,都是重要的化工试剂。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
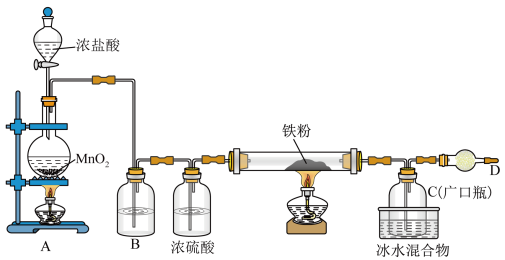
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A中发生反应的化学方程式为___________ 。
(2)过量铁粉与氯气,加热条件下反应的化学方程式为___________ 。
(3)D中装的药品是碱石灰,其作用是___________ 。
(4)将氯化铁制成氢氧化铁胶体,当光束通过 胶体时,可以看见一条光亮的“通路”,叫做
胶体时,可以看见一条光亮的“通路”,叫做___________ 效应。
(5)该小组在实验中发现稀盐酸与 混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想①:是由于 浓度低所致。
浓度低所致。
猜想②:是由于___________ 所致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入 中,然后通入HCl气体加热
中,然后通入HCl气体加热
b.稀盐酸滴入 中,然后加入NaCl固体加热
中,然后加入NaCl固体加热
c.稀盐酸滴入 中,然后加入浓硫酸加热
中,然后加入浓硫酸加热
d. 与NaCl的浓溶液混合加热
与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、 固体共热
固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想___________ 成立。

查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A中发生反应的化学方程式为
(2)过量铁粉与氯气,加热条件下反应的化学方程式为
(3)D中装的药品是碱石灰,其作用是
(4)将氯化铁制成氢氧化铁胶体,当光束通过
 胶体时,可以看见一条光亮的“通路”,叫做
胶体时,可以看见一条光亮的“通路”,叫做(5)该小组在实验中发现稀盐酸与
 混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:猜想①:是由于
 浓度低所致。
浓度低所致。猜想②:是由于
小组设计了以下实验方案进行验证:
a.稀盐酸滴入
 中,然后通入HCl气体加热
中,然后通入HCl气体加热b.稀盐酸滴入
 中,然后加入NaCl固体加热
中,然后加入NaCl固体加热c.稀盐酸滴入
 中,然后加入浓硫酸加热
中,然后加入浓硫酸加热d.
 与NaCl的浓溶液混合加热
与NaCl的浓溶液混合加热e.浓硫酸与NaCl固体、
 固体共热
固体共热实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想
您最近一年使用:0次
7 . 氯及其化合物在工农业生产和日常生活中用途十分广泛。实验室制备氯气和漂白剂(有效成分为NaClO)的装置如图1所示。
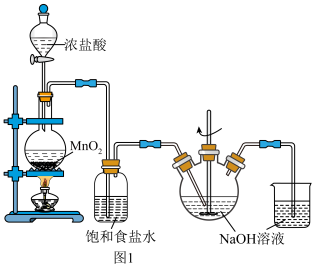
(1)在圆底烧瓶里加入MnO2,通过_______ (填写仪器名称)再加入适量的浓盐酸后加热,发生反应的化学方程式为_______ 。
(2)烧杯中NaOH溶液的作用是_______ 。
(3)设计实验探究反应条件对制备Cl2的影响:
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,反应的方程式为_______ 。
②为探究Ⅲ中无明显现象的原因,又设计了实验Ⅳ,如图2所示:
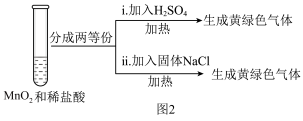
将实验Ⅲ、Ⅳ作对比,得出的结论是_______ 。
(4)实验中发现三颈烧瓶中生成物各物质的量和溶液的温度随时间的变化如图3所示。t1分钟后发生的主要反应的化学方程式为_______ 。

(5)NaClO是一种强氧化剂,有很强的杀菌、漂白作用,还可以用来氧化去除水体中的污染物。
①用NaClO处理废水中水合肼(N2H4•H2O),使其转化成无毒的氮气。写出反应的化学方程式:_______ 。
②NaClO处理高氯(含高浓度Cl-)废水中的有机物时,ClO-将有机物氧化为无毒物质。实验发现,当废水是“酸性”时,NaClO处理高氯废水时,有机物氧化率较低,其原因是_______ 。

(1)在圆底烧瓶里加入MnO2,通过
(2)烧杯中NaOH溶液的作用是
(3)设计实验探究反应条件对制备Cl2的影响:
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol•L-1的浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol•L-1的稀盐酸混合物 | 无明显现象 |
②为探究Ⅲ中无明显现象的原因,又设计了实验Ⅳ,如图2所示:

将实验Ⅲ、Ⅳ作对比,得出的结论是
(4)实验中发现三颈烧瓶中生成物各物质的量和溶液的温度随时间的变化如图3所示。t1分钟后发生的主要反应的化学方程式为

(5)NaClO是一种强氧化剂,有很强的杀菌、漂白作用,还可以用来氧化去除水体中的污染物。
①用NaClO处理废水中水合肼(N2H4•H2O),使其转化成无毒的氮气。写出反应的化学方程式:
②NaClO处理高氯(含高浓度Cl-)废水中的有机物时,ClO-将有机物氧化为无毒物质。实验发现,当废水是“酸性”时,NaClO处理高氯废水时,有机物氧化率较低,其原因是
您最近一年使用:0次
名校
8 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
I.制备N2H4
(1)装置C中盛放的试剂是___________ ,其作用是___________ 。(用离子方程式表示)
(2)装置D发生的反应的方程式为___________ 。
(3)制备N2H4的离子方程式为___________ 。
II.探究N2H4的还原性与碱性。将制得的肼分离提纯后,进行如图实验。
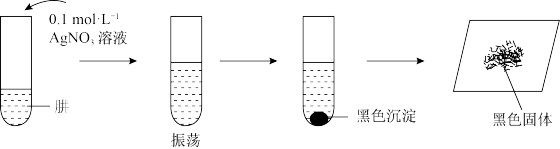
【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如表方案,进行实验。
(4)请完成表中的空白部分
(5)实验表明,黑色固体主要成分是Ag,还有少量氧化银。请解释原因:___________ 。
I.制备N2H4

(1)装置C中盛放的试剂是
(2)装置D发生的反应的方程式为
(3)制备N2H4的离子方程式为
II.探究N2H4的还原性与碱性。将制得的肼分离提纯后,进行如图实验。

【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如表方案,进行实验。
(4)请完成表中的空白部分
| 操作 | 现象 | 实验结论 |
| i. 取少量黑色固体于试管中,加入适量 | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii. 取少量黑色固体于试管中加入足量稀硝酸,振荡。 | 黑色固体是Ag和Ag2O |
您最近一年使用:0次
9 . 二氯化二硫 常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。
常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。 沸点为
沸点为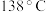 ,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成
,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成 。实验室用S和
。实验室用S和 制备
制备 的装置如图(部分夹持装置已略去)。
的装置如图(部分夹持装置已略去)。
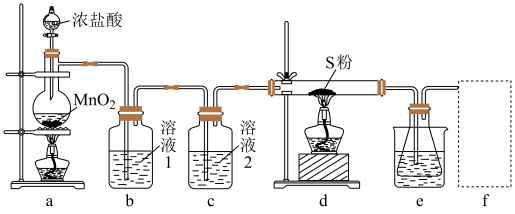
回答下列问题:
(1)装置b用于吸收 ,则溶液1为
,则溶液1为_______ ;溶液2的作用为_______ 。
(2)实验开始时,先点燃a处酒精灯,圆底烧瓶中发生反应的化学方程式为_______ ,当_______ (描述现象)时,点燃d处酒精灯。
(3)e中大烧杯装有冰水,作用是_______ ;f可以选用_______ (填标号)装置。
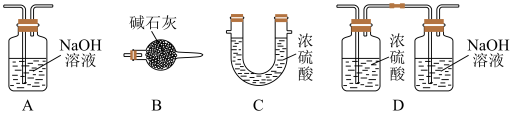
(4) (
( 中S为
中S为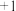 价)遇水会生成
价)遇水会生成 、一种强酸和一种淡黄色固体单质,该反应的化学方程式为
、一种强酸和一种淡黄色固体单质,该反应的化学方程式为_______ ,反应中每转移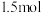 电子,生成的
电子,生成的 在标准状况下的体积为
在标准状况下的体积为_______ 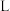 。
。
 常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。
常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。 沸点为
沸点为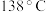 ,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成
,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成 。实验室用S和
。实验室用S和 制备
制备 的装置如图(部分夹持装置已略去)。
的装置如图(部分夹持装置已略去)。
回答下列问题:
(1)装置b用于吸收
 ,则溶液1为
,则溶液1为(2)实验开始时,先点燃a处酒精灯,圆底烧瓶中发生反应的化学方程式为
(3)e中大烧杯装有冰水,作用是

(4)
 (
( 中S为
中S为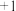 价)遇水会生成
价)遇水会生成 、一种强酸和一种淡黄色固体单质,该反应的化学方程式为
、一种强酸和一种淡黄色固体单质,该反应的化学方程式为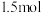 电子,生成的
电子,生成的 在标准状况下的体积为
在标准状况下的体积为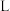 。
。
您最近一年使用:0次
2024-03-01更新
|
150次组卷
|
2卷引用:内蒙古自治区2023-2024学年高一上学期期末教学质量检测化学试题
名校
10 . 某研究小组利用如图所示装置制备氯气,并进行Cl2、Br2、I2性质的探究。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)
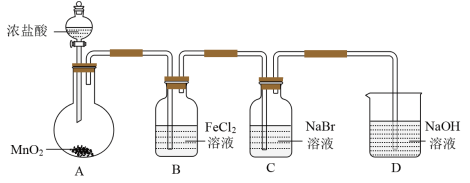
(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为_______ 。
(2)B中发生反应的离子方程式为_______ 。
(3)D中发生反应的化学方程式为_______ 。
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:______
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
【分析与解释】
(5)实验1中a试管中反应的离子方程式是_______ 。
(6)通过实验1可以得出的结论是_______ 。
(7)①甲同学认为:实验2观察到_______ 现象,得出氧化性Br2>I2;
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
补做实验3的目的是_______ 。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)

(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为
(2)B中发生反应的离子方程式为
(3)D中发生反应的化学方程式为
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
| 实验1 | 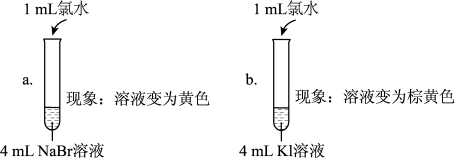 |
| 实验2 | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(5)实验1中a试管中反应的离子方程式是
(6)通过实验1可以得出的结论是
(7)①甲同学认为:实验2观察到
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
| 实验3 | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
您最近一年使用:0次



