1 . 二氯化二硫 常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。
常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。 沸点为
沸点为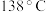 ,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成
,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成 。实验室用S和
。实验室用S和 制备
制备 的装置如图(部分夹持装置已略去)。
的装置如图(部分夹持装置已略去)。
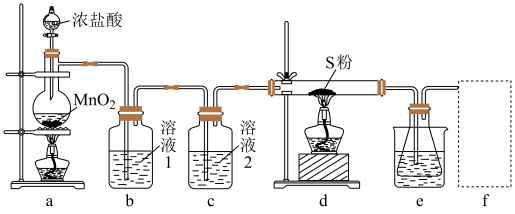
回答下列问题:
(1)装置b用于吸收 ,则溶液1为
,则溶液1为_______ ;溶液2的作用为_______ 。
(2)实验开始时,先点燃a处酒精灯,圆底烧瓶中发生反应的化学方程式为_______ ,当_______ (描述现象)时,点燃d处酒精灯。
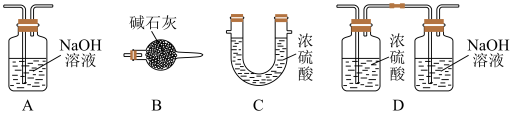
(3)e中大烧杯装有冰水,作用是_______ ;f可以选用_______ (填标号)装置。
(4) (
( 中S为
中S为 价)遇水会生成
价)遇水会生成 、一种强酸和一种淡黄色固体单质,该反应的化学方程式为
、一种强酸和一种淡黄色固体单质,该反应的化学方程式为_______ ,反应中每转移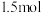 电子,生成的
电子,生成的 在标准状况下的体积为
在标准状况下的体积为_______  。
。
 常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。
常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。 沸点为
沸点为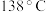 ,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成
,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成 。实验室用S和
。实验室用S和 制备
制备 的装置如图(部分夹持装置已略去)。
的装置如图(部分夹持装置已略去)。
回答下列问题:
(1)装置b用于吸收
 ,则溶液1为
,则溶液1为(2)实验开始时,先点燃a处酒精灯,圆底烧瓶中发生反应的化学方程式为
(3)e中大烧杯装有冰水,作用是

(4)
 (
( 中S为
中S为 价)遇水会生成
价)遇水会生成 、一种强酸和一种淡黄色固体单质,该反应的化学方程式为
、一种强酸和一种淡黄色固体单质,该反应的化学方程式为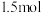 电子,生成的
电子,生成的 在标准状况下的体积为
在标准状况下的体积为 。
。
您最近一年使用:0次
2024-03-01更新
|
150次组卷
|
2卷引用:内蒙古自治区2023-2024学年高一上学期期末教学质量检测化学试题
名校
解题方法
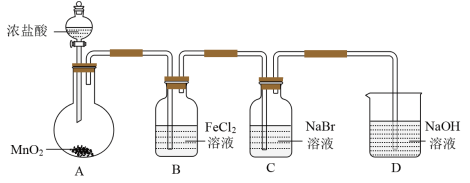
2 . 某学习小组的同学用MnO2和浓盐酸反应来制备纯净的氯气并验证其有无漂白性,设计装置如图:

(1)A装置中反应的化学方程式:____________________________ ;D装置中现象:___________________ ;该套装置存在的缺陷:_________________________________ 。
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是_______________________ (用离子方程式表示)。
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了_______________ 。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为__________________ 。
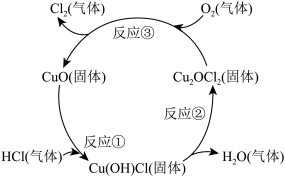
(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是___________ ,CuO的作用是_____________ ,写出总反应的化学方程式,并用单线桥法标出该反应的电子转移情况______________________________ 。

(1)A装置中反应的化学方程式:
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是

您最近一年使用:0次
2022-12-14更新
|
396次组卷
|
3卷引用:上海市松江二中2021-2022学年高一上学期期末考试化学试题
名校
3 . 某研究小组利用如图所示装置制备氯气,并进行Cl2、Br2、I2性质的探究。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)
(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为_______ 。
(2)B中发生反应的离子方程式为_______ 。
(3)D中发生反应的化学方程式为_______ 。
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:______
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
【分析与解释】
(5)实验1中a试管中反应的离子方程式是_______ 。
(6)通过实验1可以得出的结论是_______ 。
(7)①甲同学认为:实验2观察到_______ 现象,得出氧化性Br2>I2;
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
补做实验3的目的是_______ 。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)

(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为
(2)B中发生反应的离子方程式为
(3)D中发生反应的化学方程式为
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
| 实验1 | 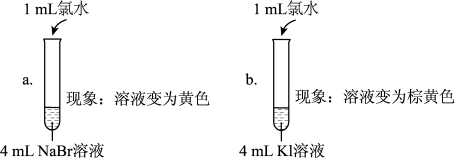 |
| 实验2 | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(5)实验1中a试管中反应的离子方程式是
(6)通过实验1可以得出的结论是
(7)①甲同学认为:实验2观察到
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
| 实验3 | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
您最近一年使用:0次
名校
4 . 二氧化氯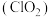 是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下
是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下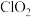 是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备
是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备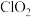 ,其工序包括制备氯酸钠,盐酸合成和
,其工序包括制备氯酸钠,盐酸合成和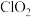 制取,主要工艺流程如图所示。
制取,主要工艺流程如图所示。
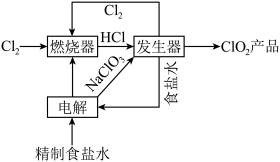
回答下列问题:
(1)工艺流程图涉及到的物质化学式或物质名称,其中能导电的是___________ ,属于电解质的是___________ 。
(2)实验室模拟“燃烧器”中发生的反应,观察到的现象有___________ 。
(3)“发生器”中发生反应的离子方程式为___________ ,若整个过程制得 ,则理论上分别向装置中补充
,则理论上分别向装置中补充___________ (填质量和物质名称)恢复至起始状态。
(4)粗盐中常常含有泥沙、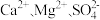 等杂质,粗盐提纯的步骤中加入稍过量的
等杂质,粗盐提纯的步骤中加入稍过量的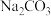 的目的是
的目的是___________ ,经一系列操作可得制食盐水,电解精制食盐水制得 同时还会获取轻质燃料氢气,则离子方程式为
同时还会获取轻质燃料氢气,则离子方程式为___________ 。
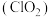 是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下
是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下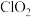 是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备
是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备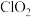 ,其工序包括制备氯酸钠,盐酸合成和
,其工序包括制备氯酸钠,盐酸合成和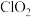 制取,主要工艺流程如图所示。
制取,主要工艺流程如图所示。
回答下列问题:
(1)工艺流程图涉及到的物质化学式或物质名称,其中能导电的是
(2)实验室模拟“燃烧器”中发生的反应,观察到的现象有
(3)“发生器”中发生反应的离子方程式为
 ,则理论上分别向装置中补充
,则理论上分别向装置中补充(4)粗盐中常常含有泥沙、
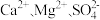 等杂质,粗盐提纯的步骤中加入稍过量的
等杂质,粗盐提纯的步骤中加入稍过量的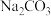 的目的是
的目的是 同时还会获取轻质燃料氢气,则离子方程式为
同时还会获取轻质燃料氢气,则离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 化学在日常防疫中发挥了重要作用,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液;②H2O2 (在水溶液中可部分电离);③ClO2;④O3;⑤碘酒;⑥75%酒精;⑦过氧乙酸(CH3COOOH);⑧高铁酸钠(Na2FeO4)。回答下列问题:
(1)上述杀菌消毒剂属于非电解质的是___________ (填序号)。
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。某游泳场馆由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。当有0.1 mol O2生成时,反应中转移电子数目为___________ 。
(3)亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。
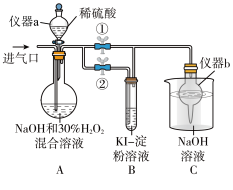
I.制备亚氯酸钠。操作步骤:
①关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
②装置A中生成 NaClO2的化学方程式为___________ 。
③若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有:___________ 、___________ 、过滤、洗涤、干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
①开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因___________ 。
②B中现象为___________ 。产生该现象的离子方程式为___________ 。
(1)上述杀菌消毒剂属于非电解质的是
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。某游泳场馆由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。当有0.1 mol O2生成时,反应中转移电子数目为
(3)亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

I.制备亚氯酸钠。操作步骤:
①关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
②装置A中生成 NaClO2的化学方程式为
③若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有:
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
①开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因
②B中现象为
您最近一年使用:0次
名校
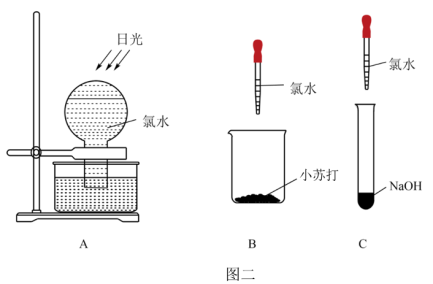
6 . 某化学兴趣小组为了探究 的相关性质,设计了如图一的一系列实验。
的相关性质,设计了如图一的一系列实验。

查阅资料:① 与
与 不反应;
不反应;
②氯元素形成物质的二维价类图如下所示:
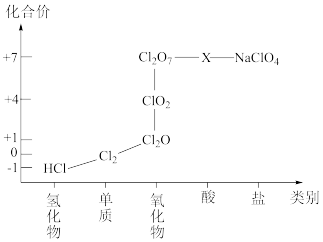
(1)根据二维图中信息,写出氯的最高价含氧酸的化学式_______ 。
(2)将 通入水中,其离子方程式为
通入水中,其离子方程式为_______ 。
(3)实验室可用该反应 制备
制备 ,该反应中盐酸体现
,该反应中盐酸体现_______ (填字母),其中氧化剂与还原剂的微粒个数之比为_______ 。
A.酸性 B.氧化性 C.还原性 D.挥发性
(4)图一中,通入_______ 后,从集气瓶A、B的现象可得出的结论是_______ 。
(5)图二中三组实验,不会产生气体的是_______ ﹔请用一个离子方程式表示图二B装置中发生的反应_______ 。
 的相关性质,设计了如图一的一系列实验。
的相关性质,设计了如图一的一系列实验。
查阅资料:①
 与
与 不反应;
不反应;②氯元素形成物质的二维价类图如下所示:

(1)根据二维图中信息,写出氯的最高价含氧酸的化学式
(2)将
 通入水中,其离子方程式为
通入水中,其离子方程式为(3)实验室可用该反应
 制备
制备 ,该反应中盐酸体现
,该反应中盐酸体现A.酸性 B.氧化性 C.还原性 D.挥发性
(4)图一中,通入
(5)图二中三组实验,不会产生气体的是

您最近一年使用:0次
2022-11-13更新
|
247次组卷
|
2卷引用:重庆市第八中学校2022-2023学年高一上学期期中考试(半期考试)化学试题
名校
7 . I.某化学兴趣小组用如图装置制备 并探究其性质。
并探究其性质。
i. 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii. 有较强的还原性
有较强的还原性
(1)装置A中a的作用是_____________________________ ;
(2)上述装置中存在一处缺陷,会干扰 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是_________________ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式_________________________ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因____________________________ 、 。
。
②某同学对褪色原因提出假设:
假设1: 被
被 氧化为更高价态;
氧化为更高价态;
假设2: 被
被 氧化为更高价态。
氧化为更高价态。
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入____________________________ ,若出现____________________________ 现象,则说明假设2成立。
II.有两组化学兴趣小组同学对、 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:
(5)甲组同学探究溶液 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为______________________________ 。 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验: 与
与 反应的离子方程式为
反应的离子方程式为______________________________ 。
为了探究白色沉淀产生的原因,同学们查阅资料得知:
i. 是难溶于水的白色固体;
是难溶于水的白色固体;
ii. 的化学性质与
的化学性质与 相似;
相似;
iii.
填写实验方案:
②步骤2的空格中填写的数据为___________________ 。
③ 与
与 反应的离子方程式为
反应的离子方程式为____________________________________ 。
 并探究其性质。
并探究其性质。
i.
 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii.
 有较强的还原性
有较强的还原性(1)装置A中a的作用是
(2)上述装置中存在一处缺陷,会干扰
 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因
 。
。②某同学对褪色原因提出假设:
假设1:
 被
被 氧化为更高价态;
氧化为更高价态;假设2:
 被
被 氧化为更高价态。
氧化为更高价态。为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入
II.有两组化学兴趣小组同学对、
 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:(5)甲组同学探究溶液
 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为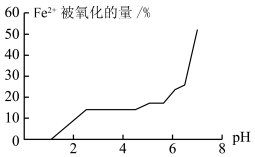
 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验:
 与
与 反应的离子方程式为
反应的离子方程式为为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.
 是难溶于水的白色固体;
是难溶于水的白色固体;ii.
 的化学性质与
的化学性质与 相似;
相似;iii.

填写实验方案:
实验方案 | 实验现象 |
步骤1:取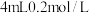 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴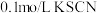 溶液 溶液 | 无明显现象 |
步骤2:取 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴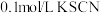 溶液 溶液 | 产生白色沉淀 |
③
 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
2024-01-13更新
|
165次组卷
|
4卷引用:福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题
名校
8 . 为了防控疫情,学校要定时进行消毒。
Ⅰ、工业上使用氯气与氢氧化钠反应制取“84消毒液”
(1)其有效成分是___________ (填化学式)。
(2)“84消毒液”使用时应按比例稀释,放置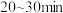 ,放置过程中生成碳酸氢钠,该反应的离子方程式为:
,放置过程中生成碳酸氢钠,该反应的离子方程式为:___________ 。
Ⅱ、“消毒液”中氯元素的存在形态与溶液的关系如表:
(3)请你写出 降低时产生氯气的离子方程式:
降低时产生氯气的离子方程式:___________ 。
Ⅲ、同学猜测“84消毒液”(以下简称“84”)可漂白米醋,进行了如下实验:
(4)实验二的目的是:①___________ ;②___________ 。
(5)结合反应的方程式,解释实验一立即褪色的原因:___________ 。
Ⅳ、 一种常用的自来水消毒剂,某研究小组用如图装置制备少量
一种常用的自来水消毒剂,某研究小组用如图装置制备少量 (夹持装置已略去)。
(夹持装置已略去)。
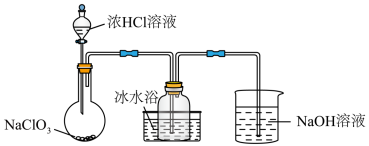
资料: 常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,
常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色, 时液化成红棕色液体。制备
时液化成红棕色液体。制备 的化学反应方程式为
的化学反应方程式为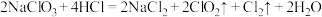
(6)装置中,冰水浴的作用是___________ 。
(7) 中
中 的化合价是
的化合价是___________ 。现有含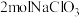 的溶液与足量浓
的溶液与足量浓 反应,可获得
反应,可获得 的质量为
的质量为___________ g。
Ⅰ、工业上使用氯气与氢氧化钠反应制取“84消毒液”
(1)其有效成分是
(2)“84消毒液”使用时应按比例稀释,放置
 ,放置过程中生成碳酸氢钠,该反应的离子方程式为:
,放置过程中生成碳酸氢钠,该反应的离子方程式为:Ⅱ、“消毒液”中氯元素的存在形态与溶液的关系如表:
溶液 | >9 | 5~6 | 4~5 | 2~3 | <2 |
| 主要成分 |  |  与 与 (少量) (少量) |  与 与 (少量) (少量) |  与 与 |  |
 降低时产生氯气的离子方程式:
降低时产生氯气的离子方程式:Ⅲ、同学猜测“84消毒液”(以下简称“84”)可漂白米醋,进行了如下实验:
| 编号 | 实验操作 | 实验现象 |
| 实验一 | 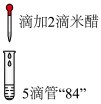 | 滴入米醋后立即褪色,闻到刺激性气味 |
| 实验二 | 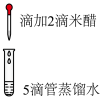 | 溶液为浅棕色,无刺激性气味 |
(5)结合反应的方程式,解释实验一立即褪色的原因:
Ⅳ、
 一种常用的自来水消毒剂,某研究小组用如图装置制备少量
一种常用的自来水消毒剂,某研究小组用如图装置制备少量 (夹持装置已略去)。
(夹持装置已略去)。
资料:
 常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,
常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色, 时液化成红棕色液体。制备
时液化成红棕色液体。制备 的化学反应方程式为
的化学反应方程式为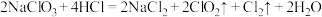
(6)装置中,冰水浴的作用是
(7)
 中
中 的化合价是
的化合价是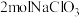 的溶液与足量浓
的溶液与足量浓 反应,可获得
反应,可获得 的质量为
的质量为
您最近一年使用:0次
解题方法
9 . 二氧化氯 具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为
具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为 。某实验小组利用如下装置制备、收集
。某实验小组利用如下装置制备、收集 并验证其化学性质,化学方程式为
并验证其化学性质,化学方程式为 。请回答下列问题:
。请回答下列问题:
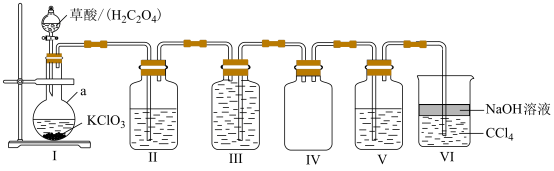
(1)装置I中仪器a的名称为___________ 。
(2)同学们查找数据发现:
① 在
在 溶液中的溶解度较小;
溶液中的溶解度较小;
② 与
与 溶液发生反应:____
溶液发生反应:____ ____
____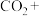 ____
____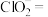 ____
____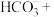 ____
____ ____
____ 。
。
请配平该离子方程式___________ 。
(3)装置II和III中均盛有饱和 溶液,请指出它们的作用。
溶液,请指出它们的作用。
装置II:___________ ,装置III:___________ 。
(4)装置V中盛有淀粉碘化钾溶液,实验时观察到的现象为___________ ;装置VI中 的作用是
的作用是___________ 。
(5)消毒效率一般以单位质量氧化剂所得的电子数表示,则 和
和 消毒效率更高的是
消毒效率更高的是___________ 。
 具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为
具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为 。某实验小组利用如下装置制备、收集
。某实验小组利用如下装置制备、收集 并验证其化学性质,化学方程式为
并验证其化学性质,化学方程式为 。请回答下列问题:
。请回答下列问题:
(1)装置I中仪器a的名称为
(2)同学们查找数据发现:
①
 在
在 溶液中的溶解度较小;
溶液中的溶解度较小;②
 与
与 溶液发生反应:____
溶液发生反应:____ ____
____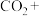 ____
____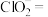 ____
____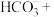 ____
____ ____
____ 。
。请配平该离子方程式
(3)装置II和III中均盛有饱和
 溶液,请指出它们的作用。
溶液,请指出它们的作用。装置II:
(4)装置V中盛有淀粉碘化钾溶液,实验时观察到的现象为
 的作用是
的作用是(5)消毒效率一般以单位质量氧化剂所得的电子数表示,则
 和
和 消毒效率更高的是
消毒效率更高的是
您最近一年使用:0次
名校
10 . 实验小组利用如下图所示的装置制备氯气及探究氯气的性质。
资料:单质碘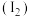 遇淀粉溶液变蓝,利用此现象可检验溶液中的
遇淀粉溶液变蓝,利用此现象可检验溶液中的 。
。
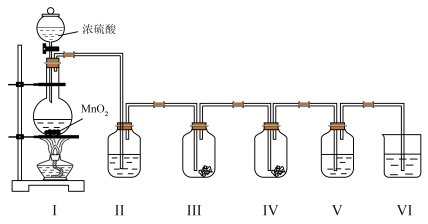
(1)Ⅰ中制备氯气时,发生反应的化学方程式是_______
(2)Ⅱ的目的是除去氯气中的水蒸气,则瓶中盛放的试剂是_______ 。
(3)利用Ⅲ、Ⅳ装置探究氯气与水反应的产物。
①实验前,向Ⅲ、Ⅳ中均放入干燥蓝色石蕊纸花,并向_______ 中滴少量水将纸花润湿。
②实验时,根据Ⅲ中的纸花不变色及_______ 现象,甲同学得出初步结论:氯气与水反应生成具有酸性及漂白性的物质。
③同学们分析后,认为用该实验装置不能得出“氯气与水反应有酸性物质生成”的结论,理由是_______ 。
(4)Ⅴ中盛有 淀粉溶液,随
淀粉溶液,随 通入,可获得
通入,可获得 具有氧化性的实验证据是
具有氧化性的实验证据是_______ 。
(5)Ⅵ中盛放的试剂是 溶液,其作用是
溶液,其作用是_______ ,发生反应的离子方程式是_______ 。
(6)利用如下装置也可以制取氯气,并利用氯气的氧化性制取 。
。
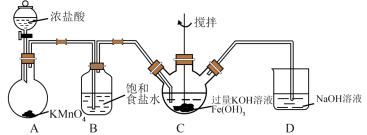
①装置A中, 被还原为
被还原为 ,写出反应的离子方程式:
,写出反应的离子方程式:_______ 。
②装置C中发生如下反应,将方程式配平:_______ 。
资料:单质碘
 遇淀粉溶液变蓝,利用此现象可检验溶液中的
遇淀粉溶液变蓝,利用此现象可检验溶液中的 。
。
(1)Ⅰ中制备氯气时,发生反应的化学方程式是
(2)Ⅱ的目的是除去氯气中的水蒸气,则瓶中盛放的试剂是
(3)利用Ⅲ、Ⅳ装置探究氯气与水反应的产物。
①实验前,向Ⅲ、Ⅳ中均放入干燥蓝色石蕊纸花,并向
②实验时,根据Ⅲ中的纸花不变色及
③同学们分析后,认为用该实验装置不能得出“氯气与水反应有酸性物质生成”的结论,理由是
(4)Ⅴ中盛有
 淀粉溶液,随
淀粉溶液,随 通入,可获得
通入,可获得 具有氧化性的实验证据是
具有氧化性的实验证据是(5)Ⅵ中盛放的试剂是
 溶液,其作用是
溶液,其作用是(6)利用如下装置也可以制取氯气,并利用氯气的氧化性制取
 。
。
①装置A中,
 被还原为
被还原为 ,写出反应的离子方程式:
,写出反应的离子方程式:②装置C中发生如下反应,将方程式配平:
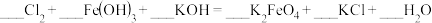
您最近一年使用:0次



