名校
1 . 某研究小组利用如图所示装置制备氯气,并进行Cl2、Br2、I2性质的探究。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)
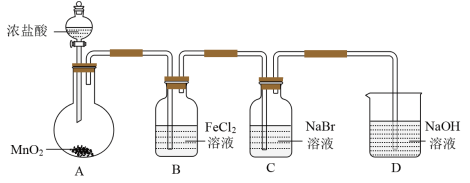
(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为_______ 。
(2)B中发生反应的离子方程式为_______ 。
(3)D中发生反应的化学方程式为_______ 。
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:______
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
【分析与解释】
(5)实验1中a试管中反应的离子方程式是_______ 。
(6)通过实验1可以得出的结论是_______ 。
(7)①甲同学认为:实验2观察到_______ 现象,得出氧化性Br2>I2;
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
补做实验3的目的是_______ 。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)

(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为
(2)B中发生反应的离子方程式为
(3)D中发生反应的化学方程式为
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
| 实验1 | 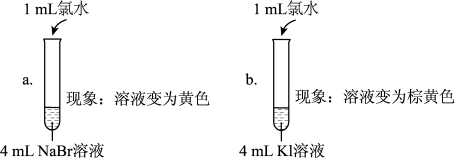 |
| 实验2 | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(5)实验1中a试管中反应的离子方程式是
(6)通过实验1可以得出的结论是
(7)①甲同学认为:实验2观察到
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
| 实验3 | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
您最近一年使用:0次
名校
2 . 二氧化氯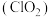 是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下
是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下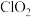 是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备
是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备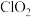 ,其工序包括制备氯酸钠,盐酸合成和
,其工序包括制备氯酸钠,盐酸合成和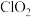 制取,主要工艺流程如图所示。
制取,主要工艺流程如图所示。
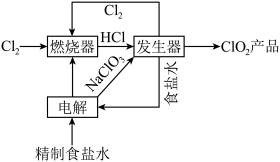
回答下列问题:
(1)工艺流程图涉及到的物质化学式或物质名称,其中能导电的是___________ ,属于电解质的是___________ 。
(2)实验室模拟“燃烧器”中发生的反应,观察到的现象有___________ 。
(3)“发生器”中发生反应的离子方程式为___________ ,若整个过程制得 ,则理论上分别向装置中补充
,则理论上分别向装置中补充___________ (填质量和物质名称)恢复至起始状态。
(4)粗盐中常常含有泥沙、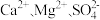 等杂质,粗盐提纯的步骤中加入稍过量的
等杂质,粗盐提纯的步骤中加入稍过量的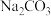 的目的是
的目的是___________ ,经一系列操作可得制食盐水,电解精制食盐水制得 同时还会获取轻质燃料氢气,则离子方程式为
同时还会获取轻质燃料氢气,则离子方程式为___________ 。
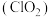 是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下
是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下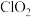 是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备
是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备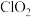 ,其工序包括制备氯酸钠,盐酸合成和
,其工序包括制备氯酸钠,盐酸合成和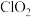 制取,主要工艺流程如图所示。
制取,主要工艺流程如图所示。
回答下列问题:
(1)工艺流程图涉及到的物质化学式或物质名称,其中能导电的是
(2)实验室模拟“燃烧器”中发生的反应,观察到的现象有
(3)“发生器”中发生反应的离子方程式为
 ,则理论上分别向装置中补充
,则理论上分别向装置中补充(4)粗盐中常常含有泥沙、
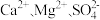 等杂质,粗盐提纯的步骤中加入稍过量的
等杂质,粗盐提纯的步骤中加入稍过量的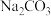 的目的是
的目的是 同时还会获取轻质燃料氢气,则离子方程式为
同时还会获取轻质燃料氢气,则离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 化学在日常防疫中发挥了重要作用,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液;②H2O2 (在水溶液中可部分电离);③ClO2;④O3;⑤碘酒;⑥75%酒精;⑦过氧乙酸(CH3COOOH);⑧高铁酸钠(Na2FeO4)。回答下列问题:
(1)上述杀菌消毒剂属于非电解质的是___________ (填序号)。
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。某游泳场馆由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。当有0.1 mol O2生成时,反应中转移电子数目为___________ 。
(3)亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。
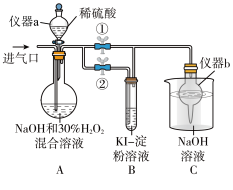
I.制备亚氯酸钠。操作步骤:
①关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
②装置A中生成 NaClO2的化学方程式为___________ 。
③若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有:___________ 、___________ 、过滤、洗涤、干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
①开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因___________ 。
②B中现象为___________ 。产生该现象的离子方程式为___________ 。
(1)上述杀菌消毒剂属于非电解质的是
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。某游泳场馆由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。当有0.1 mol O2生成时,反应中转移电子数目为
(3)亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

I.制备亚氯酸钠。操作步骤:
①关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
②装置A中生成 NaClO2的化学方程式为
③若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有:
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
①开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因
②B中现象为
您最近一年使用:0次
名校
4 . I.某化学兴趣小组用如图装置制备 并探究其性质。
并探究其性质。
i. 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii. 有较强的还原性
有较强的还原性
(1)装置A中a的作用是_____________________________ ;
(2)上述装置中存在一处缺陷,会干扰 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是_________________ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式_________________________ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因____________________________ 、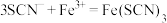 。
。
②某同学对褪色原因提出假设:
假设1: 被
被 氧化为更高价态;
氧化为更高价态;
假设2: 被
被 氧化为更高价态。
氧化为更高价态。
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入____________________________ ,若出现____________________________ 现象,则说明假设2成立。
II.有两组化学兴趣小组同学对、 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:
(5)甲组同学探究溶液 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为______________________________ 。 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验: 与
与 反应的离子方程式为
反应的离子方程式为______________________________ 。
为了探究白色沉淀产生的原因,同学们查阅资料得知:
i. 是难溶于水的白色固体;
是难溶于水的白色固体;
ii. 的化学性质与
的化学性质与 相似;
相似;
iii.
填写实验方案:
②步骤2的空格中填写的数据为___________________ 。
③ 与
与 反应的离子方程式为
反应的离子方程式为____________________________________ 。
 并探究其性质。
并探究其性质。
i.
 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii.
 有较强的还原性
有较强的还原性(1)装置A中a的作用是
(2)上述装置中存在一处缺陷,会干扰
 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因
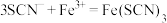 。
。②某同学对褪色原因提出假设:
假设1:
 被
被 氧化为更高价态;
氧化为更高价态;假设2:
 被
被 氧化为更高价态。
氧化为更高价态。为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入
II.有两组化学兴趣小组同学对、
 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:(5)甲组同学探究溶液
 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为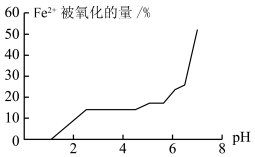
 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验:
 与
与 反应的离子方程式为
反应的离子方程式为为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.
 是难溶于水的白色固体;
是难溶于水的白色固体;ii.
 的化学性质与
的化学性质与 相似;
相似;iii.

填写实验方案:
实验方案 | 实验现象 |
步骤1:取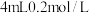 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴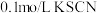 溶液 溶液 | 无明显现象 |
步骤2:取 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴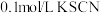 溶液 溶液 | 产生白色沉淀 |
③
 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
2024-01-13更新
|
165次组卷
|
4卷引用:福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题
解题方法
5 . 二氧化氯 具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为
具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为 。某实验小组利用如下装置制备、收集
。某实验小组利用如下装置制备、收集 并验证其化学性质,化学方程式为
并验证其化学性质,化学方程式为 。请回答下列问题:
。请回答下列问题:
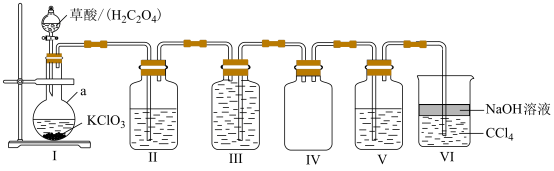
(1)装置I中仪器a的名称为___________ 。
(2)同学们查找数据发现:
① 在
在 溶液中的溶解度较小;
溶液中的溶解度较小;
② 与
与 溶液发生反应:____
溶液发生反应:____ ____
____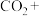 ____
____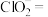 ____
____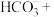 ____
____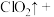 ____
____ 。
。
请配平该离子方程式___________ 。
(3)装置II和III中均盛有饱和 溶液,请指出它们的作用。
溶液,请指出它们的作用。
装置II:___________ ,装置III:___________ 。
(4)装置V中盛有淀粉碘化钾溶液,实验时观察到的现象为___________ ;装置VI中 的作用是
的作用是___________ 。
(5)消毒效率一般以单位质量氧化剂所得的电子数表示,则 和
和 消毒效率更高的是
消毒效率更高的是___________ 。
 具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为
具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为 。某实验小组利用如下装置制备、收集
。某实验小组利用如下装置制备、收集 并验证其化学性质,化学方程式为
并验证其化学性质,化学方程式为 。请回答下列问题:
。请回答下列问题:
(1)装置I中仪器a的名称为
(2)同学们查找数据发现:
①
 在
在 溶液中的溶解度较小;
溶液中的溶解度较小;②
 与
与 溶液发生反应:____
溶液发生反应:____ ____
____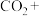 ____
____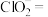 ____
____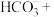 ____
____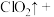 ____
____ 。
。请配平该离子方程式
(3)装置II和III中均盛有饱和
 溶液,请指出它们的作用。
溶液,请指出它们的作用。装置II:
(4)装置V中盛有淀粉碘化钾溶液,实验时观察到的现象为
 的作用是
的作用是(5)消毒效率一般以单位质量氧化剂所得的电子数表示,则
 和
和 消毒效率更高的是
消毒效率更高的是
您最近一年使用:0次
名校
6 . 实验小组利用如下图所示的装置制备氯气及探究氯气的性质。
资料:单质碘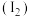 遇淀粉溶液变蓝,利用此现象可检验溶液中的
遇淀粉溶液变蓝,利用此现象可检验溶液中的 。
。
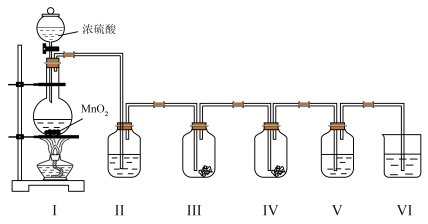
(1)Ⅰ中制备氯气时,发生反应的化学方程式是_______
(2)Ⅱ的目的是除去氯气中的水蒸气,则瓶中盛放的试剂是_______ 。
(3)利用Ⅲ、Ⅳ装置探究氯气与水反应的产物。
①实验前,向Ⅲ、Ⅳ中均放入干燥蓝色石蕊纸花,并向_______ 中滴少量水将纸花润湿。
②实验时,根据Ⅲ中的纸花不变色及_______ 现象,甲同学得出初步结论:氯气与水反应生成具有酸性及漂白性的物质。
③同学们分析后,认为用该实验装置不能得出“氯气与水反应有酸性物质生成”的结论,理由是_______ 。
(4)Ⅴ中盛有 淀粉溶液,随
淀粉溶液,随 通入,可获得
通入,可获得 具有氧化性的实验证据是
具有氧化性的实验证据是_______ 。
(5)Ⅵ中盛放的试剂是 溶液,其作用是
溶液,其作用是_______ ,发生反应的离子方程式是_______ 。
(6)利用如下装置也可以制取氯气,并利用氯气的氧化性制取 。
。
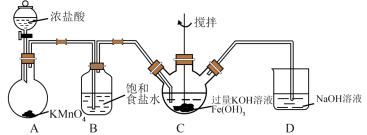
①装置A中, 被还原为
被还原为 ,写出反应的离子方程式:
,写出反应的离子方程式:_______ 。
②装置C中发生如下反应,将方程式配平:_______ 。
资料:单质碘
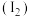 遇淀粉溶液变蓝,利用此现象可检验溶液中的
遇淀粉溶液变蓝,利用此现象可检验溶液中的 。
。
(1)Ⅰ中制备氯气时,发生反应的化学方程式是
(2)Ⅱ的目的是除去氯气中的水蒸气,则瓶中盛放的试剂是
(3)利用Ⅲ、Ⅳ装置探究氯气与水反应的产物。
①实验前,向Ⅲ、Ⅳ中均放入干燥蓝色石蕊纸花,并向
②实验时,根据Ⅲ中的纸花不变色及
③同学们分析后,认为用该实验装置不能得出“氯气与水反应有酸性物质生成”的结论,理由是
(4)Ⅴ中盛有
 淀粉溶液,随
淀粉溶液,随 通入,可获得
通入,可获得 具有氧化性的实验证据是
具有氧化性的实验证据是(5)Ⅵ中盛放的试剂是
 溶液,其作用是
溶液,其作用是(6)利用如下装置也可以制取氯气,并利用氯气的氧化性制取
 。
。
①装置A中,
 被还原为
被还原为 ,写出反应的离子方程式:
,写出反应的离子方程式:②装置C中发生如下反应,将方程式配平:
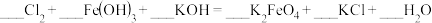
您最近一年使用:0次
名校
解题方法
7 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)请写出硫在元素周期表的位置:___________ 。
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径: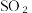 转化成
转化成 的化学方程式:
的化学方程式:___________ 。
你认为减少酸雨产生的无效措施是___________ (填字母序号)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:___________ 。
(5)当观察到②中溶液颜色变浅时,①中的现象是___________ 。
(6)装置③的作用是___________ 。
(7)②中的现象说明二氧化硫具有的性质是___________ 。
(8)从氧化还原角度制备硫代硫酸钠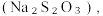 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。
(9)为进一步减少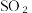 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原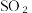 得到单质硫的方法来除去
得到单质硫的方法来除去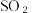 写出该反应的化学方程式:
写出该反应的化学方程式:___________ 。
(1)请写出硫在元素周期表的位置:
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
A.热稳定性: | B.溶解度: 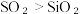 |
C.单质的熔点: | D.酸性:  |
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径:

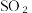 转化成
转化成 的化学方程式:
的化学方程式:你认为减少酸雨产生的无效措施是
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
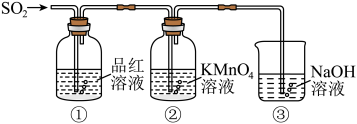
(5)当观察到②中溶液颜色变浅时,①中的现象是
(6)装置③的作用是
(7)②中的现象说明二氧化硫具有的性质是
(8)从氧化还原角度制备硫代硫酸钠
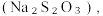 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。A. | B. 和浓 和浓 | C.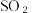 和 和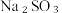 | D.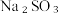 和 和 |
(9)为进一步减少
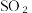 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原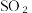 得到单质硫的方法来除去
得到单质硫的方法来除去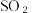 写出该反应的化学方程式:
写出该反应的化学方程式:
您最近一年使用:0次
解题方法
8 . Ⅰ.铁及其化合物在生产生活中有极其重要的用途。 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:
(1)由上述实验能否得出“维生素C可将 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:______ 。
Ⅱ.高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠: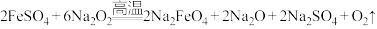 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是______ 。
(3)高铁酸钾可通过次氯酸钾氧化 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
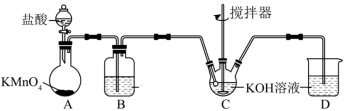
回答下列问题:
①装置A中 与盐酸反应生成
与盐酸反应生成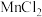 和
和 ,其化学方程式为
,其化学方程式为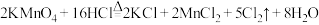 。
。
a.请用双线桥法标出电子转移方向与数目_______ 。
b.上述反应中的HCl体现了什么性质?_______ 。
②将制备的 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为_____ 。
③ 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是______ 。
④若实验制得的次氯酸钾溶液中 (N代表微粒个数),则
(N代表微粒个数),则
_______ 。
⑤装置D的作用是_______ 。
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:________ 。
 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:| 实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
(1)由上述实验能否得出“维生素C可将
 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:Ⅱ.高铁酸钾(
 )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
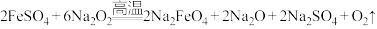 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是(3)高铁酸钾可通过次氯酸钾氧化
 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
回答下列问题:
①装置A中
 与盐酸反应生成
与盐酸反应生成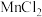 和
和 ,其化学方程式为
,其化学方程式为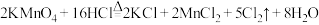 。
。a.请用双线桥法标出电子转移方向与数目
b.上述反应中的HCl体现了什么性质?
②将制备的
 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为③
 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是④若实验制得的次氯酸钾溶液中
 (N代表微粒个数),则
(N代表微粒个数),则
⑤装置D的作用是
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将
 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:
您最近一年使用:0次
解题方法
9 . 84消毒液是常用消毒剂,主要成分为 ,某化学小组在实验室制备84消毒液并探究其相关性质。回答下列问题:
,某化学小组在实验室制备84消毒液并探究其相关性质。回答下列问题:
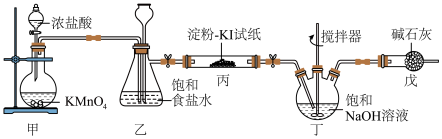
(1)装置甲中盛放浓盐酸的仪器名称是_______ 。
(2)配平方程式:_______ 。
_______MnO +_______Cl-+ _______= _______Mn2++_______Cl2↑+_______
+_______Cl-+ _______= _______Mn2++_______Cl2↑+_______
(3)装置丙中现象_______ 所发生反应的化学方程_______ 。
(4)装置丁制备 的反应中,氧化产物和还原产物的物质的量之比为1∶1,若要制取
的反应中,氧化产物和还原产物的物质的量之比为1∶1,若要制取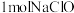 ,理论上反应中转移电子数为
,理论上反应中转移电子数为___ 。
(5)装置戊的作用是_______ 装置乙饱和食盐水作用_______ 。
 ,某化学小组在实验室制备84消毒液并探究其相关性质。回答下列问题:
,某化学小组在实验室制备84消毒液并探究其相关性质。回答下列问题:
(1)装置甲中盛放浓盐酸的仪器名称是
(2)配平方程式:
_______MnO
 +_______Cl-+ _______= _______Mn2++_______Cl2↑+_______
+_______Cl-+ _______= _______Mn2++_______Cl2↑+_______(3)装置丙中现象
(4)装置丁制备
 的反应中,氧化产物和还原产物的物质的量之比为1∶1,若要制取
的反应中,氧化产物和还原产物的物质的量之比为1∶1,若要制取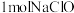 ,理论上反应中转移电子数为
,理论上反应中转移电子数为(5)装置戊的作用是
您最近一年使用:0次
名校
解题方法
10 . 如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
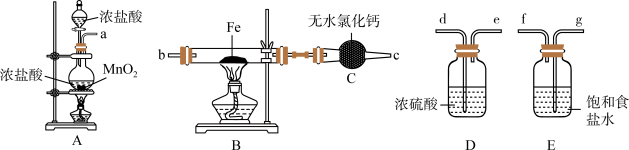
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为___________ 。
(5)利用制取的无水氯化铁固体配制少量 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为___________ ;溶解所得溶液中含有 的原因可能是
的原因可能是___________ 。
②向沸水中滴加少量 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至___________ (填实验现象)时停止,得到 胶体。
胶体。

回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
(2)装置A中发生反应的离子方程式为
(3)装置E的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为(5)利用制取的无水氯化铁固体配制少量
 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为
 的原因可能是
的原因可能是②向沸水中滴加少量
 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至 胶体。
胶体。
您最近一年使用:0次
2024-03-02更新
|
88次组卷
|
2卷引用:内蒙古自治区乌兰浩特第一中学2023-2024学年高一上学期期末考试化学试题



