1 . 根据下列实验设计,回答问题:
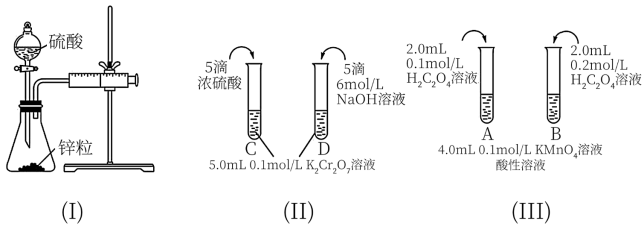
(1)利用实验(Ⅰ)探究锌与0.1 硫酸和2
硫酸和2 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:___________ 。
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知: (橙色)
(橙色) (黄色)
(黄色) 推测D试管中实验现象为
推测D试管中实验现象为___________ ,用平衡移动原理解释原因:___________ 。
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为___________ ,推测该实验设计能否达到实验目的并描述判断理由:___________ 。
(4)某小组也用酸性KMnO4溶液和草酸( )溶液进行实验,实验操作及现象如下表:
)溶液进行实验,实验操作及现象如下表:
①实验i、实验ii可得出的结论是___________ 。
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
提供试剂:0.01 酸性
酸性 溶液,0.1
溶液,0.1 草酸溶液,3
草酸溶液,3 硫酸,
硫酸, 溶液,
溶液, 固体,蒸馏水。
固体,蒸馏水。
补全实验iii的操作:向试管中先加入5 0.01
0.01 酸性
酸性 溶液,
溶液,___________ ,最后加入5 0.1
0.1 草酸溶液。
草酸溶液。

(1)利用实验(Ⅰ)探究锌与0.1
 硫酸和2
硫酸和2 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:
 (橙色)
(橙色) (黄色)
(黄色) 推测D试管中实验现象为
推测D试管中实验现象为(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为
(4)某小组也用酸性KMnO4溶液和草酸(
 )溶液进行实验,实验操作及现象如下表:
)溶液进行实验,实验操作及现象如下表:| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入5 0.01 0.01 酸性 酸性 溶液,再加入1滴3 溶液,再加入1滴3 硫酸和9滴蒸馏水,最后加入5 硫酸和9滴蒸馏水,最后加入5 0.1 0.1 草酸溶液 草酸溶液 | 前10 内溶液紫色无明显变化,后颜色逐渐变浅,30 内溶液紫色无明显变化,后颜色逐渐变浅,30 后几乎变为无色 后几乎变为无色 |
| ii | 向另一支试管中先加入5 0.01 0.01 酸性 酸性 溶液,再加入10滴3 溶液,再加入10滴3 硫酸,最后加入5 硫酸,最后加入5 0.1m 0.1m 草酸溶液 草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
 对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。提供试剂:0.01
 酸性
酸性 溶液,0.1
溶液,0.1 草酸溶液,3
草酸溶液,3 硫酸,
硫酸, 溶液,
溶液, 固体,蒸馏水。
固体,蒸馏水。补全实验iii的操作:向试管中先加入5
 0.01
0.01 酸性
酸性 溶液,
溶液, 0.1
0.1 草酸溶液。
草酸溶液。
您最近一年使用:0次
2021-11-05更新
|
379次组卷
|
4卷引用:广东省广州市部分学校2021-2022学年高二上学期期中联考化学试题
2 . Ⅰ.硒( )在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬(
)在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬( )被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。
)被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。
(1)在元素周期表中,硒是第34号元素,与氧同主族,硒原子的电子式表示为___________ ,比较硫和硒的氢化物的热稳定性:
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
Ⅱ.工业制备高纯硒的流程如下:
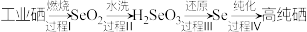
(2)下列说法正确的是___________。
(3)过程Ⅲ中还需要用的反应物为 ,对应产物为
,对应产物为 ,标况下,当有
,标况下,当有 生成时,该反应中转移的电子数目为
生成时,该反应中转移的电子数目为___________ 。
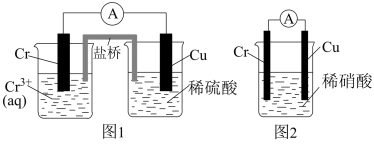
(4)工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是___________。
Ⅲ.+6价铬的化合物毒性较大,常用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有 ),其原理示意图如下图所示:
),其原理示意图如下图所示:
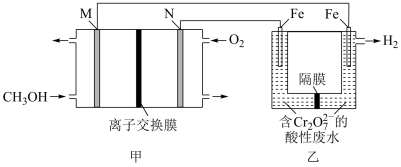
(5)M极为原电池的___________ 极(填“正”或“负”)。
(6)N极附近的
___________ (填“变大”或“变小”或“不变”)。
(7)写出电解池中阳极产物将 转化为
转化为 的离子方程式
的离子方程式___________ 。
 )在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬(
)在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬( )被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。
)被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。(1)在元素周期表中,硒是第34号元素,与氧同主族,硒原子的电子式表示为

 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。Ⅱ.工业制备高纯硒的流程如下:
(2)下列说法正确的是___________。
| A.过程Ⅰ只发生氧化反应 |
| B.过程Ⅱ的水洗过程属于非氧化还原反应 |
C. 能与 能与 反应生成 反应生成 和 和 |
D. 在过程Ⅲ的反应中体现了还原性 在过程Ⅲ的反应中体现了还原性 |
(3)过程Ⅲ中还需要用的反应物为
 ,对应产物为
,对应产物为 ,标况下,当有
,标况下,当有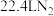 生成时,该反应中转移的电子数目为
生成时,该反应中转移的电子数目为(4)工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是___________。

A.由实验现象可知:金属活动性 |
B.图1为原电池装置, 电极上产生的是 电极上产生的是 |
C.两个装置中,电子均由 电极流向 电极流向 电极 电极 |
D.图2装置中 电极上发生的电极反应式为 电极上发生的电极反应式为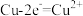 |
Ⅲ.+6价铬的化合物毒性较大,常用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有
 ),其原理示意图如下图所示:
),其原理示意图如下图所示:
(5)M极为原电池的
(6)N极附近的

(7)写出电解池中阳极产物将
 转化为
转化为 的离子方程式
的离子方程式
您最近一年使用:0次
名校
解题方法
3 . 二氯化一氯五氮合钴 可用作聚氯乙烯的染色剂和稳定剂。
可用作聚氯乙烯的染色剂和稳定剂。 不溶于水和乙醇;
不溶于水和乙醇;
 是粉红色不溶于水的固体;
是粉红色不溶于水的固体;
 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。
Ⅰ.制备 :装置和简化流程如图。
:装置和简化流程如图。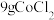 、
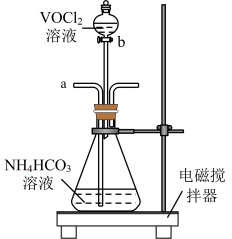
、 和20mL浓氮水,并不断搅拌,充分反应,仪器a的名称是
和20mL浓氮水,并不断搅拌,充分反应,仪器a的名称是________ ;加入浓氨水前先加 的原因有
的原因有________ 。
(2)步骤ii ①请补齐该步骤发生的相关反应的离子方程式:_____
□________+□ +□
+□ □
□ □________
□________
②加入20mL5% 的操作方式为
的操作方式为________ 。
A.过滤出黄色沉淀,向沉淀中加入 B.向黄色悬浊液中加入
C.一次性快速倒入 D.控温缓慢滴加
(3)步骤iii 待溶液中停止产生气泡后,缓慢加入20mL浓盐酸,在85℃水浴中加热20min,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。产品洗涤时必须使用的试剂有① 溶液、②无水乙醇、③冰水,洗涤过程中这三种试剂的使用先后顺序为
溶液、②无水乙醇、③冰水,洗涤过程中这三种试剂的使用先后顺序为________ (用序号填写)。
Ⅱ.产品测定
(4)取0.3g产品加入强碱溶液,加热煮沸,将蒸出的氨气用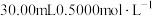 的盐酸完全吸收。滴加2~3滴甲基橙,再用
的盐酸完全吸收。滴加2~3滴甲基橙,再用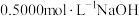 溶液滴定,达到终点时共消耗NaOH溶液22.00mL。产品中N的质量分数为
溶液滴定,达到终点时共消耗NaOH溶液22.00mL。产品中N的质量分数为________ (结果保留三位有效数字)。
Ⅲ.实验探究
(5)实验小组在制备过程中发现 溶液中直接加入
溶液中直接加入 ,
, 不被氧化,据此认为加入浓氨水和
不被氧化,据此认为加入浓氨水和 对
对 的氧化产生了影响,提出以下猜想并设计、进行实验验证。
的氧化产生了影响,提出以下猜想并设计、进行实验验证。
猜想1:加入 溶液,增强了
溶液,增强了 的氧化性。
的氧化性。
猜想2:加入浓氨水形成配合物,增强了 离子的还原性。
离子的还原性。
①a是________ ,b是________ 。
②请从物质结构角度解释猜想2合理可能的原因________ 。
 可用作聚氯乙烯的染色剂和稳定剂。
可用作聚氯乙烯的染色剂和稳定剂。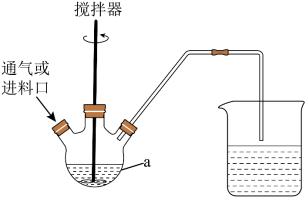
 不溶于水和乙醇;
不溶于水和乙醇; 是粉红色不溶于水的固体;
是粉红色不溶于水的固体; 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。Ⅰ.制备
 :装置和简化流程如图。
:装置和简化流程如图。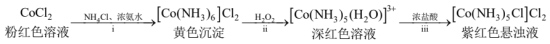
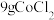 、
、 和20mL浓氮水,并不断搅拌,充分反应,仪器a的名称是
和20mL浓氮水,并不断搅拌,充分反应,仪器a的名称是 的原因有
的原因有(2)步骤ii ①请补齐该步骤发生的相关反应的离子方程式:
□________+□
 +□
+□ □
□ □________
□________②加入20mL5%
 的操作方式为
的操作方式为A.过滤出黄色沉淀,向沉淀中加入 B.向黄色悬浊液中加入
C.一次性快速倒入 D.控温缓慢滴加
(3)步骤iii 待溶液中停止产生气泡后,缓慢加入20mL浓盐酸,在85℃水浴中加热20min,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。产品洗涤时必须使用的试剂有①
 溶液、②无水乙醇、③冰水,洗涤过程中这三种试剂的使用先后顺序为
溶液、②无水乙醇、③冰水,洗涤过程中这三种试剂的使用先后顺序为Ⅱ.产品测定
(4)取0.3g产品加入强碱溶液,加热煮沸,将蒸出的氨气用
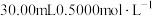 的盐酸完全吸收。滴加2~3滴甲基橙,再用
的盐酸完全吸收。滴加2~3滴甲基橙,再用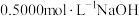 溶液滴定,达到终点时共消耗NaOH溶液22.00mL。产品中N的质量分数为
溶液滴定,达到终点时共消耗NaOH溶液22.00mL。产品中N的质量分数为Ⅲ.实验探究
(5)实验小组在制备过程中发现
 溶液中直接加入
溶液中直接加入 ,
, 不被氧化,据此认为加入浓氨水和
不被氧化,据此认为加入浓氨水和 对
对 的氧化产生了影响,提出以下猜想并设计、进行实验验证。
的氧化产生了影响,提出以下猜想并设计、进行实验验证。猜想1:加入
 溶液,增强了
溶液,增强了 的氧化性。
的氧化性。猜想2:加入浓氨水形成配合物,增强了
 离子的还原性。
离子的还原性。实验编号 | 试剂 | 现象 |
1 | 0.5mL水 | 无明显变化 |
2 | a | 无明显变化 |
3 | b | 溶液变为深红色,且出现棕褐色沉淀 |

①a是
②请从物质结构角度解释猜想2合理可能的原因
您最近一年使用:0次
名校
解题方法
4 . 铁元素属于过渡元素,在化学反应中最外层和次外层均可失去电子。铁在化合物中通常显+2价、+3价。
实验甲组用如图所示的装置制备白色的

供选择的试剂有:①铁粉 ②稀硫酸 ③NaOH溶液
(1)装置I中加入___________ (填写编号)
(2)本实验成功的关键是___________ 。
A.实验过程隔绝空气(氧气) B.实验过程空气(氧气)充足
若控制不当,将会生成___________ 色的 沉淀。反应的化学方程式为
沉淀。反应的化学方程式为___________ 。
(3)待装置Ⅱ中a处收集到的 纯净后,如何操作会得到白色的
纯净后,如何操作会得到白色的 沉淀?
沉淀?_______ 。
实验乙组用如下实验步骤探究 和
和 的性质
的性质
(4)分别取一定量 、
、 固体,均配制成
固体,均配制成 的溶液。为防止
的溶液。为防止 溶液被氧化,可向溶液中加入
溶液被氧化,可向溶液中加入___________ 。
A.铁片 B.酸性 溶液
溶液
(5)取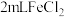 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。书写
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。书写 溶液与氯水反应的离子方程式。
溶液与氯水反应的离子方程式。___________ 。
(6)取 溶液,向其中加入
溶液,向其中加入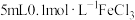 溶液,充分振荡。分别取2mL混合溶液进行如下实验:
溶液,充分振荡。分别取2mL混合溶液进行如下实验:
通过实验①可知两种溶液混合___________ 反应(“发生”或“不发生”)。结合题干和实验②的实验结论,你能得出什么结论?___________ 。
实验甲组用如图所示的装置制备白色的


供选择的试剂有:①铁粉 ②稀硫酸 ③NaOH溶液
(1)装置I中加入
(2)本实验成功的关键是
A.实验过程隔绝空气(氧气) B.实验过程空气(氧气)充足
若控制不当,将会生成
 沉淀。反应的化学方程式为
沉淀。反应的化学方程式为(3)待装置Ⅱ中a处收集到的
 纯净后,如何操作会得到白色的
纯净后,如何操作会得到白色的 沉淀?
沉淀?实验乙组用如下实验步骤探究
 和
和 的性质
的性质(4)分别取一定量
 、
、 固体,均配制成
固体,均配制成 的溶液。为防止
的溶液。为防止 溶液被氧化,可向溶液中加入
溶液被氧化,可向溶液中加入A.铁片 B.酸性
 溶液
溶液(5)取
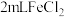 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。书写
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。书写 溶液与氯水反应的离子方程式。
溶液与氯水反应的离子方程式。(6)取
 溶液,向其中加入
溶液,向其中加入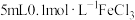 溶液,充分振荡。分别取2mL混合溶液进行如下实验:
溶液,充分振荡。分别取2mL混合溶液进行如下实验:| 实验序号 | 加入试剂 | 现象 | 结论 |
| ① |  溶液 溶液 |  层呈现紫色 层呈现紫色 | |
| ② | 1滴KSCN溶液 | 溶液变红 |
您最近一年使用:0次
名校
解题方法
5 . 某学习小组实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图所示:

已知:①CS2不溶于水,密度比水大;NH3不溶于CS2;
②热稳定性;NH4HS低于NH4SCN。
实验步骤如下:
(1)制备NH4SCN溶液:
制备NH4SCN原理为CS2+3NH3 NH4SCN+NH4HS(该反应比较缓慢)。
NH4SCN+NH4HS(该反应比较缓慢)。
①实验前,经检验装置的气密性后装入试剂。其中,盛放碱石灰的玻璃仪器为_______ 仪器名称)。向三颈烧瓶内装入固体催化剂、CS2和水,三颈烧瓶左侧的进气管口必须浸没到CS2液体中,目的是_______ 。
②实验开始时打开K1,加热装置A、D,使装置A中产生的气体缓缓通入装置D中,当看到三颈烧瓶中_______ 现象时说明该反应接近完全,装置C的作用是_______ 。
(2)制备KSCN晶体:熄灭装置A中的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃一段时间,其目的是_______ ;然后打开K2,再趁热滴加适量的KOH溶液,制得较纯净的KSCN溶液,该反应的化学方程式为_______ ;最后提纯得到硫氰化钾晶体。
(3)装置E用来吸收尾气,防止污染环境,吸收NH3生成无色无味气体的离子方程式为_______ (铬元素被还原为Cr3+)
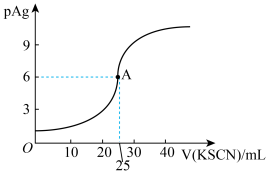
(4)使用制得的晶体配制成0.100mol/L的KSCN标准溶液来滴定25.00mL未知浓度的AgNO3溶液,以Fe(NO3)3溶液作指示剂,测得溶液中pAg=-lgc(Ag+)随加入KSCN溶液的体积变化如图所示。已知:SCN-+Ag+=AgSCN↓(白色),A点为滴定终点(滴定过程不考虑 氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=
氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=_______ 。

已知:①CS2不溶于水,密度比水大;NH3不溶于CS2;
②热稳定性;NH4HS低于NH4SCN。
实验步骤如下:
(1)制备NH4SCN溶液:
制备NH4SCN原理为CS2+3NH3
 NH4SCN+NH4HS(该反应比较缓慢)。
NH4SCN+NH4HS(该反应比较缓慢)。①实验前,经检验装置的气密性后装入试剂。其中,盛放碱石灰的玻璃仪器为
②实验开始时打开K1,加热装置A、D,使装置A中产生的气体缓缓通入装置D中,当看到三颈烧瓶中
(2)制备KSCN晶体:熄灭装置A中的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃一段时间,其目的是
(3)装置E用来吸收尾气,防止污染环境,吸收NH3生成无色无味气体的离子方程式为
(4)使用制得的晶体配制成0.100mol/L的KSCN标准溶液来滴定25.00mL未知浓度的AgNO3溶液,以Fe(NO3)3溶液作指示剂,测得溶液中pAg=-lgc(Ag+)随加入KSCN溶液的体积变化如图所示。已知:SCN-+Ag+=AgSCN↓(白色),A点为滴定终点(滴定过程不考虑
 氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=
氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=
您最近一年使用:0次
2023-12-24更新
|
166次组卷
|
2卷引用:重庆市巫溪县中学校2023-2024学年高二上学期期末模拟考试化学试题
名校
6 . 二氯异氰尿酸钠 ,是中国疾控中心研发的“-18℃低温消毒剂”主要成分之一,实验室通过以下原理和装置(夹持仪器已略去)制取二氯异氰尿酸钠。
,是中国疾控中心研发的“-18℃低温消毒剂”主要成分之一,实验室通过以下原理和装置(夹持仪器已略去)制取二氯异氰尿酸钠。

尿素三聚氰酸二氯异氰尿酸钠
已知:实验室常用高浓度的NaClO溶液和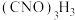 固体,在10℃时反应制备二氧异氰尿酸钠,主要发生反应:
固体,在10℃时反应制备二氧异氰尿酸钠,主要发生反应: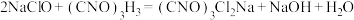 。
。
(1) 和
和 中
中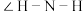 大小:
大小:
_______  (填“>”“<”或“=”),氯化铵的阳离子VSEPR模型为
(填“>”“<”或“=”),氯化铵的阳离子VSEPR模型为_______ ;三聚氰酸中C原子的杂化轨道类型是_______ 。
(2)制备高浓度NaClO溶液:
①NaClO溶液可由低温下将 缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为
缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为_______ ;
②为提高B中NaOH的利用率,需对该装置进行改进的可行方法是_______ (一种即可)。
(3)制备二氧异氰尿酸钠:
待装置B中出现液面上方有黄绿色气体现象时,可由三颈烧瓶进料口加入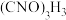 固体,反应过程中仍需不断通入
固体,反应过程中仍需不断通入 的理由是
的理由是_______ 。实验过程中若温度过高,pH值过低,会生成 ,写出
,写出 与
与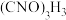 生成
生成 、
、 的化学方程式:
的化学方程式:_______ 。
(4)实验室测定二氯异氰尿酸钠样品中有效氯的原理如下:



准确称取m g样品,配成100 mL溶液,取20.00 mL所配溶液于碘量瓶中,加入稀 和过量KI溶液,充分反应后,加入淀粉溶液,用c mol⋅L
和过量KI溶液,充分反应后,加入淀粉溶液,用c mol⋅L
 标准溶液滴定,滴到终点时,消耗
标准溶液滴定,滴到终点时,消耗 标准溶液的体积为V mL,则样品有效氯含量为
标准溶液的体积为V mL,则样品有效氯含量为_______ %(有效氯含量 )。
)。
 ,是中国疾控中心研发的“-18℃低温消毒剂”主要成分之一,实验室通过以下原理和装置(夹持仪器已略去)制取二氯异氰尿酸钠。
,是中国疾控中心研发的“-18℃低温消毒剂”主要成分之一,实验室通过以下原理和装置(夹持仪器已略去)制取二氯异氰尿酸钠。
尿素三聚氰酸二氯异氰尿酸钠
已知:实验室常用高浓度的NaClO溶液和
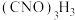 固体,在10℃时反应制备二氧异氰尿酸钠,主要发生反应:
固体,在10℃时反应制备二氧异氰尿酸钠,主要发生反应: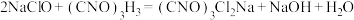 。
。(1)
 和
和 中
中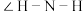 大小:
大小:
 (填“>”“<”或“=”),氯化铵的阳离子VSEPR模型为
(填“>”“<”或“=”),氯化铵的阳离子VSEPR模型为(2)制备高浓度NaClO溶液:
①NaClO溶液可由低温下将
 缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为
缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为②为提高B中NaOH的利用率,需对该装置进行改进的可行方法是
(3)制备二氧异氰尿酸钠:
待装置B中出现液面上方有黄绿色气体现象时,可由三颈烧瓶进料口加入
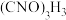 固体,反应过程中仍需不断通入
固体,反应过程中仍需不断通入 的理由是
的理由是 ,写出
,写出 与
与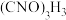 生成
生成 、
、 的化学方程式:
的化学方程式:(4)实验室测定二氯异氰尿酸钠样品中有效氯的原理如下:



准确称取m g样品,配成100 mL溶液,取20.00 mL所配溶液于碘量瓶中,加入稀
 和过量KI溶液,充分反应后,加入淀粉溶液,用c mol⋅L
和过量KI溶液,充分反应后,加入淀粉溶液,用c mol⋅L
 标准溶液滴定,滴到终点时,消耗
标准溶液滴定,滴到终点时,消耗 标准溶液的体积为V mL,则样品有效氯含量为
标准溶液的体积为V mL,则样品有效氯含量为 )。
)。
您最近一年使用:0次
2023-04-13更新
|
167次组卷
|
2卷引用:湖南省多校联考2022-2023学年高二下学期期中考试化学试题
名校
解题方法
7 . 实验小组制备硫代硫酸钠(Na2S2O3)并探究其性质。
资料:ⅰ. 。
。
ⅱ.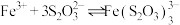 (紫黑色)。
(紫黑色)。
ⅲ. 是难溶于水、可溶于
是难溶于水、可溶于 溶液的白色固体。
溶液的白色固体。
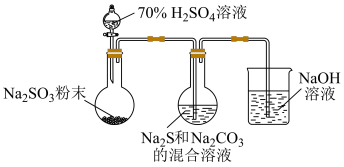
(1)实验室可利用反应: 制备
制备 ,装置如下图。
,装置如下图。
①用化学用语解释 和
和 的混合溶液呈碱性的原因:
的混合溶液呈碱性的原因: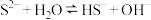 、
、___________ 。
②为了保证 的产量,实验中通入的
的产量,实验中通入的 不能过量。要控制
不能过量。要控制 的生成速率,可以采取的措施有:
的生成速率,可以采取的措施有:___________ (写出一条)。
(2)探究 溶液与不同金属的硫酸盐溶液间反应的多样性。
溶液与不同金属的硫酸盐溶液间反应的多样性。
①Ⅰ中产生白色沉淀的离子方程式为___________ 。
②经检验,现象Ⅱ中的沉淀有 和
和 ,用平衡移动原理解释Ⅱ中的现象:
,用平衡移动原理解释Ⅱ中的现象:___________ 。
③经检验,现象Ⅲ中的无色溶液中含有 。Ⅲ中溶液变为无色的离子方程式为
。Ⅲ中溶液变为无色的离子方程式为___________ 。
④从化学反应速率和限度的角度解释Ⅲ中 与
与 反应的实验现象:
反应的实验现象:___________ 。
以上实验说明: 溶液与金属阳离子反应的多样性和阳离子的性质有关。
溶液与金属阳离子反应的多样性和阳离子的性质有关。
资料:ⅰ.
 。
。ⅱ.
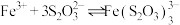 (紫黑色)。
(紫黑色)。ⅲ.
 是难溶于水、可溶于
是难溶于水、可溶于 溶液的白色固体。
溶液的白色固体。(1)实验室可利用反应:
 制备
制备 ,装置如下图。
,装置如下图。
①用化学用语解释
 和
和 的混合溶液呈碱性的原因:
的混合溶液呈碱性的原因: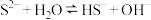 、
、②为了保证
 的产量,实验中通入的
的产量,实验中通入的 不能过量。要控制
不能过量。要控制 的生成速率,可以采取的措施有:
的生成速率,可以采取的措施有:(2)探究
 溶液与不同金属的硫酸盐溶液间反应的多样性。
溶液与不同金属的硫酸盐溶液间反应的多样性。| 实验 | 试剂 | 现象 | |
| 试管 | 滴管 | ||
 | 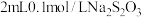 溶液 溶液 |  溶液(浓度约为 溶液(浓度约为 ) ) | Ⅰ.局部生成白色沉淀,振荡后沉淀溶解,得到无色溶液 |
 溶液 溶液 | Ⅱ.一段时间后,生成沉淀 | ||
 溶液 溶液 | Ⅲ.混合后溶液先变成紫黑色, 时溶液几乎变为无色 时溶液几乎变为无色 | ||
②经检验,现象Ⅱ中的沉淀有
 和
和 ,用平衡移动原理解释Ⅱ中的现象:
,用平衡移动原理解释Ⅱ中的现象:③经检验,现象Ⅲ中的无色溶液中含有
 。Ⅲ中溶液变为无色的离子方程式为
。Ⅲ中溶液变为无色的离子方程式为④从化学反应速率和限度的角度解释Ⅲ中
 与
与 反应的实验现象:
反应的实验现象:以上实验说明:
 溶液与金属阳离子反应的多样性和阳离子的性质有关。
溶液与金属阳离子反应的多样性和阳离子的性质有关。
您最近一年使用:0次
名校
解题方法
8 . 氮元素与人类的生命、生产等活动息息相关。
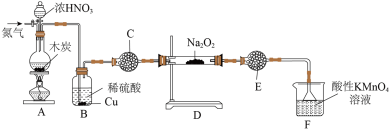
(1)亚硝酸钠( )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
已知:① ;
;
②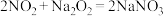
③酸性条件下, 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为___________ 。
②装置B中的实验现象为___________ 。
③装置C的作用为___________ 。
④装置F中发生反应的离子方程式为___________ 。
(2)生物脱氮法流程如下:
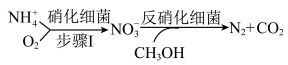
步骤I中若 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为___________ 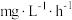 。
。
(3)目前,湿法 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一
已知:两组实验中 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为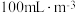
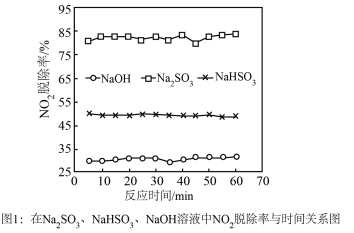
①图1是 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式___________ 。
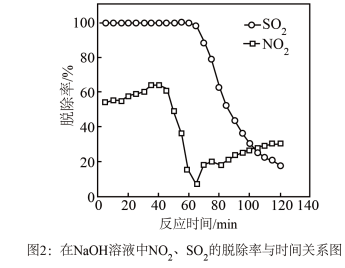
②实验发现,在相同实验条件下利用 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因___________ 。
(1)亚硝酸钠(
 )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
已知:①
 ;
;②
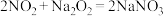
③酸性条件下,
 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为
②装置B中的实验现象为
③装置C的作用为
④装置F中发生反应的离子方程式为
(2)生物脱氮法流程如下:

步骤I中若
 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为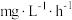 。
。(3)目前,湿法
 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一已知:两组实验中
 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为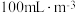
①图1是
 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式
②实验发现,在相同实验条件下利用
 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因
您最近一年使用:0次
2023-07-14更新
|
442次组卷
|
2卷引用:四川省泸州市泸县第五中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
9 . 氧钒(IV)碱式碳酸铵为紫色晶体,是制备热敏材料 的原料,其化学式为
的原料,其化学式为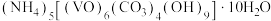 。实验室以
。实验室以 为原料制备氧钒(IV)碱式碳酸铵晶体,过程如下,并对所制备的晶体中钒元素的质量分数进行测定。
为原料制备氧钒(IV)碱式碳酸铵晶体,过程如下,并对所制备的晶体中钒元素的质量分数进行测定。

已知:① 具有还原性,易被
具有还原性,易被 氧化
氧化
② 与
与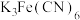 溶液产生蓝色沉淀
溶液产生蓝色沉淀
I、制备氧钒(IV)碱式碳酸铵晶体
(1)步骤1中生成 的同时生成一种无色无污染的气体,该反应的化学方程式为
的同时生成一种无色无污染的气体,该反应的化学方程式为___________ 。
(2)步骤2可在下图装置中进行。滴加 溶液之前,需由a口向锥形瓶中通入一段时间
溶液之前,需由a口向锥形瓶中通入一段时间 ,作用是
,作用是___________ ,所得紫色晶体残留的杂质阴离子主要为___________ 。
II、欲测定上述流程中所得氧钒(IV)碱式碳酸铵晶体钒元素的质量分数,现进行如下操作:
①称量wg晶体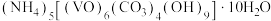 溶于水,配成500mL溶液;
溶于水,配成500mL溶液;
②取100mL上述溶液于锥形瓶中,滴加酸性溶液氧化,再除去多余的(方法略);
③用 标准溶液滴定至终点(滴定过程只发生反应
标准溶液滴定至终点(滴定过程只发生反应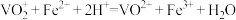 ),消耗标准溶液的体积为ymL。
),消耗标准溶液的体积为ymL。
(3)操作②时,酸性 溶液氧化
溶液氧化 的离子方程式为
的离子方程式为___________ 。
(4)操作③滴定时,选用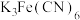 溶液作指示剂,滴定终点的现象为
溶液作指示剂,滴定终点的现象为___________ 。
(5)该晶体中钒元素的质量分数为___________ %(用含有w、x、y的式子表示)。
(6)若实验测得钒的质量分数偏大,则可能的原因是___________ 。
A. 标准溶液部分被氧化
标准溶液部分被氧化
B.滴定前平视读数,滴定终点时俯视读数
C.滴定管水洗后未用标准溶液润洗
 的原料,其化学式为
的原料,其化学式为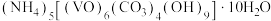 。实验室以
。实验室以 为原料制备氧钒(IV)碱式碳酸铵晶体,过程如下,并对所制备的晶体中钒元素的质量分数进行测定。
为原料制备氧钒(IV)碱式碳酸铵晶体,过程如下,并对所制备的晶体中钒元素的质量分数进行测定。
已知:①
 具有还原性,易被
具有还原性,易被 氧化
氧化②
 与
与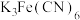 溶液产生蓝色沉淀
溶液产生蓝色沉淀I、制备氧钒(IV)碱式碳酸铵晶体
(1)步骤1中生成
 的同时生成一种无色无污染的气体,该反应的化学方程式为
的同时生成一种无色无污染的气体,该反应的化学方程式为(2)步骤2可在下图装置中进行。滴加
 溶液之前,需由a口向锥形瓶中通入一段时间
溶液之前,需由a口向锥形瓶中通入一段时间 ,作用是
,作用是
II、欲测定上述流程中所得氧钒(IV)碱式碳酸铵晶体钒元素的质量分数,现进行如下操作:
①称量wg晶体
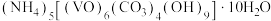 溶于水,配成500mL溶液;
溶于水,配成500mL溶液;②取100mL上述溶液于锥形瓶中,滴加酸性溶液氧化,再除去多余的(方法略);
③用
 标准溶液滴定至终点(滴定过程只发生反应
标准溶液滴定至终点(滴定过程只发生反应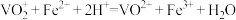 ),消耗标准溶液的体积为ymL。
),消耗标准溶液的体积为ymL。(3)操作②时,酸性
 溶液氧化
溶液氧化 的离子方程式为
的离子方程式为(4)操作③滴定时,选用
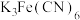 溶液作指示剂,滴定终点的现象为
溶液作指示剂,滴定终点的现象为(5)该晶体中钒元素的质量分数为
(6)若实验测得钒的质量分数偏大,则可能的原因是
A.
 标准溶液部分被氧化
标准溶液部分被氧化B.滴定前平视读数,滴定终点时俯视读数
C.滴定管水洗后未用标准溶液润洗
您最近一年使用:0次
2022-11-12更新
|
418次组卷
|
2卷引用:重庆第八中学2022-2023学年高二上学期期中考试化学试题
10 . 二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2 可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:_______ 。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2.

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是_______ 。
②装置B的作用是_______ 。
③A装置中,装H2SO4溶液的仪器名称为:_______ 。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______ 作指示剂,用0.1000mol·L ‑1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2 = 2I-+
= 2I-+ ),当看到
),当看到_______ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为_______ mol·L-1。
(4)下列操作使测定结果偏高的是_______
(1)在处理废水时,ClO2 可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2.

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
②装置B的作用是
③A装置中,装H2SO4溶液的仪器名称为:
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入
 = 2I-+
= 2I-+ ),当看到
),当看到(4)下列操作使测定结果偏高的是_______
| A.滴定前平视,滴定终点俯视读数 |
| B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗 |
| C.用C中溶液润洗锥形瓶,再取10mLC中溶液于锥形瓶中 |
| D.滴定前正常,滴定后滴定管尖嘴内有气泡 |
您最近一年使用:0次



