1 . A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是_______ ;
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:_______ 。
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)_______ 。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为_______ ,检查其中刺激性气体产物X的方法是_______ 。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为_______ 。
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是_______ mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为_______ 。
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是_______ 盐,X极易溶于水的原因是:_______ 。
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是
您最近一年使用:0次
2 . (1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol/L烧碱溶液,至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体0.672L(标准状况)。据此计算:
①加入铝粉的质量 克
②原硫酸铜溶液的物质的量浓度 mol/L
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol/L烧碱溶液,至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体0.672L(标准状况)。据此计算:
①加入铝粉的质量 克
②原硫酸铜溶液的物质的量浓度 mol/L
您最近一年使用:0次
2013·安徽马鞍山·一模
名校
3 . 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中如右图所示:.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.下列说法中错误的是
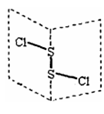

| A.S2Cl2的结构式为Cl-S-S-Cl |
| B.S2Cl2分子中既有有极性键又有非极性键 |
| C.反应中SO2是还原产物,S是氧化产物 |
| D.反应中,生成 1molSO2,转移电子为3mol |
您最近一年使用:0次
2016-04-20更新
|
918次组卷
|
11卷引用:2015-2016学年甘肃天水一中高一下第一次月考化学试卷
2015-2016学年甘肃天水一中高一下第一次月考化学试卷2016届湖南省衡阳市第八中学高三上学期第一次月考化学试卷2015-2016学年湖北省宜昌一中高二下3月月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷湖南省邵东县第一中学2017届高三上学期第三次月考化学试题福建省龙岩市武平县第一中学2021届高三上学期10月月考化学试题广东省梅州市虎山中学、蕉岭中学、平远中学、宪梓中学四校2021-2022学年高二下学期5月联考化学试题(已下线)2013届安徽省马鞍山市高中毕业班第一次教学质量检测理综化学试卷2016届江西省吉安一中高三上学期期中测试化学试卷2016届广东省潮州市朝安区凤凰中学高三上学期期中化学试卷(已下线)练习15分子的结构与物质的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)
2014·黑龙江·一模
4 . 制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20 ℃/g)如下表,请依据表中数据解释下列问题:
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3- 、NH4+ 、Ca2+、Mg2+,流程示意如下:
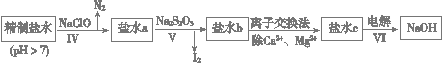
① 过程Ⅳ除去的离子有______、_______。
② 盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③ 过程VI中,产品NaOH在电解槽的__________区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20 ℃/g)如下表,请依据表中数据解释下列问题:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3- 、NH4+ 、Ca2+、Mg2+,流程示意如下:

① 过程Ⅳ除去的离子有______、_______。
② 盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③ 过程VI中,产品NaOH在电解槽的__________区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
您最近一年使用:0次
2014·河北唐山·一模
名校
5 . 根据表中信息判断,下列选项正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4,H2O2,H2SO4 | K2SO4、MnSO4……… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-………… | Cl2、Mn2+ |
| A.第①组反应的其余产物为H2O |
| B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1 : 2 |
| C.第③组反应中生成1 mol Cl2,转移电子5 mol |
| D.氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2 |
您最近一年使用:0次
2014-04-02更新
|
1191次组卷
|
7卷引用:【全国百强校】甘肃省兰州市第一中学2019届高三上学期12月月考化学试题
10-11高三·甘肃天水·阶段练习
6 . 按要求写出下列反应的化学方程式;
①将硫酸氢钠与氢氧化钡在溶液中按物质的量之比2︰1混合,则离子方程式:___________________________________ 。
②将硫酸氢钠与氢氧化钡在溶液中按物质的量之比1︰1混合,则化学方程式:____________________________________
③实验室用金属铜和浓硝酸制取二氧化氮的化学方程式:___________ .
④氨的催化氧化:______________________________________ .
①将硫酸氢钠与氢氧化钡在溶液中按物质的量之比2︰1混合,则离子方程式:
②将硫酸氢钠与氢氧化钡在溶液中按物质的量之比1︰1混合,则化学方程式:
③实验室用金属铜和浓硝酸制取二氧化氮的化学方程式:
④氨的催化氧化:
您最近一年使用:0次
11-12高三上·甘肃天水·阶段练习
7 . 测我国了“神舟”系列载人飞船的成功发射,标志着“炎黄子孙千年飞天梦想实现了”
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是_____ (填写编号)。
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:
N2O4+ N2H4→ N2+ H2O 。请配平该反应方程式:
————N2O4+————N2H4→————N2+————H2O
这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是_______ 。
(3)为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。
①写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似):____________________ ;_________________________ 。
②你选择的供氧剂是:_______________ 。
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是
| A.在高温下不融化 | B.在高温下可分解气化 |
| C.在常温下就分解气化 | D.该涂料不可能发生分解 |
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:
N2O4+ N2H4→ N2+ H2O 。请配平该反应方程式:
————N2O4+————N2H4→————N2+————H2O
这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是
(3)为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。
①写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似):
②你选择的供氧剂是:
您最近一年使用:0次



