名校
解题方法
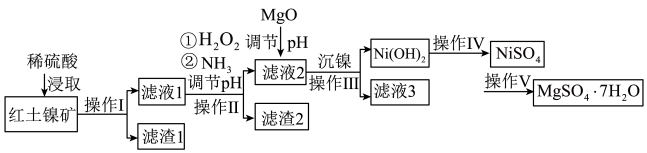
1 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;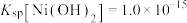 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“浸取”时需将矿样研磨的目的是______ ,“滤渣1”的成分______ (填化学式)。
(2)“滤液1”中加入 的作用是
的作用是______ (用离子反应方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是______ 。
(4)“滤液1”中是否存在 ,可用
,可用______ 检验。
(5)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为______  。
。
(6)操作V是______ 、过滤、洗涤。
(7) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为______ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;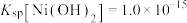 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全( | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“浸取”时需将矿样研磨的目的是
(2)“滤液1”中加入
 的作用是
的作用是(3)操作II为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(4)“滤液1”中是否存在
 ,可用
,可用(5)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(6)操作V是
(7)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
2023-02-10更新
|
1019次组卷
|
7卷引用:湖南省株洲市炎陵县2023-2024学年高二下学期开学化学试题
名校
解题方法
2 . 工业上利用软锰矿(主要成分为MnO2,还含Fe、Al、Mg、Zn、Ca、Si等元素)与纤维素制备Mn3O4,工艺如下图所示。

(1)利用纤维素“酸浸"相较于FeS2酸浸法,除了原料来源丰富、耗能低,还具有的优点是___________ (回答两点)。
(2)“酸浸”时,由纤维素水解得到的葡萄糖与软锰矿反应。完成葡萄糖与软锰矿反应的离子方程式:___________
____C6H12O6+____MnO2+____=____Mn2++____CO2↑+____
(3)“中和”时,相关离子形成氢氧化物沉淀的pH范围如下:
“中和”步骤要调节溶液pH,最适宜的pH范围是___________ 。
(4)“净化”时,加入Na2S、NH4F是为了将Zn2+、Mg2+转化为ZnS和MgF2沉淀除去,还能除去___________ (填元素符号)。
(5)“沉锰”时,主要生成Mn2(OH)2SO4和Mn(OH)2沉淀,其中生成Mn(OH)2的离子方程式为___________ 。
(6)“氧化”时,氧化时间对产品中的锰含量及溶液pH的影响如下图。最佳的氧化时间为___________ min;下列说法错误的是___________ 。

A.前15min,主要发生的反应是6Mn(OH)2+O2=2Mn3O4+6H2O,pH下降较慢
B.15~150min,主要发生的反应是3Mn2(OH)2SO4+O2=2Mn3O4+6H++3SO ,pH下降较快
,pH下降较快
C.150min之后,pH趋于稳定,则Mn2(OH)2SO4已完全氧化
D.250min后,继续通入空气,可能将产品氧化生成Mn2O3及MnO2,使产品中的锰含量下降

(1)利用纤维素“酸浸"相较于FeS2酸浸法,除了原料来源丰富、耗能低,还具有的优点是
(2)“酸浸”时,由纤维素水解得到的葡萄糖与软锰矿反应。完成葡萄糖与软锰矿反应的离子方程式:
____C6H12O6+____MnO2+____=____Mn2++____CO2↑+____
(3)“中和”时,相关离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Al3+ | Mg2+ | Zn2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 3.0 | 8.9 | 6.0 | 8.1 |
| 完全沉淀的pH | 2.8 | 4.7 | 10.9 | 8.0 | 10.1 |
(4)“净化”时,加入Na2S、NH4F是为了将Zn2+、Mg2+转化为ZnS和MgF2沉淀除去,还能除去
(5)“沉锰”时,主要生成Mn2(OH)2SO4和Mn(OH)2沉淀,其中生成Mn(OH)2的离子方程式为
(6)“氧化”时,氧化时间对产品中的锰含量及溶液pH的影响如下图。最佳的氧化时间为

A.前15min,主要发生的反应是6Mn(OH)2+O2=2Mn3O4+6H2O,pH下降较慢
B.15~150min,主要发生的反应是3Mn2(OH)2SO4+O2=2Mn3O4+6H++3SO
 ,pH下降较快
,pH下降较快C.150min之后,pH趋于稳定,则Mn2(OH)2SO4已完全氧化
D.250min后,继续通入空气,可能将产品氧化生成Mn2O3及MnO2,使产品中的锰含量下降
您最近一年使用:0次





 )时的pH
)时的pH

