名校
1 . “纳米零价铁-H2O2”体系可将烟气中难溶的NO氧化为可溶的 。
。
(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为___________ ,该反应的还原产物是___________ (写化学式)。
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +___________ + Fe = Fe3+ +  + 4H2O
+ 4H2O
①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是___________ 。
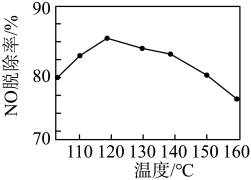
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是___________ 。___________ (填化学式),写出该物质的一种用途___________ 。
 。
。(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +
 + 4H2O
+ 4H2O①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是
您最近一年使用:0次
名校
2 . I.神舟十七号载人航天飞船于2023年10月26日成功发射,飞船搭载的是中国研制的长征二号F遥十七运载火箭,采用四氧化二氮(N2O4)和偏二甲肼(C2H8N2)作为推进剂,二者反应生成二氧化碳、水蒸气和氮气。
(1)偏二甲肼的摩尔质量为___________ 。
(2)四氧化二氮能与水反应生成亚硝酸和___________ (写化学式)。
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是___________ 。
(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为___________ 。
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是___________ 。
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为___________ 。
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为___________ 。
(1)偏二甲肼的摩尔质量为
(2)四氧化二氮能与水反应生成亚硝酸和
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2
 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为
您最近一年使用:0次
3 . 按要求完成以下填空:
(1)现有下列10种物质:①稀盐酸,②纯醋酸,③干冰,④H2SO4,⑤AgCl,⑥熔融硝酸钠,⑦液态氯化氢,⑧Ba(OH)2,⑨Al2O3,⑩C2H5OH
上述物质中能导电的是___________ (填序号),属于非电解质的有 ___________ (填序号),利用以上物质写出与离子方程式“H++OH- =H2O”相对应的一个化学方程式:___________ 。
(2)为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应2NO+2CO N2+2CO2。
N2+2CO2。
①用双线桥标出电子转移的方向和数目___________ (注明得失)。
②当消耗3g的NO时得到氧化产物的质量为___________ ,转移的电子的物质的量是 ___________ 。
(3)下列所列举的是3张在一定温度下物质的导电能力(σ)随新物质加入量(V)的变化曲线图,向饱和食盐水中不断通入二氧化碳相符的变化曲线图是___________ (填字母)。
A.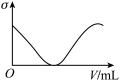 B.
B.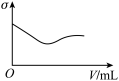 C.
C.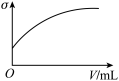
(1)现有下列10种物质:①稀盐酸,②纯醋酸,③干冰,④H2SO4,⑤AgCl,⑥熔融硝酸钠,⑦液态氯化氢,⑧Ba(OH)2,⑨Al2O3,⑩C2H5OH
上述物质中能导电的是
(2)为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应2NO+2CO
 N2+2CO2。
N2+2CO2。①用双线桥标出电子转移的方向和数目
②当消耗3g的NO时得到氧化产物的质量为
(3)下列所列举的是3张在一定温度下物质的导电能力(σ)随新物质加入量(V)的变化曲线图,向饱和食盐水中不断通入二氧化碳相符的变化曲线图是
A.
 B.
B. C.
C.
您最近一年使用:0次
4 . 生活中离不开化学,家庭厨卫中有许多中学化学常见的物质,括号内为厨卫商品的主要成分:
①食盐(NaCl);②料酒(乙醇);③食醋(乙酸);④碱面( );⑤小苏打(
);⑤小苏打( );⑥84消毒液(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)
);⑥84消毒液(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)
回答下列问题:
(1)明矾的化学式为 ,属于
,属于______ (填“纯净物”或“混合物”)。
(2)小苏打的主要成分 ,在水溶液的电离方程式:
,在水溶液的电离方程式:______ 。
(3)厨卫用品的主要成分(括号内的物质)是电解质的有______ (填序号,下同),是非电解质的有______ ,能够导电的有______ 。
(4)⑥和⑦不能混用,原理为______ (用化学反应方程式表示)。
(5)已知 和碱反应生成
和碱反应生成 ,故
,故 为酸性氧化物,
为酸性氧化物, 与酸反应生成
与酸反应生成 ,故
,故 为碱性氧化物.
为碱性氧化物. 可以形成两种盐:
可以形成两种盐: 、
、 (微溶物),则
(微溶物),则 属于
属于______ 氧化物(填“酸性”或“碱性”、“两性”、“不成盐”).写出 与浓NaOH溶液反应的化学反应方程式:
与浓NaOH溶液反应的化学反应方程式:______ 。
①食盐(NaCl);②料酒(乙醇);③食醋(乙酸);④碱面(
 );⑤小苏打(
);⑤小苏打( );⑥84消毒液(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)
);⑥84消毒液(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)回答下列问题:
(1)明矾的化学式为
 ,属于
,属于(2)小苏打的主要成分
 ,在水溶液的电离方程式:
,在水溶液的电离方程式:(3)厨卫用品的主要成分(括号内的物质)是电解质的有
(4)⑥和⑦不能混用,原理为
(5)已知
 和碱反应生成
和碱反应生成 ,故
,故 为酸性氧化物,
为酸性氧化物, 与酸反应生成
与酸反应生成 ,故
,故 为碱性氧化物.
为碱性氧化物. 可以形成两种盐:
可以形成两种盐: 、
、 (微溶物),则
(微溶物),则 属于
属于 与浓NaOH溶液反应的化学反应方程式:
与浓NaOH溶液反应的化学反应方程式:
您最近一年使用:0次
5 . 回答下列问题:
(1)下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2
三种物质依次是(填化学式):①_______ ;②_______ ;③_______ 。
(2)HCO 与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO
与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO 与OH-在溶液不能大量共存的原因:
与OH-在溶液不能大量共存的原因:_______ 。
(3)离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO 的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。
的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。
(4)等质量的O2和O3所含氧原子个数之比_______ 。
(5)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为_______ 。
(6)标况下, 16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体含有_______ 个C原子。
(7)请配平下面方程式:_______ 。
_______KMnO4 +_______HCl —_______KCl +_______MnCl2 +_______Cl2↑ + _______H2O
(8)用双线桥法表示反应8NH3+3Cl2=6NH4Cl+N2的电子转:_______ 。
(1)下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2
三种物质依次是(填化学式):①
(2)HCO
 与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO
与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO 与OH-在溶液不能大量共存的原因:
与OH-在溶液不能大量共存的原因:(3)离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO
 的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。
的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。A.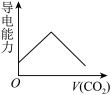 | B.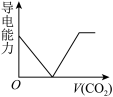 | C. | D.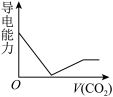 |
(4)等质量的O2和O3所含氧原子个数之比
(5)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为
(6)标况下, 16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体含有
(7)请配平下面方程式:
_______KMnO4 +_______HCl —_______KCl +_______MnCl2 +_______Cl2↑ + _______H2O
(8)用双线桥法表示反应8NH3+3Cl2=6NH4Cl+N2的电子转:
您最近一年使用:0次
名校
解题方法
6 . 钠是一种非常活泼、具有广泛应用的金属。
(1)钠的原子结构示意图为___________ ,钠在反应中容易___________ 电子(填“得到”或“失去”)。
(2)汽车安全气囊的气体发生剂 可由金属钠生产。某汽车安全气囊内含
可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。
ⅰ.当汽车发生较严重的碰撞时,引发 分解
分解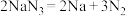 ,从而为气囊充气。产生的Na立即与
,从而为气囊充气。产生的Na立即与 发生置换反应生成
发生置换反应生成 ,化学方程式是
,化学方程式是___________ 。
ⅱ. 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为
起冷却作用时发生反应的化学方程式为___________ 。
ⅲ.一个安全气囊通常装有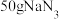 ,其完全分解所释放的
,其完全分解所释放的 为
为___________ mol。(保留两位小数)
(3)工业通过电解NaCl生产金属钠: ,过程如下:
,过程如下:
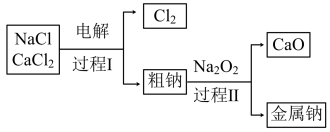
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入 从而把熔点降至约580℃。
从而把熔点降至约580℃。
①把NaCl固体加热至熔融状态,目的是___________ 。
②粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是___________ 。
(1)钠的原子结构示意图为
(2)汽车安全气囊的气体发生剂
 可由金属钠生产。某汽车安全气囊内含
可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。ⅰ.当汽车发生较严重的碰撞时,引发
 分解
分解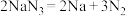 ,从而为气囊充气。产生的Na立即与
,从而为气囊充气。产生的Na立即与 发生置换反应生成
发生置换反应生成 ,化学方程式是
,化学方程式是ⅱ.
 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为
起冷却作用时发生反应的化学方程式为ⅲ.一个安全气囊通常装有
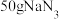 ,其完全分解所释放的
,其完全分解所释放的 为
为(3)工业通过电解NaCl生产金属钠:
 ,过程如下:
,过程如下:
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入
 从而把熔点降至约580℃。
从而把熔点降至约580℃。①把NaCl固体加热至熔融状态,目的是
②粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是
您最近一年使用:0次
7 . 废旧锂离子电池的回收利用意义重大,其正极废料的主要成分是 、铝、炭黑及其他微量杂质,回收利用的流程如下:
、铝、炭黑及其他微量杂质,回收利用的流程如下:
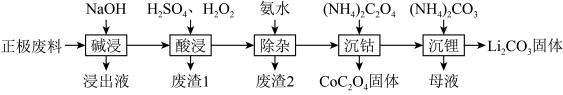
(1)“碱浸”步骤中铝溶解的离子方程式为________ ,“废渣1”的主要成分是_______ 。
(2)已知Li在化合物中显 价,
价, 中Co的化合价为
中Co的化合价为_____ ,“酸浸”步骤中 固体溶解的化学方程式为
固体溶解的化学方程式为_______ ,反应中 的作用为
的作用为_______ 。
(3)“酸浸”后的溶液中含有少量 、
、 、
、 ,滤渣2的主要成分是
,滤渣2的主要成分是______ 。
(4)沉钴过程发生的反应属于______ (填反应类型)。
(5)“母液”中的溶质成分是_______ ,生成 固体的离子方程式为
固体的离子方程式为________ 。
 、铝、炭黑及其他微量杂质,回收利用的流程如下:
、铝、炭黑及其他微量杂质,回收利用的流程如下:
(1)“碱浸”步骤中铝溶解的离子方程式为
(2)已知Li在化合物中显
 价,
价, 中Co的化合价为
中Co的化合价为 固体溶解的化学方程式为
固体溶解的化学方程式为 的作用为
的作用为(3)“酸浸”后的溶液中含有少量
 、
、 、
、 ,滤渣2的主要成分是
,滤渣2的主要成分是(4)沉钴过程发生的反应属于
(5)“母液”中的溶质成分是
 固体的离子方程式为
固体的离子方程式为
您最近一年使用:0次
名校
8 . 钠和铁都是重要的金属元素,被广泛应用于冶金、建筑等领域,有着重要的工业利用价值。
I.物质类别和核心元素的价态是学习元素及其化合物性质的两个重要视角。下图是钠及其化合物 的“价−类”二维图。
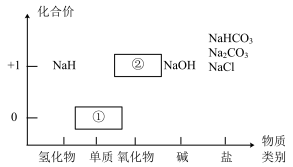
请回答下列问题:
(1)写出NaHCO3在水中电离的离子方程式________ 。
(2)银白色固体①应保存在______ 中;①可直接转化为淡黄色固体②,写出该反应的化学方程式_______ 。
(3)氢化钠(NaH)是一种储氢材料,室温下能结合CO2制氢:4NaH+3CO2=2Na2CO3+C+2H2。
①该反应中氧化产物和还原产物的物质的量之比为__________ 。
②由氢元素价态可知,NaH常用作_______ (填“氧化剂”或“还原剂”)。
II.绿矾(七水合硫酸亚铁,FeSO4·7H2O)能够用于处理工业废水中具有强氧化性的离子重铬酸根(Cr2O72−),反应原理为: Fe2++ Cr2O72−+ H+ = Fe3++ Cr3++ H2O
(4)填写空格,完成该反应方程式的配平________ 。
(5)该反应中______ 元素被氧化,还原产物是________ 。
I.物质类别和核心元素的价态是学习元素及其化合物性质的两个重要视角。下图是

请回答下列问题:
(1)写出NaHCO3在水中电离的离子方程式
(2)银白色固体①应保存在
(3)氢化钠(NaH)是一种储氢材料,室温下能结合CO2制氢:4NaH+3CO2=2Na2CO3+C+2H2。
①该反应中氧化产物和还原产物的物质的量之比为
②由氢元素价态可知,NaH常用作
II.绿矾(七水合硫酸亚铁,FeSO4·7H2O)能够用于处理工业废水中具有强氧化性的离子重铬酸根(Cr2O72−),反应原理为: Fe2++ Cr2O72−+ H+ = Fe3++ Cr3++ H2O
(4)填写空格,完成该反应方程式的配平
(5)该反应中
您最近一年使用:0次
9 . Ⅰ.某化学兴趣小组的同学学了金属的电化学腐蚀,对教材叙述[钢铁在酸性环境中发生析氢腐蚀;在酸性很弱或呈中性,溶有 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
(1)用图1所示装置进行实验:打开a________ (填仪器名称)的活塞,加入1mL溶液,测得压强随时间变化曲线如图2。
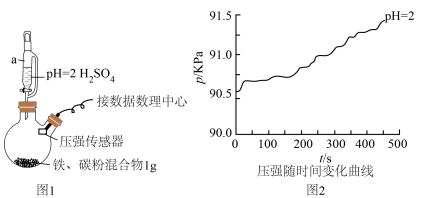
同学甲得出结论:酸性条件下,铁粉发生析氢腐蚀。
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是___________ ,提出改进措施___________ 。改进后,再次实验,证明甲、乙的猜想均正确,请在图2绘制出改进后的曲线___________ 。
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是___________ 。
(4)对于图3中 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。
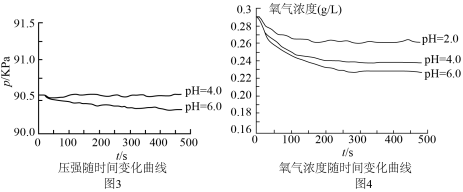
结合实验分析: 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为___________ 。
综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
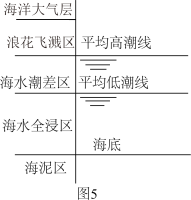
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因___________ 。
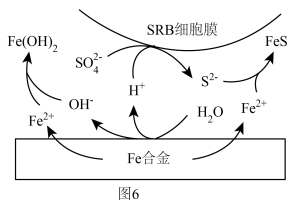
(6)科学家还发现在 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应___________ (离子方程式)。
(7)请列举出生产生活中金属制品的防腐措施___________ (任写一点即可)。
 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。(1)用图1所示装置进行实验:打开a

同学甲得出结论:酸性条件下,铁粉发生析氢腐蚀。
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用
 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是(4)对于图3中
 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。
结合实验分析:
 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因

(6)科学家还发现在
 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应
(7)请列举出生产生活中金属制品的防腐措施
您最近一年使用:0次
2024-01-05更新
|
937次组卷
|
2卷引用:2024届广东东莞中学、广州二中、惠州一中、深圳实验、珠海一中、中山纪念中学六校高三上学期第三次联考化学
名校
10 . 按要求回答下列问题:
(1)已知Na2O2可用于呼吸面具供氧,请用化学方程式解释:___________ 。
(2)已知制备Fe(OH)2时,白色沉淀会迅速变为灰绿色,最终变为红褐色,请用化学方程式解释这一变化结果:___________ 。
(3)家庭中常用消毒液(主要成分NaClO、NaCl)与洁厕灵(主要成分盐酸)清洁卫生。两者同时使用容易产生氯气引起中毒,写出反应的离子方程式___________ 。
(4)已知燃煤烟气的主要成分为N2、CO、SO2,如图装置可以测SO2的体积分数,已知A的目的是观察气流速度,则B中发生反应的离子方程式:___________ 。

(5)已知亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,通过下面实验过程可以得到该产品,写出反应②的离子方程式:___________ 。

(1)已知Na2O2可用于呼吸面具供氧,请用化学方程式解释:
(2)已知制备Fe(OH)2时,白色沉淀会迅速变为灰绿色,最终变为红褐色,请用化学方程式解释这一变化结果:
(3)家庭中常用消毒液(主要成分NaClO、NaCl)与洁厕灵(主要成分盐酸)清洁卫生。两者同时使用容易产生氯气引起中毒,写出反应的离子方程式
(4)已知燃煤烟气的主要成分为N2、CO、SO2,如图装置可以测SO2的体积分数,已知A的目的是观察气流速度,则B中发生反应的离子方程式:

(5)已知亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,通过下面实验过程可以得到该产品,写出反应②的离子方程式:

您最近一年使用:0次



