名校
1 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: 。
。
上述两种方法中,方法2比方法1更好,其原因是_______ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为_______ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为_______ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为_______ g。
(4) 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知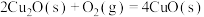
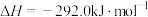 ;则
;则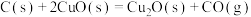 的
的
_______  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验ⅰ中气体减少的原因是_______ 。
②实验ⅰ中,推测产生 ,可能发生的反应有
,可能发生的反应有 、
、_______ 。
③随着阴极析出 ,实验ⅱ中
,实验ⅱ中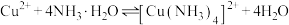 平衡不移动,理由是
平衡不移动,理由是_______ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为(4)
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知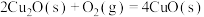
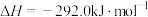 ;则
;则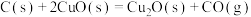 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| 1 | 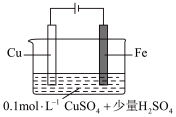 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| 2 | 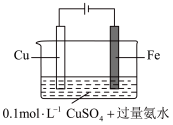 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 元素 元素 |
②实验ⅰ中,推测产生
 ,可能发生的反应有
,可能发生的反应有 、
、③随着阴极析出
 ,实验ⅱ中
,实验ⅱ中 平衡不移动,理由是
平衡不移动,理由是
您最近一年使用:0次
2024-01-01更新
|
214次组卷
|
2卷引用:河南省部分名校2023-2024学年高三上学期11月期中化学试题
名校
2 . 镍铼高温合金可用于制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴。NH4ReO4是制备高纯度Re的原料。实验室制备NH4ReO4的装置如图所示。
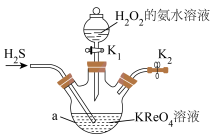
已知: Ⅰ.KReO4、与H2S反应生成Re2Sn7;
Ⅱ.2NH4ReO4+7H2=2Re+ 2NH3 + 8H2O。
有关物质的溶解度S见下表:
回答下列问题:
(1)金属铼具有良好的导电、导热性和延展性,可用于解释这--现象的理论是_______________ 。
(2)仪器a的名称是__________ 。
(3)反应开始前先向仪器a中加入一定量的KReO4溶液,再通入一定量的H2S,反应一段时间,仪器a内生成Re2S7,然后滴入足量的H2O2的氨水溶液,生成NH4ReO4,同时有硫酸铵生成;写出生成NH4ReO4的化学方程式:_____ ,反应结束后从溶液中分离出NH4ReO4的方法是_______ 。
(4)氢气还原NH4ReO4制备金属铼时,在加热前,需先通入一段时间的氢气,其目的是_____ 。实验室制取氢气时,常用粗锌粒而不用纯锌,其原因是___ 。

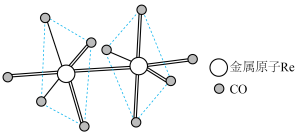
(5)铼可形成多种配位化合物, Re2 (CO)10就是其中的一种,其结构如图,其中配位原子为_______ (填“C"或“O")。

已知: Ⅰ.KReO4、与H2S反应生成Re2Sn7;
Ⅱ.2NH4ReO4+7H2=2Re+ 2NH3 + 8H2O。
有关物质的溶解度S见下表:
| 温度/℃ | S[(NH4)2SO4]/g | S[NH4ReO4]/g |
| 20 | 75.4 | 6.1 |
| 30 | 78.0 | 32.3 |
(1)金属铼具有良好的导电、导热性和延展性,可用于解释这--现象的理论是
(2)仪器a的名称是
(3)反应开始前先向仪器a中加入一定量的KReO4溶液,再通入一定量的H2S,反应一段时间,仪器a内生成Re2S7,然后滴入足量的H2O2的氨水溶液,生成NH4ReO4,同时有硫酸铵生成;写出生成NH4ReO4的化学方程式:
(4)氢气还原NH4ReO4制备金属铼时,在加热前,需先通入一段时间的氢气,其目的是

(5)铼可形成多种配位化合物, Re2 (CO)10就是其中的一种,其结构如图,其中配位原子为

您最近一年使用:0次
2023-08-20更新
|
158次组卷
|
2卷引用:辽宁省朝阳地区2023-2024学年高三上学期期中考试化学试题
解题方法
3 . 化学实验是科学研究中的重要方法。
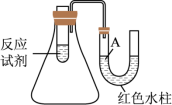
(1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将铝片加入小试管内,然后注入足量的盐酸,U形导管中液面A_______ (填“上升”或“下降”),说明此反应是_______ (填“放热”或“吸热”)反应。
(2)用A、B、C、D四种金属按如表所示的装置进行实验。
根据实验现象回答下列问题:
①装置乙中正极的电极反应式为_______ 。
②四种金属的活动性由强到弱的顺序是_______ 。
(3)化学兴趣小组同学查阅资料:制取氮气用的亚硝酸钠外观与食盐相似,毒性较强。可以用如图装置(略去部分夹持仪器)制备。
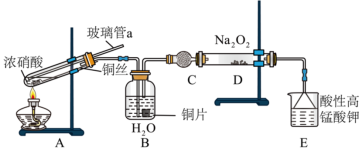
已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO 反应生成NO
反应生成NO 和Mn2+。
和Mn2+。
①E中倒置的漏斗的作用为_______ 。
②实验结束后还可以通入空气把残存气体排入后面装置吸收,防止污染大气。NO在E中发生反应的离子方程式为_______ 。
(1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将铝片加入小试管内,然后注入足量的盐酸,U形导管中液面A

(2)用A、B、C、D四种金属按如表所示的装置进行实验。
| 装置 |  甲 |  乙 |  丙 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置乙中正极的电极反应式为
②四种金属的活动性由强到弱的顺序是
(3)化学兴趣小组同学查阅资料:制取氮气用的亚硝酸钠外观与食盐相似,毒性较强。可以用如图装置(略去部分夹持仪器)制备。

已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO
 反应生成NO
反应生成NO 和Mn2+。
和Mn2+。①E中倒置的漏斗的作用为
②实验结束后还可以通入空气把残存气体排入后面装置吸收,防止污染大气。NO在E中发生反应的离子方程式为
您最近一年使用:0次
4 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: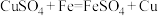 。
。
上述两种方法中,方法2比方法1更好,其原因是___________ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为___________ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为___________ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到
溶液恰好使混合物完全溶解,同时收集到 (标准状况)
(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为___________  。
。
(4) 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知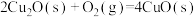
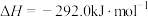 ;则
;则 的
的
___________  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验i中气体减少的原因是___________ 。
②实验i中,推测产生 ,可能发生的反应有
,可能发生的反应有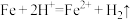 、
、___________ 。
③随着阴极析出 ,实验ii中
,实验ii中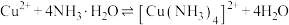 平衡
平衡___________ (填“向左”“向右”或“不”)移动,理由是___________ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
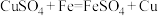 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到
溶液恰好使混合物完全溶解,同时收集到 (标准状况)
(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为 。
。(4)
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知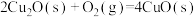
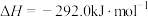 ;则
;则 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| i |  | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| ii |  | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素 |
②实验i中,推测产生
 ,可能发生的反应有
,可能发生的反应有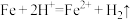 、
、③随着阴极析出
 ,实验ii中
,实验ii中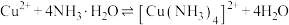 平衡
平衡
您最近一年使用:0次
2024-01-02更新
|
132次组卷
|
2卷引用:江西省部分地区2023-2024学年高三上学期11月期中化学试题
5 . 化学工业为疫情防控提供了强有力的物质支撑。次氯酸溶液是常用的消毒剂,可利用Cl2O与水反应得到。根据该原理,某化学兴趣小组利用如下装置制备一定浓度的次氯酸溶液。已知:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解为Cl2和O2。实验时,将氯气和空气(不参与反应)按体积比为1:3混合通入含水8%的碳酸钠糊状物中,请回答下列问题:
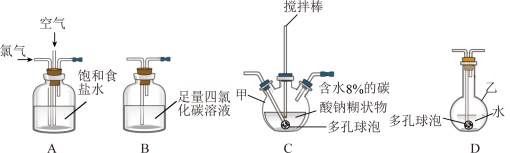
(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为_______ 。
(2)装置C中的仪器甲的名称为_______ ,仪器甲中发生反应的化学方程式为_______ ,为了提高 的产率,需控制反应在合适的温度,可采取的操作为
的产率,需控制反应在合适的温度,可采取的操作为_______ 。
(3)装置 的作用为
的作用为_______ ,有同学建议将装置 中的仪器乙换为棕色瓶,原因是
中的仪器乙换为棕色瓶,原因是_______ 。
(4)测定装置D中得到的次氯酸的物质的量浓度。量取 装置D中得到的次氯酸溶液,并稀释至
装置D中得到的次氯酸溶液,并稀释至 ,再从中取出
,再从中取出 至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用
至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (滴定反应为
(滴定反应为 )。
)。
①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为_______ 。
②达到滴定终点的现象为_______ 。
③装置D中得到的次氯酸的物质的量浓度为_______ mol/L。
④若滴定开始前滴定管尖嘴有气泡,滴定结束后气泡消失,则测定的次氯酸的物质的量浓度将_______ (填“偏低”、“偏高”或“无影响”)。

(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为
(2)装置C中的仪器甲的名称为
 的产率,需控制反应在合适的温度,可采取的操作为
的产率,需控制反应在合适的温度,可采取的操作为(3)装置
 的作用为
的作用为 中的仪器乙换为棕色瓶,原因是
中的仪器乙换为棕色瓶,原因是(4)测定装置D中得到的次氯酸的物质的量浓度。量取
 装置D中得到的次氯酸溶液,并稀释至
装置D中得到的次氯酸溶液,并稀释至 ,再从中取出
,再从中取出 至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用
至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (滴定反应为
(滴定反应为 )。
)。①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为
②达到滴定终点的现象为
③装置D中得到的次氯酸的物质的量浓度为
④若滴定开始前滴定管尖嘴有气泡,滴定结束后气泡消失,则测定的次氯酸的物质的量浓度将
您最近一年使用:0次
名校
6 . 工业上,利用黄铁矿(主要成分是 )制备硫酸以及冶炼铁,其简易流程如下:
)制备硫酸以及冶炼铁,其简易流程如下:
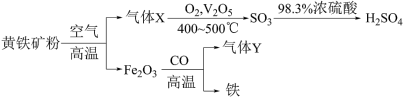
请回答下列问题:
(1)气体Y的相对分子质量为44,气体Y的电子式为_______ 。
(2)气体X转化成 的反应是放热反应,则参与反应的气体X和
的反应是放热反应,则参与反应的气体X和 的总能量
的总能量_______ (填“高于”“低于”或“等于”)生成的 的总能量。用
的总能量。用 的浓硫酸吸收
的浓硫酸吸收 ,避免直接与水反应形成大量酸雾,污染环境,反应的能量变化如图所示。由此可知:
,避免直接与水反应形成大量酸雾,污染环境,反应的能量变化如图所示。由此可知: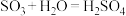 是
是_______ (填“放热”或“吸热”)反应。

(3)配平下列方程式并推断X的化学式:_______ ,_______ _______
_______ _______
_______ _______X。X的化学式是
_______X。X的化学式是_______ 。
(4)向 溶液中通入气体X,没有明显现象,再通入
溶液中通入气体X,没有明显现象,再通入 ,产生白色沉淀,该白色沉淀是
,产生白色沉淀,该白色沉淀是_______ (填化学式)。
(5)铁片和铜片在稀硫酸中构成原电池,装置如图所示。可观察到正极表面上实验现象有_______ 。写出负极的电极反应式:_______ 。

(6)在 时,向
时,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 发生反应:
发生反应: ,经过
,经过 达到平衡,测得生成
达到平衡,测得生成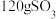 。
。
①反应开始到平衡时 的平均反应速率为
的平均反应速率为_______ 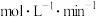 。
。
②在该条件下, 的平衡转化率为
的平衡转化率为_______ 。
 )制备硫酸以及冶炼铁,其简易流程如下:
)制备硫酸以及冶炼铁,其简易流程如下: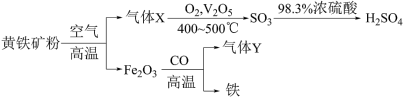
请回答下列问题:
(1)气体Y的相对分子质量为44,气体Y的电子式为
(2)气体X转化成
 的反应是放热反应,则参与反应的气体X和
的反应是放热反应,则参与反应的气体X和 的总能量
的总能量 的总能量。用
的总能量。用 的浓硫酸吸收
的浓硫酸吸收 ,避免直接与水反应形成大量酸雾,污染环境,反应的能量变化如图所示。由此可知:
,避免直接与水反应形成大量酸雾,污染环境,反应的能量变化如图所示。由此可知: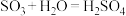 是
是
(3)配平下列方程式并推断X的化学式:
 _______
_______ _______
_______ _______X。X的化学式是
_______X。X的化学式是(4)向
 溶液中通入气体X,没有明显现象,再通入
溶液中通入气体X,没有明显现象,再通入 ,产生白色沉淀,该白色沉淀是
,产生白色沉淀,该白色沉淀是(5)铁片和铜片在稀硫酸中构成原电池,装置如图所示。可观察到正极表面上实验现象有

(6)在
 时,向
时,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 发生反应:
发生反应: ,经过
,经过 达到平衡,测得生成
达到平衡,测得生成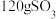 。
。①反应开始到平衡时
 的平均反应速率为
的平均反应速率为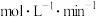 。
。②在该条件下,
 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解题方法
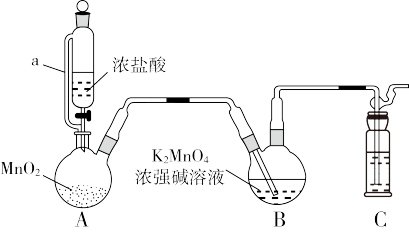
7 . 溶液常 用作氧化还原反应滴定的标准液,利用
用作氧化还原反应滴定的标准液,利用 氧化
氧化 制备
制备 的装置如图所示(加热、夹持装置略):
的装置如图所示(加热、夹持装置略):
已知: 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: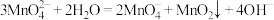
回答下列问题:
(1) 的化学名称为
的化学名称为_______ 。
(2)装置A中所发生反应的化学方程式为_______ ;其中a的作用是_______ 。
(3)装置C中盛装的试剂是_______ 。
(4)分析发现该装置有不足之处,改进的方法是_______ 。
(5)为测定某 固体的纯度,现用
固体的纯度,现用 的酸性
的酸性 溶液进行滴定。(已知:
溶液进行滴定。(已知: )称取
)称取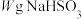 固体溶于水配成500mL溶液,取
固体溶于水配成500mL溶液,取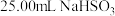 溶液置于锥形瓶中,用
溶液置于锥形瓶中,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。滴定终点的现象为
溶液V mL。滴定终点的现象为_______ , 固体的纯度为
固体的纯度为_______ 。
 用作氧化还原反应滴定的标准液,利用
用作氧化还原反应滴定的标准液,利用 氧化
氧化 制备
制备 的装置如图所示(加热、夹持装置略):
的装置如图所示(加热、夹持装置略):
已知:
 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: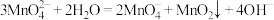
回答下列问题:
(1)
 的化学名称为
的化学名称为(2)装置A中所发生反应的化学方程式为
(3)装置C中盛装的试剂是
(4)分析发现该装置有不足之处,改进的方法是
(5)为测定某
 固体的纯度,现用
固体的纯度,现用 的酸性
的酸性 溶液进行滴定。(已知:
溶液进行滴定。(已知: )称取
)称取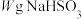 固体溶于水配成500mL溶液,取
固体溶于水配成500mL溶液,取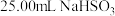 溶液置于锥形瓶中,用
溶液置于锥形瓶中,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。滴定终点的现象为
溶液V mL。滴定终点的现象为 固体的纯度为
固体的纯度为
您最近一年使用:0次
2022-11-15更新
|
168次组卷
|
2卷引用:江苏省淮安市高中校协作体2022-2023学年高三上学期期中考试化学试题
名校
解题方法
8 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
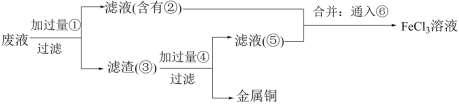
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
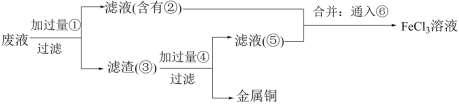
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
406次组卷
|
2卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
名校
解题方法
9 . 碘化钾( )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:
步骤Ⅰ:取含碘废液,调节溶液 为
为 ,加入一定量
,加入一定量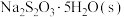 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;
步骤Ⅱ:在 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),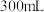 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约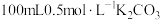 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;
步骤Ⅲ:用氢碘酸调滤液A的 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中的控温方法为___________ , 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为___________ 。
(2)步骤Ⅱ中铁粉转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)步骤Ⅲ中,仪器的名称是___________ ,现象是___________ 。
(4)产品中KI含量的测定
称取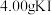 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入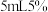 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。
①用 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是___________ ,在滴定时 溶液应盛放在
溶液应盛放在___________ (“酸式”或“碱式”)滴定管。
②样品中 的质量分数为
的质量分数为___________ 。
 )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:步骤Ⅰ:取含碘废液,调节溶液
 为
为 ,加入一定量
,加入一定量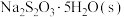 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;步骤Ⅱ:在
 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),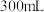 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约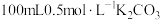 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;步骤Ⅲ:用氢碘酸调滤液A的
 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。回答下列问题:
(1)步骤Ⅰ中的控温方法为
 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为(2)步骤Ⅱ中铁粉转化为
 ,该反应的化学方程式为
,该反应的化学方程式为(3)步骤Ⅲ中,仪器的名称是
(4)产品中KI含量的测定
称取
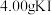 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入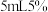 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。①用
 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是 溶液应盛放在
溶液应盛放在②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024-01-02更新
|
209次组卷
|
2卷引用:江西省部分地区2023-2024学年高三上学期11月期中化学试题
名校
解题方法
10 . (一)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
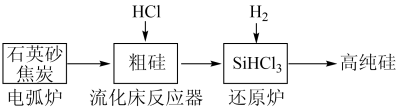
(1)工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为:___________ 。
(2)在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应为:Si+3HCl SiHCl3+H2,生成物SiHCl3的结构式为:
SiHCl3+H2,生成物SiHCl3的结构式为:___________ 。
(二)某化学兴趣小组利用下列图示装置探究氨气的性质。
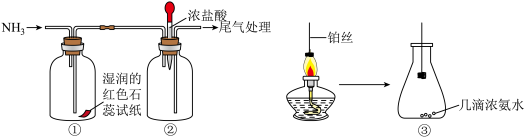
(3)①中湿润的红色石蕊试纸变蓝的原因:___________ (用化学方程式表示)。
(4)向②中滴入浓盐酸,现象为:___________ 。
(5)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧化的化学方程式:___________ ,瓶中红棕色气体为___________ (填化学式)。
(三)某氨氮废水( 、
、 )的生物法处理流程如图所示:
)的生物法处理流程如图所示:

(6)检验氨氮废水中含有 的方法是:
的方法是:___________ 。
(7)过程Ⅱ在硝化细菌作用下实现 的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为:
的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为:___________ 。

(1)工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为:
(2)在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应为:Si+3HCl
 SiHCl3+H2,生成物SiHCl3的结构式为:
SiHCl3+H2,生成物SiHCl3的结构式为:(二)某化学兴趣小组利用下列图示装置探究氨气的性质。

(3)①中湿润的红色石蕊试纸变蓝的原因:
(4)向②中滴入浓盐酸,现象为:
(5)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧化的化学方程式:
(三)某氨氮废水(
 、
、 )的生物法处理流程如图所示:
)的生物法处理流程如图所示:
(6)检验氨氮废水中含有
 的方法是:
的方法是:(7)过程Ⅱ在硝化细菌作用下实现
 的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为:
的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为:
您最近一年使用:0次



