1 . 硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。
实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是_______ 。
(2)检查装置气密性后加入药品,打开 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到_______ 时,再打开 。
。
(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是_______ ;装置D中除生成硫脲外,还生成一种碱,写出该过程D中发生反应的化学方程式:_______ 。
实验(二):探究硫脲的性质。
(4)①取少量 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加_______ ,可检验是否有 生成。
生成。
②取少量 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成_______ (填离子符号)。
③取少量 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为_______ 。
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为_______ (用含m、c、V的代数式表示)。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: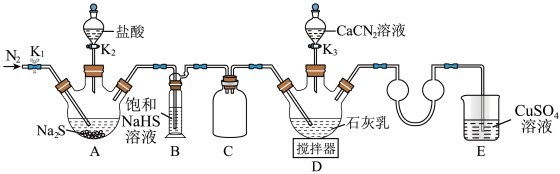
 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是
(2)检查装置气密性后加入药品,打开
 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到 。
。(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是
实验(二):探究硫脲的性质。
(4)①取少量
 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加 生成。
生成。②取少量
 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成③取少量
 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为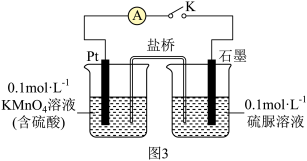
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性
 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
您最近一年使用:0次
解题方法
2 . 连二亚硫酸钠 俗称低亚硫酸钠,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。
俗称低亚硫酸钠,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。
查阅资料:连二亚硫酸钠是白色结晶粉末,极易溶于水,不溶于乙醇,加热到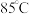 以上分解放出二氧化硫,空气中能被氧化,是一种强还原剂。
以上分解放出二氧化硫,空气中能被氧化,是一种强还原剂。
I. 的制备。
的制备。 时选用上图所示装置中的
时选用上图所示装置中的_______ (填小写字母),选用以下试剂中的_______ (填选项字母)。
A.铜粉 B. C.
C. 浓硫酸 D.
浓硫酸 D. 硫酸 E.
硫酸 E. 硫酸 F.浓盐酸 G.稀硝酸
硫酸 F.浓盐酸 G.稀硝酸
II. 的制备。
的制备。
利用如图所示实验装置(加热、搅拌及夹持装置省略)制备 ,实验步骤如下:
,实验步骤如下:
ii.持续通入 ,保持水浴温度
,保持水浴温度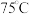 左右反应
左右反应 ;
;
iii.停止加热,冷却至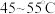 ;
;
iv.拆卸装置,将e中的混合物经过_______、洗涤后得到粗产品。
(2)步骤i先通入 的目的是
的目的是_______ 。
(3)装置e中发生的主要反应的化学方程式为_______ 。
(4)步骤iv的空白处实验操作为_______ 。洗涤粗产品的洗涤剂为_______ (填“水”或“乙醇”),进一步提纯 的方法为
的方法为_______ 。
III. 纯度的测定。
纯度的测定。
称取纯化后的产品mg溶于水,加入 溶液碱化后配成
溶液碱化后配成 待测液,量取
待测液,量取 待测液于锥形瓶中,加入
待测液于锥形瓶中,加入 滴亚甲基蓝,用
滴亚甲基蓝,用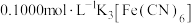 标准液进行滴定,当溶液颜色由无色变为蓝色时,达到滴定终点,进行三次平行实验消耗标准液
标准液进行滴定,当溶液颜色由无色变为蓝色时,达到滴定终点,进行三次平行实验消耗标准液 {已知滴定过程中主要转化为
{已知滴定过程中主要转化为 ,
,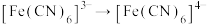 }。
}。
(5)下列情况会造成测定结果偏小的是_______(填选项字母)。
(6)产品的纯度为_______ (用含V的代数式表示)。
 俗称低亚硫酸钠,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。
俗称低亚硫酸钠,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。查阅资料:连二亚硫酸钠是白色结晶粉末,极易溶于水,不溶于乙醇,加热到
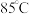 以上分解放出二氧化硫,空气中能被氧化,是一种强还原剂。
以上分解放出二氧化硫,空气中能被氧化,是一种强还原剂。I.
 的制备。
的制备。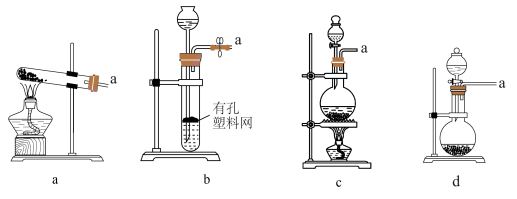
 时选用上图所示装置中的
时选用上图所示装置中的A.铜粉 B.
 C.
C. 浓硫酸 D.
浓硫酸 D. 硫酸 E.
硫酸 E. 硫酸 F.浓盐酸 G.稀硝酸
硫酸 F.浓盐酸 G.稀硝酸II.
 的制备。
的制备。利用如图所示实验装置(加热、搅拌及夹持装置省略)制备
 ,实验步骤如下:
,实验步骤如下: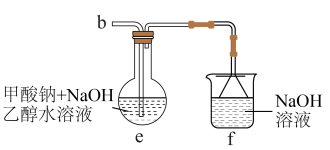
ii.持续通入
 ,保持水浴温度
,保持水浴温度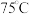 左右反应
左右反应 ;
;iii.停止加热,冷却至
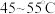 ;
;iv.拆卸装置,将e中的混合物经过_______、洗涤后得到粗产品。
(2)步骤i先通入
 的目的是
的目的是(3)装置e中发生的主要反应的化学方程式为
(4)步骤iv的空白处实验操作为
 的方法为
的方法为III.
 纯度的测定。
纯度的测定。称取纯化后的产品mg溶于水,加入
 溶液碱化后配成
溶液碱化后配成 待测液,量取
待测液,量取 待测液于锥形瓶中,加入
待测液于锥形瓶中,加入 滴亚甲基蓝,用
滴亚甲基蓝,用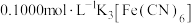 标准液进行滴定,当溶液颜色由无色变为蓝色时,达到滴定终点,进行三次平行实验消耗标准液
标准液进行滴定,当溶液颜色由无色变为蓝色时,达到滴定终点,进行三次平行实验消耗标准液 {已知滴定过程中主要转化为
{已知滴定过程中主要转化为 ,
,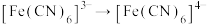 }。
}。(5)下列情况会造成测定结果偏小的是_______(填选项字母)。
| A.盛放待测液的锥形瓶内残留少量蒸馏水 |
B.未用 标准液润洗酸式滴定管 标准液润洗酸式滴定管 |
| C.若考虑空气参与上述滴定氧化还原反应 |
| D.滴定终点时俯视读数 |
(6)产品的纯度为
您最近一年使用:0次
3 . 水合肼 常用于生产火箭燃料,其沸点是
常用于生产火箭燃料,其沸点是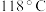 ,受热易分解。尿素法合成水合肼的基本流程如图所示。
,受热易分解。尿素法合成水合肼的基本流程如图所示。

回答下列问题:
(1) 是二元弱碱,在水中的电离方式与氨相似,写出
是二元弱碱,在水中的电离方式与氨相似,写出 第二步电离的方程式:
第二步电离的方程式:___________ 。
(2)已知次氯酸钠与盐酸混合能够生成 ,说明氧化性
,说明氧化性
___________  (填“>”或“<”)。实验发现,
(填“>”或“<”)。实验发现, 与烧碱溶液反应可以生成
与烧碱溶液反应可以生成 ,说明
,说明 与
与 的氧化性强弱关系与
的氧化性强弱关系与___________ 有关。
(3) 强碱性溶液与尿素
强碱性溶液与尿素 水溶液加热制备水合肼的离子方程式为
水溶液加热制备水合肼的离子方程式为___________ 。
(4)常通过减压蒸馏从反应后的混合溶液中获得水合肼,采用该操作的原因是___________ 。
(5)水合肼与硫酸反应生成的盐是农业上重要的杀虫剂、灭菌剂,写出水合肼与硫酸反应生成的碱式盐的化学式:___________ 。
(6)电化学方法制备 的装置如图所示。其中双极膜是阴、阳复合膜,层间的
的装置如图所示。其中双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。

①双极膜中产生的___________ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②若电路中转移2mol电子,理论上负极区溶液增重___________ g。
 常用于生产火箭燃料,其沸点是
常用于生产火箭燃料,其沸点是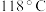 ,受热易分解。尿素法合成水合肼的基本流程如图所示。
,受热易分解。尿素法合成水合肼的基本流程如图所示。
回答下列问题:
(1)
 是二元弱碱,在水中的电离方式与氨相似,写出
是二元弱碱,在水中的电离方式与氨相似,写出 第二步电离的方程式:
第二步电离的方程式:(2)已知次氯酸钠与盐酸混合能够生成
 ,说明氧化性
,说明氧化性
 (填“>”或“<”)。实验发现,
(填“>”或“<”)。实验发现, 与烧碱溶液反应可以生成
与烧碱溶液反应可以生成 ,说明
,说明 与
与 的氧化性强弱关系与
的氧化性强弱关系与(3)
 强碱性溶液与尿素
强碱性溶液与尿素 水溶液加热制备水合肼的离子方程式为
水溶液加热制备水合肼的离子方程式为(4)常通过减压蒸馏从反应后的混合溶液中获得水合肼,采用该操作的原因是
(5)水合肼与硫酸反应生成的盐是农业上重要的杀虫剂、灭菌剂,写出水合肼与硫酸反应生成的碱式盐的化学式:
(6)电化学方法制备
 的装置如图所示。其中双极膜是阴、阳复合膜,层间的
的装置如图所示。其中双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②若电路中转移2mol电子,理论上负极区溶液增重
您最近一年使用:0次
名校
4 . 电催化还原 是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
(1)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原 的装置示意图如图-1所示。控制其他条件相同,将一定量的
的装置示意图如图-1所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
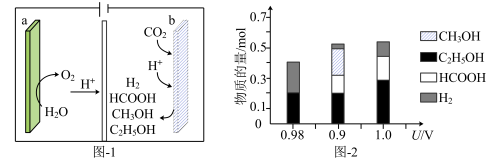
①电解前需向电解质溶液中持续通入过量 的原因是
的原因是___________ 。
②控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
③科研小组利用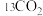 代替原有的
代替原有的 进行研究,其目的是
进行研究,其目的是___________ 。
(2)一种铜基复合电极材料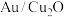 的制备方法:将一定量
的制备方法:将一定量 分散至水与乙醇的混合溶液中,向溶液中逐滴滴加
分散至水与乙醇的混合溶液中,向溶液中逐滴滴加 (一种强酸)溶液,搅拌一段时间后离心分离,得
(一种强酸)溶液,搅拌一段时间后离心分离,得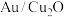 ,溶液呈蓝色。写出
,溶液呈蓝色。写出 还原
还原 的离子方程式:
的离子方程式:___________ 。
(3)金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图-3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图-4所示。
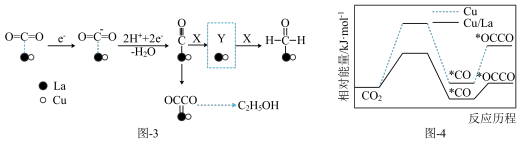
①X为___________ 。在答题卡上相应位置补充完整虚线框内Y的结构。_________
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原 的优点是
的优点是___________ 。
 是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。(1)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原
 的装置示意图如图-1所示。控制其他条件相同,将一定量的
的装置示意图如图-1所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
①电解前需向电解质溶液中持续通入过量
 的原因是
的原因是②控制电压为0.8V,电解时转移电子的物质的量为
③科研小组利用
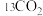 代替原有的
代替原有的 进行研究,其目的是
进行研究,其目的是(2)一种铜基复合电极材料
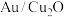 的制备方法:将一定量
的制备方法:将一定量 分散至水与乙醇的混合溶液中,向溶液中逐滴滴加
分散至水与乙醇的混合溶液中,向溶液中逐滴滴加 (一种强酸)溶液,搅拌一段时间后离心分离,得
(一种强酸)溶液,搅拌一段时间后离心分离,得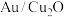 ,溶液呈蓝色。写出
,溶液呈蓝色。写出 还原
还原 的离子方程式:
的离子方程式:(3)金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图-3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图-4所示。

①X为
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原
 的优点是
的优点是
您最近一年使用:0次
2023-05-27更新
|
739次组卷
|
6卷引用:江苏省南通市2023届高三下学期第四次模拟考试化学试题
江苏省南通市2023届高三下学期第四次模拟考试化学试题江苏省盐城市伍佑中学2023届高三下学期模拟预测化学试题江苏省南京师范大学苏州实验学校2023-2024学年高三上学期零模考试热身练化学试题(已下线)考点19 电解池(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第25讲电解池与金属的电化学腐蚀四川省宜宾市叙州区第一中学校2023-2024学年高二上学期1月期末化学试题
21-22高三上·辽宁铁岭·阶段练习
解题方法
5 . 全球气候变化对全球人类社会构成重大威胁。政府气候变化专门委员会(IPCC)报告认为,为了避免极端危害,世界必须将全球变暖幅度控制在1.5℃以内。只有全球都在21世纪中叶实现温室气体净零排放,才能有可能实现这一目标。请根据二氧化碳的利用回答下列问题:
(1)CO2催化氢化制甲烷的研究过程如图1:
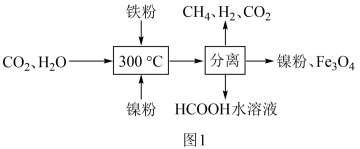
①上述过程中,加入铁粉的作用是__ 。
②HCOOH是CO2转化为CH4的中间体:CO2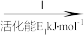 HCOOH
HCOOH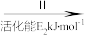 CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是__ 。
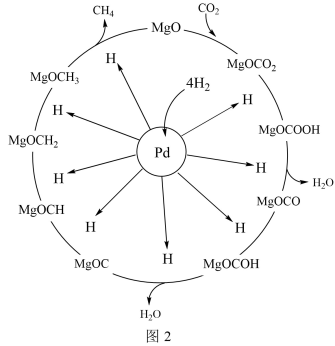
(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为__ 。
(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=__ k正。
②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强__ (填“>”“<”或“=”)T1℃时平衡压强。
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l) MDEAH+(aq)+HCO
MDEAH+(aq)+HCO (aq) △H。
(aq) △H。
①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显__ 性(填酸,碱,中)。
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g) C(g)+D(aq)的Kθ=
C(g)+D(aq)的Kθ=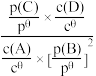 ,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=
,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=__ (计算结果保留两位小数)。
(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:
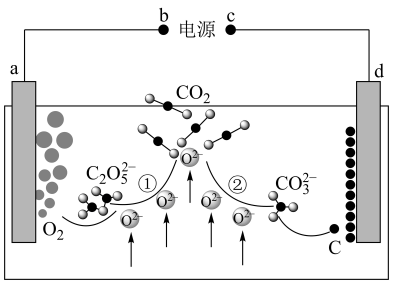
a极的电极反应式为__ 。
(1)CO2催化氢化制甲烷的研究过程如图1:

①上述过程中,加入铁粉的作用是
②HCOOH是CO2转化为CH4的中间体:CO2
 HCOOH
HCOOH CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为

(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l)
 MDEAH+(aq)+HCO
MDEAH+(aq)+HCO (aq) △H。
(aq) △H。①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g)
 C(g)+D(aq)的Kθ=
C(g)+D(aq)的Kθ=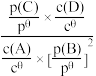 ,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=
,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:

a极的电极反应式为
您最近一年使用:0次
6 . 唐朝初年,瘟疫频发,人们把它归因于一种叫“年”的怪兽。一位叫李田的人就把硝石、硫磺和木炭装在竹筒里,点燃后驱赶怪兽。后来人们靠此驱散了山林瘴气,战胜了疫情。中国古代四大发明之一的“黑火药”是由“一硫二硝三木炭”混合而成。
(1)写出“黑火药”爆炸的化学反应方程式_______ 。
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的SO2气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是_______ (用文字表述,任写一条合理途径)。
(3)古代曾用硝土[含有 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:

①“反应”过程中的离子反应方程式为_______ 。
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和_______ ;
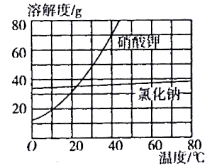
③如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液_______ 、过滤洗涤、干燥等步骤。
(4)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油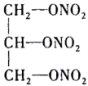 (
(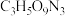 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为_______ ;
②实验室制备硝化甘油的化学方程式为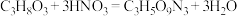 ,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
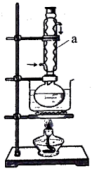
该装置中仪器a名称为_______ ,采用水浴加热而不用酒精灯直接加热的原因是_______ ,从反应后混合溶液中分离硝化甘油的简单方法是_______ 。
(1)写出“黑火药”爆炸的化学反应方程式
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的SO2气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是
(3)古代曾用硝土[含有
 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:
①“反应”过程中的离子反应方程式为
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和
③如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液

(4)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油
 (
(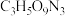 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为
②实验室制备硝化甘油的化学方程式为
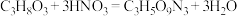 ,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
该装置中仪器a名称为
您最近一年使用:0次
22-23高一上·广东佛山·期中
名校
解题方法
7 . 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态可以对物质的性质进行解释和预测。以下为含氯物质的价类二维图,请回答下列问题:
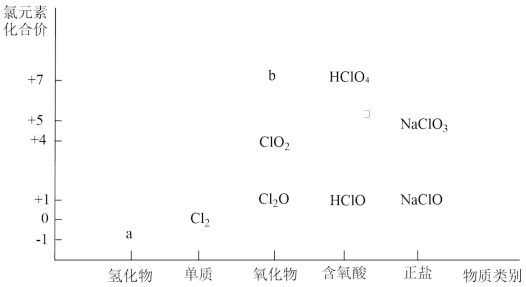
(1)a物质的化学式为_______ ,b属于_______ (填“酸性”或“碱性”)氧化物。
(2)用 消毒水时,
消毒水时, 还可将水中的
还可将水中的 转化为
转化为 ,
, 再水解生成
再水解生成 胶体,说明
胶体,说明 具有
具有_______ 性,在此水处理过程中生成的 胶体有
胶体有_______ 作用。
(3)工业上可以用反应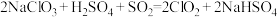 制备
制备 ,用单线桥法标出电子转移的数目和方向。
,用单线桥法标出电子转移的数目和方向。_______
(4)实验室制取氯气时,下列装置能达到相应实验目的是_______ 。
写出实验室用二氧化锰与浓盐酸反应制取氯气的离子方程式:_______ 。
(5)阅读资料,回答相关问题。
① 与
与 溶液反应的化学方程式是
溶液反应的化学方程式是_______ 。
②“84”消毒液不能与洁厕灵(含盐酸)混用,混用会产生氯气,写出反应的离子方程式:_______ 。

(1)a物质的化学式为
(2)用
 消毒水时,
消毒水时, 还可将水中的
还可将水中的 转化为
转化为 ,
, 再水解生成
再水解生成 胶体,说明
胶体,说明 具有
具有 胶体有
胶体有(3)工业上可以用反应
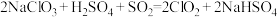 制备
制备 ,用单线桥法标出电子转移的数目和方向。
,用单线桥法标出电子转移的数目和方向。(4)实验室制取氯气时,下列装置能达到相应实验目的是
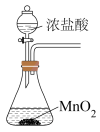 |  | 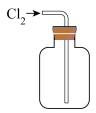 |  |
A.制备 | B.除去 中的 中的 | C.收集 | D.尾气处理 |
(5)阅读资料,回答相关问题。
资料:人们常用“84”消毒液进行消毒。“84”消毒液的名称源于北京某医院在1984年研制成功的一种高效含氯消毒液。“84”消毒液呈无色或淡黄色,可由 与 与 溶液反应制得,其主要成分为 溶液反应制得,其主要成分为 、 、 。 。 |
 与
与 溶液反应的化学方程式是
溶液反应的化学方程式是②“84”消毒液不能与洁厕灵(含盐酸)混用,混用会产生氯气,写出反应的离子方程式:
您最近一年使用:0次
8 . 氮及其化合物在工农业生产和生命活动中起着重要的作用。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一 个十年行动纲领。氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的价电子轨道表示式___________ ;基态铬、氮原子的未成对电子数之比为___________ 。
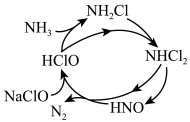
(2)NH3也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反应机理如图所示(其中H2O和NaCl 略去)。NaClO 氧化NH3的总反应化学程式为___________ 。
(3)改变 对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图所示,则除氨气过程中最佳的
对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图所示,则除氨气过程中最佳的 值约为
值约为___________ 。

(4)室温下,用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而减小的是___________。
(5)25°C时,将amol NH4NO3溶于水,向该溶液中滴加bL氨水后溶液呈中性,滴加氨水的过程中水的电离平衡将___________ (填 “正向”、“逆向”或“不”)移动。
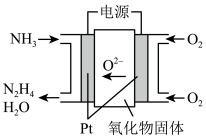
(6)工业上利用NH3制备联氨(N2H4)装置如下图,其阳极电极反应式为___________ 。
(1)“中国制造2025”是中国政府实施制造强国战略第一 个十年行动纲领。氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的价电子轨道表示式
(2)NH3也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反应机理如图所示(其中H2O和NaCl 略去)。NaClO 氧化NH3的总反应化学程式为

(3)改变
 对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图所示,则除氨气过程中最佳的
对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图所示,则除氨气过程中最佳的 值约为
值约为
(4)室温下,用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而减小的是___________。
A.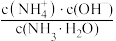 ) ) | B.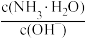 |
| C.c(H+) | D.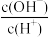 |
(6)工业上利用NH3制备联氨(N2H4)装置如下图,其阳极电极反应式为

您最近一年使用:0次
名校
解题方法
9 . 双氧水(过氧化氢的水溶液)在工业生产和日常生活中应用广泛。
(1)双氧水常用于伤口消毒,这一过程利用了过氧化氢的_________ (填过氧化氢的化学性质)。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。已知0.4 mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为__________ 。
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为________ ,写出该反应的离子方程式________ 。
(4)下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式_______ 。

(5)下图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是_______ 。
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为__________ mol。
(1)双氧水常用于伤口消毒,这一过程利用了过氧化氢的
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。已知0.4 mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为
(4)下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式

(5)下图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为
您最近一年使用:0次
2019-11-18更新
|
176次组卷
|
3卷引用:2019年吉林省长春市普通高中高三上学期质量监测(一)化学试题
17-18高三上·北京·期中
名校
解题方法
10 . 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
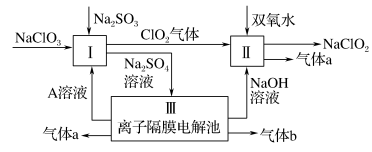
(1)Ⅰ中发生反应的还原剂是____ (填化学式)。
(2)Ⅱ中反应的离子方程式是____ 。
(3)Ⅲ中离子隔膜电解池的装置如下:
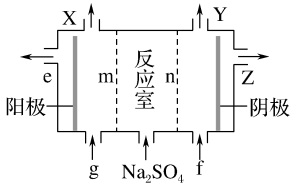
①A的化学式是________ ,A在____ 口产生。
②m为____ (填“阴”或“阳”)离子交换膜。
③结合化学用语和文字说明解释NaOH产生的原因:________
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是____ 。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是____ 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者____ (填“>”“<”或“=”)后者。

(1)Ⅰ中发生反应的还原剂是
(2)Ⅱ中反应的离子方程式是
(3)Ⅲ中离子隔膜电解池的装置如下:

①A的化学式是
②m为
③结合化学用语和文字说明解释NaOH产生的原因:
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者
您最近一年使用:0次



