名校
解题方法
1 . 钴广泛应用于机械制造、电子电器、航空航天、电池制造等行业,是国家重要的战略资源。用含钴废料(主要成分为 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题:
① 具有强氧化性。
具有强氧化性。
② ,
, 。
。
(1)为提高含钴废料的浸出效率,可采取的措施是___________ (任写一条)。
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ ;浸出渣的主要成分为___________ (填化学式)。
(3)向“浸出液”中加入适量的 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)①“除钙镁”后,滤液中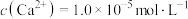 时,
时,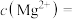
___________  。
。
②若“调pH”时溶液的pH偏低,将会导致 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是___________ 。
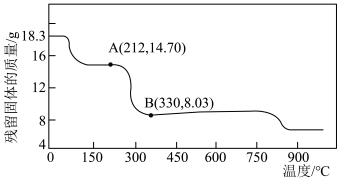
(5)将 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: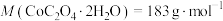 ]
] ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为___________ 。
 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题: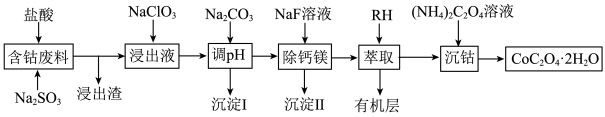
①
 具有强氧化性。
具有强氧化性。②
 ,
, 。
。(1)为提高含钴废料的浸出效率,可采取的措施是
(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)向“浸出液”中加入适量的
 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为(4)①“除钙镁”后,滤液中
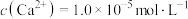 时,
时,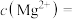
 。
。②若“调pH”时溶液的pH偏低,将会导致
 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是(5)将
 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: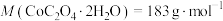 ]
]
 ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为
您最近一年使用:0次
7日内更新
|
122次组卷
|
5卷引用:2024届内蒙古自治区名校联盟高三下学期联合质量检测(三模)理科综合试题-高中化学
解题方法
2 . 硫酸四氨合铜晶体( )常用作杀虫剂、媒染剂。已知:常温下
)常用作杀虫剂、媒染剂。已知:常温下 受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程:
受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程: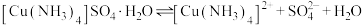 。现以废铜屑(表面沾有油污)为原料制备
。现以废铜屑(表面沾有油污)为原料制备 的实验步骤如下:
的实验步骤如下: 的制备
的制备
(1)步骤①中采取“碱煮水洗”,“碱”是指一种钠盐,其化学式是_____ 。
(2)步骤②在常温下进行,需要加入的试剂有稀 和另一种液态试剂,发生的化学反应方程式为
和另一种液态试剂,发生的化学反应方程式为_____ 。
Ⅱ.晶体的制备
将上述制备的 溶液加入装置A中,滴加
溶液加入装置A中,滴加 氨水时,有浅蓝色沉淀
氨水时,有浅蓝色沉淀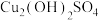 生成;继续滴加氨水,沉淀消失,得到深蓝色
生成;继续滴加氨水,沉淀消失,得到深蓝色 溶液。将A中溶液转移至B中,析出
溶液。将A中溶液转移至B中,析出 晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。_____ 。
(4)抽滤时,抽气泵处于工作状态,活塞需_____ (填“打开”或“关闭”),作用是_____ 。
(5)使用下列试剂可代替乙醇来促进 晶体析出的有
晶体析出的有_____ 。(填标号)
a.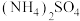 b.稀氨水 c.
b.稀氨水 c. d.
d. 溶液
溶液
(6)晶体采用冷风吹干而不用加热烘干的原因是_____ 。
Ⅲ.废液回收
减压过滤后的废液中含有 、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得
、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得 和的混合溶液。
和的混合溶液。
(7) 溶液受热易分解,则回收乙醇的实验方法为
溶液受热易分解,则回收乙醇的实验方法为_____ 。
 )常用作杀虫剂、媒染剂。已知:常温下
)常用作杀虫剂、媒染剂。已知:常温下 受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程:
受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程: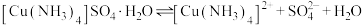 。现以废铜屑(表面沾有油污)为原料制备
。现以废铜屑(表面沾有油污)为原料制备 的实验步骤如下:
的实验步骤如下: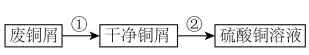
 的制备
的制备(1)步骤①中采取“碱煮水洗”,“碱”是指一种钠盐,其化学式是
(2)步骤②在常温下进行,需要加入的试剂有稀
 和另一种液态试剂,发生的化学反应方程式为
和另一种液态试剂,发生的化学反应方程式为Ⅱ.晶体的制备
将上述制备的
 溶液加入装置A中,滴加
溶液加入装置A中,滴加 氨水时,有浅蓝色沉淀
氨水时,有浅蓝色沉淀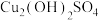 生成;继续滴加氨水,沉淀消失,得到深蓝色
生成;继续滴加氨水,沉淀消失,得到深蓝色 溶液。将A中溶液转移至B中,析出
溶液。将A中溶液转移至B中,析出 晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。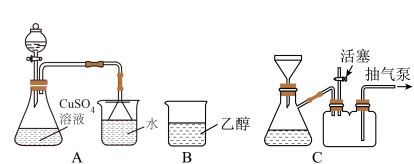
(4)抽滤时,抽气泵处于工作状态,活塞需
(5)使用下列试剂可代替乙醇来促进
 晶体析出的有
晶体析出的有a.
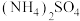 b.稀氨水 c.
b.稀氨水 c. d.
d. 溶液
溶液(6)晶体采用冷风吹干而不用加热烘干的原因是
Ⅲ.废液回收
减压过滤后的废液中含有
 、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得
、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得 和的混合溶液。
和的混合溶液。(7)
 溶液受热易分解,则回收乙醇的实验方法为
溶液受热易分解,则回收乙醇的实验方法为
您最近一年使用:0次
解题方法
3 . 科学家最近首次发现像大脑一样学习的材料—— 。某小组以接触法制硫酸的废催化剂(主要成分是
。某小组以接触法制硫酸的废催化剂(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如下:
的流程如下: 难溶于水,
难溶于水, 易溶于水;
易溶于水;
②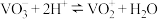
③几种金属离子氢氧化物沉淀的 。
。
请回答下列问题:
(1)“碱浸”中提高反应速率的可行措施有___________ (答出两条)。
(2)有人建议:在“酸浸”和“调 ”之间加入适量双氧水,理由是
”之间加入适量双氧水,理由是___________ 。
(3)理论上,为实现 完全沉淀,应调节
完全沉淀,应调节 ,在工业生产中,常调节
,在工业生产中,常调节 ,其目的是
,其目的是___________ (用化学用语和必要的文字说明)。
(4)“高温还原”中试剂X可能是 ,如果制备等量的
,如果制备等量的 (氧化产物都是
(氧化产物都是 ),则还原剂
),则还原剂 的物质的量之比为
的物质的量之比为___________ 。
(5)“煅烧2”需要在流动空气中煅烧的目的是___________ 。
(6)将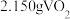 产品溶于强碱溶液,加热煮沸,淍节
产品溶于强碱溶液,加热煮沸,淍节 为8.5,把溶液稀释成
为8.5,把溶液稀释成 溶液,取
溶液,取 稀释后的溶液于锥形瓶中,加入酼酸酸化的KI溶液(过量),溶液中的还原产物为V3+,滴加指示剂,用0.10mol∙L−1Na2S2O3溶液滴定,重复三次,溶液中测得数据如下表所示:
稀释后的溶液于锥形瓶中,加入酼酸酸化的KI溶液(过量),溶液中的还原产物为V3+,滴加指示剂,用0.10mol∙L−1Na2S2O3溶液滴定,重复三次,溶液中测得数据如下表所示:
该产品的纯度为___________ %(保留3位有效数字)。如果加入稀酼酸过多,会使测定结果偏高,其原因是___________ (用离子方程式表示)。
 。某小组以接触法制硫酸的废催化剂(主要成分是
。某小组以接触法制硫酸的废催化剂(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如下:
的流程如下:
 难溶于水,
难溶于水, 易溶于水;
易溶于水;②
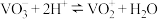
③几种金属离子氢氧化物沉淀的
 。
。| 金属氢氧化物 |  |  |  |
开始沉淀的 | 2.7 | 4.0 | 4.6 |
完全沉淀的 | 3.7 | 5.2 | 6.0 |
(1)“碱浸”中提高反应速率的可行措施有
(2)有人建议:在“酸浸”和“调
 ”之间加入适量双氧水,理由是
”之间加入适量双氧水,理由是(3)理论上,为实现
 完全沉淀,应调节
完全沉淀,应调节 ,在工业生产中,常调节
,在工业生产中,常调节 ,其目的是
,其目的是(4)“高温还原”中试剂X可能是
 ,如果制备等量的
,如果制备等量的 (氧化产物都是
(氧化产物都是 ),则还原剂
),则还原剂 的物质的量之比为
的物质的量之比为(5)“煅烧2”需要在流动空气中煅烧的目的是
(6)将
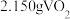 产品溶于强碱溶液,加热煮沸,淍节
产品溶于强碱溶液,加热煮沸,淍节 为8.5,把溶液稀释成
为8.5,把溶液稀释成 溶液,取
溶液,取 稀释后的溶液于锥形瓶中,加入酼酸酸化的KI溶液(过量),溶液中的还原产物为V3+,滴加指示剂,用0.10mol∙L−1Na2S2O3溶液滴定,重复三次,溶液中测得数据如下表所示:
稀释后的溶液于锥形瓶中,加入酼酸酸化的KI溶液(过量),溶液中的还原产物为V3+,滴加指示剂,用0.10mol∙L−1Na2S2O3溶液滴定,重复三次,溶液中测得数据如下表所示:| 序号 | 起始读数 | 终点读数 |
| ① | 0.20 | 21.55 |
| ② | 0.02 | 20.12 |
| ③ | 0.03 | 19.93 |
您最近一年使用:0次
4 . 废催化剂回收不仅可以有效利用资源,还能减少对环境的污染,某含银废催化剂主要含Ag、α-Al2O3(α-Al2O3为载体,不溶于硝酸)及少量MgO、SiO2、K2O、FeO、Fe2O3等,一种回收制备高纯银粉工艺的部分流程如图。回答下列问题:
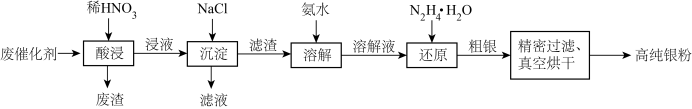
已知:
①“溶解”得到的溶解液里Ag元素以[Ag(NH3)2]+存在。
②AgSCN是白色沉淀,常温下,Ksp(AgSCN)=2.0×10-12。
(1)银单质与稀硝酸反应的离子方程式为________ ,酸浸时,能够增大浸取率的措施有_____ (写出一条即可),废渣的主要成分是_______ 。
(2)已知Ksp(AgCI)=1.8×10-10,进行“沉淀”过程时,若将等体积0.008mol·L-1AgNO3溶液与0.08mol·L-1NaCl溶液混合,是否生成AgCl沉淀?_______ (填“是”、“否”或“无法确定”),此时Ag+浓度为c(Ag+)=_______ 。
(3)若“还原”中N2H4转化生成无污染的气体,还原剂与氧化剂物质的量之比是______ 。
(4)粗银中银的质量分数w的测定:取ag粗银样品用硝酸溶解,以铁铵矾[NH4Fe(SO4)2·12H2O]为指示剂,用cmol/L的KSCN标准溶液滴定,消耗标准溶液VmL。判断滴定终点的标志是________ ,w=______ %。

已知:
①“溶解”得到的溶解液里Ag元素以[Ag(NH3)2]+存在。
②AgSCN是白色沉淀,常温下,Ksp(AgSCN)=2.0×10-12。
(1)银单质与稀硝酸反应的离子方程式为
(2)已知Ksp(AgCI)=1.8×10-10,进行“沉淀”过程时,若将等体积0.008mol·L-1AgNO3溶液与0.08mol·L-1NaCl溶液混合,是否生成AgCl沉淀?
(3)若“还原”中N2H4转化生成无污染的气体,还原剂与氧化剂物质的量之比是
(4)粗银中银的质量分数w的测定:取ag粗银样品用硝酸溶解,以铁铵矾[NH4Fe(SO4)2·12H2O]为指示剂,用cmol/L的KSCN标准溶液滴定,消耗标准溶液VmL。判断滴定终点的标志是
您最近一年使用:0次
名校
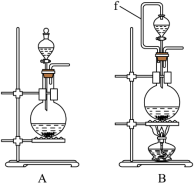
5 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,以下为制备两种消毒剂的方法,请回答下列问题:
(1)实验室沿用舍勒的方法制取 时选用图中装置
时选用图中装置_______ (填“A”或“B”),反应的离子方程式为_______ ,装置B中管f的作用是_______ 。
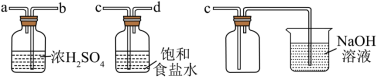
(2)实验室制取干燥、纯净的 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→_______ (填字母)。
(3)反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
【提出猜想】
猜想1: 降低,氧化剂
降低,氧化剂_______ (填化学式)氧化性减弱。
猜想2:_______ 减弱。
猜想3: 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
【实验拓展】经过探究,小组同学认为硫酸、 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式:_______ 。
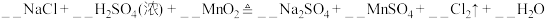
(1)实验室沿用舍勒的方法制取
 时选用图中装置
时选用图中装置
(2)实验室制取干燥、纯净的
 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→
(3)反应停止后,实验小组检验烧瓶中还有
 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。【提出猜想】
猜想1:
 降低,氧化剂
降低,氧化剂猜想2:
猜想3:
 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸,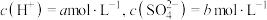 | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使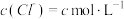 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 固体,使 固体,使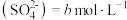 | 猜想3正确 |
 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式: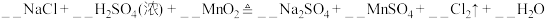
您最近一年使用:0次
2024-01-07更新
|
656次组卷
|
4卷引用: 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)
2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)(已下线)期末测试卷01-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题河南省新乡市原阳县第一高级中学2023-2024学年高一上学期1月月考化学试题
名校
解题方法
6 . 草酸是一种用途广泛的二元有机中强酸,某同学通过查阅资料设计了如图所示的装置(夹持仪器省略)制备一定量的草酸晶体(H2C2O4·2H2O),并验证其具有的某些性质。回答下列问题:
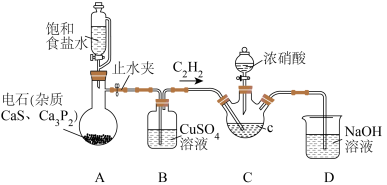
(1)仪器C的名称是_________ 。有人经分析后认为,用质量分数为70%的酒精溶液代替饱和食盐水(20℃时NaCl溶解度为36g)可获得更为平稳的气流,他得出这种结论的依据是_______ 。
(2)装置B的作用是_______________ ,若实验中使用上述酒精溶液代替食盐水,并且利用酸性KMnO4溶液检验有乙炔生成,则气体通过B后应先通入到盛有__________ 的洗气瓶,最后通入到酸性KMnO4溶液中。
(3)草酸在装置C中生成,反应的化学方程式为__________ ,装置D的作用是___________ 。
(4)待反应结束后,从C中分离出草酸晶体,然后用0.1000mol/L的酸性KMnO4溶液进行滴定以测定其纯度。
①称量3.500g草酸晶体配制100mL溶液,下 列配制操作中错误的是________ (填标号)。
a. b.
b. c.
c. d.
d. 
②三次平行滴定实验中消耗KMnO4溶液的体积如下表所示,其中第一次实验滴定后的液面位置如图所示。
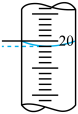
则V=_____ mL,样品中草酸晶体的质量分数为___________ 。

(1)仪器C的名称是
(2)装置B的作用是
(3)草酸在装置C中生成,反应的化学方程式为
(4)待反应结束后,从C中分离出草酸晶体,然后用0.1000mol/L的酸性KMnO4溶液进行滴定以测定其纯度。
①称量3.500g草酸晶体配制100mL溶液,下 列配制操作中错误的是
a.
 b.
b. c.
c. d.
d. 
②三次平行滴定实验中消耗KMnO4溶液的体积如下表所示,其中第一次实验滴定后的液面位置如图所示。

| 滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液的体积/mL | ||
| 第一次 | 20.00 | 0.20 | V1 | |
| 第二次 | 20.00 | 2.56 | 23.40 | |
| 第三次 | 20.00 | 0.22 | 20.32 | |
您最近一年使用:0次
名校
解题方法
7 .  是一种绿色净水剂,易溶于水。某小组在实验室条件下制备
是一种绿色净水剂,易溶于水。某小组在实验室条件下制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
实验(一)制备 。
。
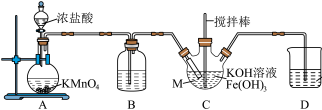
(1)仪器M的名称是_____ ,装置B的作用是_____ 。
(2)装置C中生成 的化学方程式为
的化学方程式为_____ 。
(3)实验得知装置D中吸收的 为装置A中生成
为装置A中生成 的25%,不考虑其他消耗,若装置D中生成的氧化产物只有
的25%,不考虑其他消耗,若装置D中生成的氧化产物只有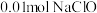 ,则生成
,则生成_____ 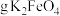 。
。
实验(二)探究 的性质。
的性质。

实验中观察到b中溶液变为蓝色,a中溶液由紫红色变为黄色,并产生气泡。
(4)酸R选择稀硫酸,不选择盐酸,其主要原因是_____ ;酸R选择稀硫酸时,从d口逸出的气体_____ (填“可以”或“不可以”)直接排放至大气中。
(5)当选用硫酸时,装置a中的离子方程式为_____ 。
(6)另设计一种方案确认有 产生:
产生:_____ 。
(7)向另一试管中的 溶液中滴加
溶液中滴加 溶液,溶液变为紫红色。不能证明氧化性:
溶液,溶液变为紫红色。不能证明氧化性: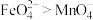 ,其原因是
,其原因是_____ 。
 是一种绿色净水剂,易溶于水。某小组在实验室条件下制备
是一种绿色净水剂,易溶于水。某小组在实验室条件下制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:实验(一)制备
 。
。
(1)仪器M的名称是
(2)装置C中生成
 的化学方程式为
的化学方程式为(3)实验得知装置D中吸收的
 为装置A中生成
为装置A中生成 的25%,不考虑其他消耗,若装置D中生成的氧化产物只有
的25%,不考虑其他消耗,若装置D中生成的氧化产物只有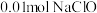 ,则生成
,则生成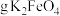 。
。实验(二)探究
 的性质。
的性质。
实验中观察到b中溶液变为蓝色,a中溶液由紫红色变为黄色,并产生气泡。
(4)酸R选择稀硫酸,不选择盐酸,其主要原因是
(5)当选用硫酸时,装置a中的离子方程式为
(6)另设计一种方案确认有
 产生:
产生:(7)向另一试管中的
 溶液中滴加
溶液中滴加 溶液,溶液变为紫红色。不能证明氧化性:
溶液,溶液变为紫红色。不能证明氧化性: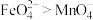 ,其原因是
,其原因是
您最近一年使用:0次
2023-09-28更新
|
89次组卷
|
2卷引用:内蒙古部分名校2023-2024学年高三上学期9月大联考化学试题
8 . 某废旧金属材料中主要含Fe、Cu、Al、 、
、 、
、 (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去_______ 。
(2)“碱浸”时发生反应的化学方程式为_______ 。
(3)操作Ⅰ、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是_______ 。
(4)第一次酸浸完全后“加入过量试剂a”后发生的化学反应中有一个属于化合反应,其离子方程式为_______ 。
(5)滤液Ⅱ中可能含有因氧气的作用而产生的少量杂质离子,该反应的离子方程式为_______ 。
①设计实验检验滤液Ⅱ中是否含有上述离子:_______ 。
②若要定量测定所得绿矾纯度,可通过如下方法:称取 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性
的酸性 溶液,恰好完全反应时,消耗酸性
溶液,恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为 ,则
,则 的纯度为
的纯度为_______ 。(写出计算过程,结果保留三位有效数字)已知: (未配平)
(未配平)
 、
、 、
、 (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。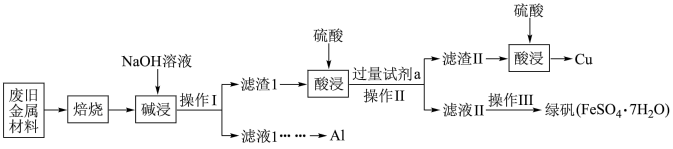
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去
(2)“碱浸”时发生反应的化学方程式为
(3)操作Ⅰ、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是
(4)第一次酸浸完全后“加入过量试剂a”后发生的化学反应中有一个属于化合反应,其离子方程式为
(5)滤液Ⅱ中可能含有因氧气的作用而产生的少量杂质离子,该反应的离子方程式为
①设计实验检验滤液Ⅱ中是否含有上述离子:
②若要定量测定所得绿矾纯度,可通过如下方法:称取
 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性
的酸性 溶液,恰好完全反应时,消耗酸性
溶液,恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为 ,则
,则 的纯度为
的纯度为 (未配平)
(未配平)
您最近一年使用:0次
2023-07-28更新
|
437次组卷
|
2卷引用:内蒙古自治区乌海市第一中学2023-2024学年高一下学期4月第一次月考化学试题
解题方法
9 . 某化工厂产生的废渣中含有PbSO4和Ag,为了回收这两种物质,某同学设计了如下流程:
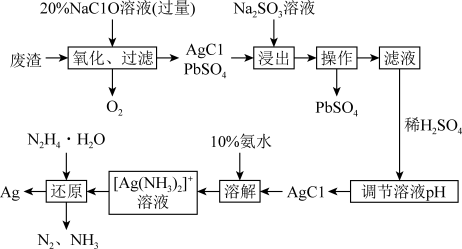
已知:“浸出”过程发生可逆反应AgCl+2

 +Cl-、Ksp(PbSO4) =2.5 ×10-8、Ksp(PbCO3)=7.4×10-14
+Cl-、Ksp(PbSO4) =2.5 ×10-8、Ksp(PbCO3)=7.4×10-14
请回答以下问题:
(1)“氧化”阶段需在80°C条件下进行,最适合的加热方式为___________ ,将废渣“氧化”的化学方程式为___________ 。
(2)“浸出”时Na2SO3溶液和氨水都可用作浸出剂,从环保角度分析亚硫酸钠的优势___________ 。
(3)研究发现:浸出液中含银化合物总浓度与含硫化合物总浓度及浸出液pH的关系如下图所示:
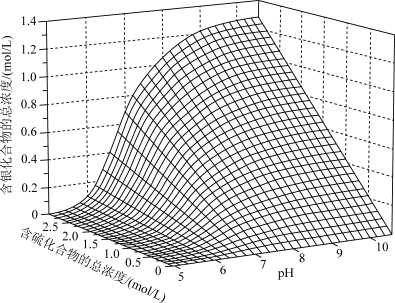
①pH=10时,含银化合物总浓度随含硫化合物总浓度的变化趋势是___________ 。
②pH=5时,含银化合物总浓度随含硫化合物总浓度的变化与pH=10时不同,原因是___________ 。
(4)“还原”过程中还原剂与氧化剂物质的量之比为___________ 。
(5)工业上常用Na2CO3溶液与PbSO4反应实现铅的转化并且反应趋于完全,请用沉淀溶解平衡原理解释选择Na2CO3转化铅的原因___________ 。

已知:“浸出”过程发生可逆反应AgCl+2


 +Cl-、Ksp(PbSO4) =2.5 ×10-8、Ksp(PbCO3)=7.4×10-14
+Cl-、Ksp(PbSO4) =2.5 ×10-8、Ksp(PbCO3)=7.4×10-14请回答以下问题:
(1)“氧化”阶段需在80°C条件下进行,最适合的加热方式为
(2)“浸出”时Na2SO3溶液和氨水都可用作浸出剂,从环保角度分析亚硫酸钠的优势
(3)研究发现:浸出液中含银化合物总浓度与含硫化合物总浓度及浸出液pH的关系如下图所示:

①pH=10时,含银化合物总浓度随含硫化合物总浓度的变化趋势是
②pH=5时,含银化合物总浓度随含硫化合物总浓度的变化与pH=10时不同,原因是
(4)“还原”过程中还原剂与氧化剂物质的量之比为
(5)工业上常用Na2CO3溶液与PbSO4反应实现铅的转化并且反应趋于完全,请用沉淀溶解平衡原理解释选择Na2CO3转化铅的原因
您最近一年使用:0次
解题方法
10 . 我国锂云母矿石储量丰富,现有产自内蒙古的锂云母矿石(主要成分为SiO2·Al2O3·2(Li,K)(F,OH)],内含少量镁、钙、铁的氧化物),工业上欲采用硫酸法用其制备Li2CO3具体流程如下:
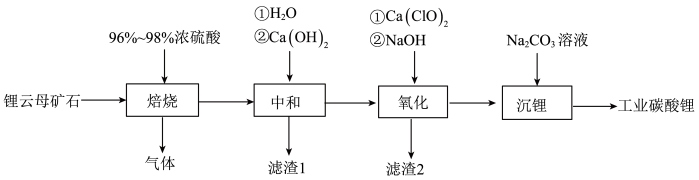
查阅资料可知:
I.“焙烧”温度对锂提取率的影响如下图所示

Ⅱ.“焙烧”过程中铁的氧化物未参与反应
Ⅲ.3SiO2·Al2O3·2(Li,K)(F,OH)]+H2SO4(浓) Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2O
Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2O
Ⅳ.Li2SO4+Na2CO3→Li2CO3↓+Na2SO4
回答下列问题:
(1)“焙烧”温度理论上选择_______ 为宜,同时为提高“焙烧”效率,还可采取的措施有_______ ;
(2)“焙烧”产生的气体可用NaOH溶液吸收,且元素化合价均不发生变化,该反应的化学方程式为_______ ;
(3)在“中和”过程中,为使Fe3+和Al3+完全沉淀,pH值至少调整为_______ ;部分金属氢氧化物的pKsp(pKsp=-lgKsp)如图所示:

(4)“中和”所得“滤渣1”中除氢氧化物沉淀外还含有_______ ;
(5)“氧化”过程中发生氧化还原反应的离子方程式为_______ ;
(6)“滤渣2”的主要成分是_______ ;
(7)工业上还可以通过“苛化反应”,利用Li2CO3(s)+Ca2+(aq) CaCO3(s)+2Li+(aq)反应原理得到氢氧化锂溶液,进而生产出纯度更高的工业碳酸锂,请通过计算过程证实该方案的可行性
CaCO3(s)+2Li+(aq)反应原理得到氢氧化锂溶液,进而生产出纯度更高的工业碳酸锂,请通过计算过程证实该方案的可行性_______ 。[已知Ksp(Li2CO3)=8.64×10-4;KspCaCO3)=2.5×10-9]

查阅资料可知:
I.“焙烧”温度对锂提取率的影响如下图所示

Ⅱ.“焙烧”过程中铁的氧化物未参与反应
Ⅲ.3SiO2·Al2O3·2(Li,K)(F,OH)]+H2SO4(浓)
 Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2O
Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2OⅣ.Li2SO4+Na2CO3→Li2CO3↓+Na2SO4
回答下列问题:
(1)“焙烧”温度理论上选择
(2)“焙烧”产生的气体可用NaOH溶液吸收,且元素化合价均不发生变化,该反应的化学方程式为
(3)在“中和”过程中,为使Fe3+和Al3+完全沉淀,pH值至少调整为

(4)“中和”所得“滤渣1”中除氢氧化物沉淀外还含有
(5)“氧化”过程中发生氧化还原反应的离子方程式为
(6)“滤渣2”的主要成分是
(7)工业上还可以通过“苛化反应”,利用Li2CO3(s)+Ca2+(aq)
 CaCO3(s)+2Li+(aq)反应原理得到氢氧化锂溶液,进而生产出纯度更高的工业碳酸锂,请通过计算过程证实该方案的可行性
CaCO3(s)+2Li+(aq)反应原理得到氢氧化锂溶液,进而生产出纯度更高的工业碳酸锂,请通过计算过程证实该方案的可行性
您最近一年使用:0次



