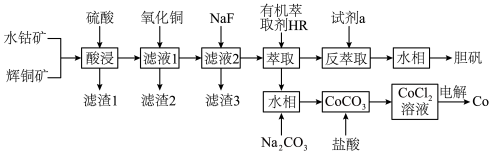
1 . 以水钴矿(Co2O3·H2O,含Fe2O3、MgO、CaO)和辉铜矿(Cu2S,含SiO2、Fe2O3)为原料制取胆矾和单质钴。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
③萃取Cu2+的反应原理;Cu2++2HR CuR2+2H+;
CuR2+2H+;
④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
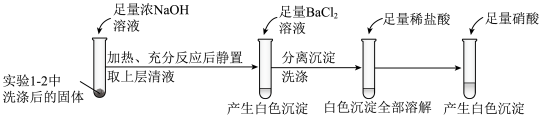
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于___________ 。
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为___________ g(忽略溶液体积的变化)。
(5)“反萃取”步骤中加入的“试剂a”为___________ 。
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶1∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为___________ 。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Cu2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.7 | 7.5 | 7.6 | 4.7 |
| 完全沉淀时(c=10-5mol/L)的pH | 3.7 | 9.0 | 9.1 | 6.2 |
 CuR2+2H+;
CuR2+2H+;④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:
(2)“滤渣1”的主要成分为
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为
(5)“反萃取”步骤中加入的“试剂a”为
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶1∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为
您最近一年使用:0次
名校
解题方法
2 . 亚硝酸钙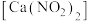 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应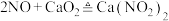 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: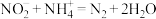 ;“还原
;“还原 ”时加入
”时加入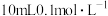 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
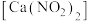 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应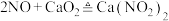 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。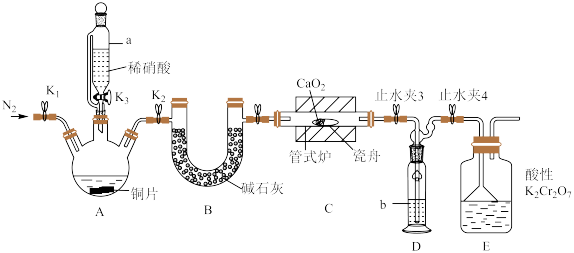
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质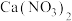 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: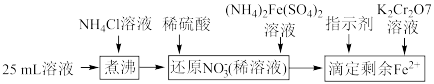
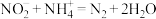 ;“还原
;“还原 ”时加入
”时加入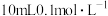 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
今日更新
|
242次组卷
|
6卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
解题方法
3 . 废旧铅蓄电池具有较高的回收利用价值。由废铅膏(含 、
、 、
、 和
和 以及少量的铁和铝的氧化物)制备
以及少量的铁和铝的氧化物)制备 的流程如下:
的流程如下: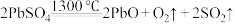 ;
;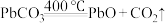
②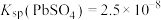 ,
,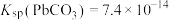
请回答下列问题:
(1)“浸取”时为增大浸取速率,可以采取的措施有___________ (请写一点)。
(2)“浸取”时 发生的主要反应的化学方程式为
发生的主要反应的化学方程式为___________ 。
(3)“浸取”时将 换成
换成 溶液效果会更好,
溶液效果会更好, 除作还原剂外,还有的作用为
除作还原剂外,还有的作用为___________ 。
(4)“脱硫”的目的是___________ 。
(5)“脱硫”时 转化反应的离子方程式为
转化反应的离子方程式为___________ ;用沉淀溶解平衡原理解释选择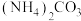 的原因
的原因___________ 。
(6)“焙烧”时会有中间产物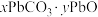 生成,固体残留率
生成,固体残留率 与温度的关系如图所示,则358℃时对应固体的成分为
与温度的关系如图所示,则358℃时对应固体的成分为___________ (填化学式)。
 、
、 、
、 和
和 以及少量的铁和铝的氧化物)制备
以及少量的铁和铝的氧化物)制备 的流程如下:
的流程如下: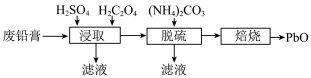
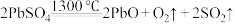 ;
;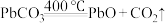
②
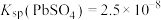 ,
,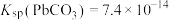
请回答下列问题:
(1)“浸取”时为增大浸取速率,可以采取的措施有
(2)“浸取”时
 发生的主要反应的化学方程式为
发生的主要反应的化学方程式为(3)“浸取”时将
 换成
换成 溶液效果会更好,
溶液效果会更好, 除作还原剂外,还有的作用为
除作还原剂外,还有的作用为(4)“脱硫”的目的是
(5)“脱硫”时
 转化反应的离子方程式为
转化反应的离子方程式为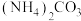 的原因
的原因(6)“焙烧”时会有中间产物
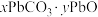 生成,固体残留率
生成,固体残留率 与温度的关系如图所示,则358℃时对应固体的成分为
与温度的关系如图所示,则358℃时对应固体的成分为
您最近一年使用:0次
名校
解题方法
4 . 钼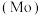 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;
②钼酸铵 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。
(1)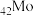 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为__________ 。
(2)“焙烧”中 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:________________ 。
(3)下列说法正确的是__________(填标号)。
(4)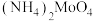 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。
(5)经过结晶、过滤、洗涤、干燥等操作得到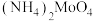 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为__________ 。
(6)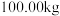 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为 )通过该工艺最终得到
)通过该工艺最终得到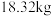 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为__________  。(保留一位小数,产率=
。(保留一位小数,产率=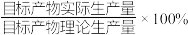 )
)
(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为__________ , 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为__________
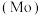 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。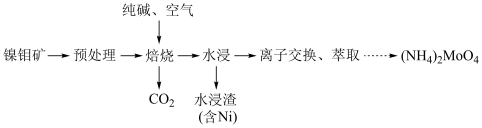
 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;②钼酸铵
 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。(1)
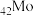 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为(2)“焙烧”中
 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:(3)下列说法正确的是__________(填标号)。
A.电负性: |
B.离子半径: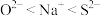 |
C.第一电离能: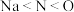 |
D.基态 中成对电子数与未成对电子数之比为 中成对电子数与未成对电子数之比为 |
(4)
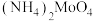 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。| A.分子间作用力 | B.金属键 |
| C.共价键 | D.离子键 |
(5)经过结晶、过滤、洗涤、干燥等操作得到
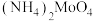 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为(6)
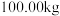 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为 )通过该工艺最终得到
)通过该工艺最终得到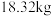 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为 。(保留一位小数,产率=
。(保留一位小数,产率=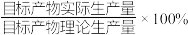 )
)(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在
 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为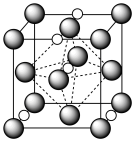
您最近一年使用:0次
昨日更新
|
145次组卷
|
3卷引用:河北省保定市九校2024届高三下学期二模化学试题
名校
解题方法
5 . 某研究小组用氨基钠(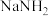 )与
)与 反应制备叠氮化钠(
反应制备叠氮化钠( )并对制得的叠氮化钠产品纯度进行测定。已知叠氮化钠为易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,NaOH溶于乙醇不溶于乙醚。氨基钠极易水解和氧化;
)并对制得的叠氮化钠产品纯度进行测定。已知叠氮化钠为易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,NaOH溶于乙醇不溶于乙醚。氨基钠极易水解和氧化; 不与酸或碱反应;
不与酸或碱反应; 具有较强还原性(Sn与碳同族)。回答下列问题:
具有较强还原性(Sn与碳同族)。回答下列问题:
(1)制备叠氮化钠:连接好装置后,打开A中分液漏斗活塞,向圆底烧瓶中滴加溶液,充分反应。___________ 。
②装置的连接顺序为a→___________ →h(填仪器接口字母)。
③A中发生反应的化学方程式为___________ ,E装置的作用为___________ 。
④C中发生的反应为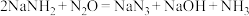 ,反应后待装置冷却,在混合物中加入
,反应后待装置冷却,在混合物中加入___________ ,过滤,用___________ (选填字母)洗涤,晾干得到粗产品。
A.冷水 B.乙醚 C.热水 D.乙醇
(2)测定产品纯度:取装置C中制得的叠氮化钠样品m克放入圆底烧瓶中进行纯度的测定,如图。___________ 。
②读取气体体积时,应注意冷却至室温、___________ 、视线与凹液面最低点水平相切。
③若量气管的初始读数为x mL、末读数为y mL,本实验条件下气体摩尔体积为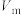 L/mol,则产品中
L/mol,则产品中 的质量分数为
的质量分数为___________ %(表达式)。(提示:量气管刻度与滴定管类似)
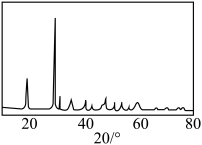
④若对所得产品进行X射线衍射实验得到图谱如图所示,该产品属于___________ (填“晶体”或“非晶体”)。
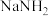 )与
)与 反应制备叠氮化钠(
反应制备叠氮化钠( )并对制得的叠氮化钠产品纯度进行测定。已知叠氮化钠为易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,NaOH溶于乙醇不溶于乙醚。氨基钠极易水解和氧化;
)并对制得的叠氮化钠产品纯度进行测定。已知叠氮化钠为易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,NaOH溶于乙醇不溶于乙醚。氨基钠极易水解和氧化; 不与酸或碱反应;
不与酸或碱反应; 具有较强还原性(Sn与碳同族)。回答下列问题:
具有较强还原性(Sn与碳同族)。回答下列问题:(1)制备叠氮化钠:连接好装置后,打开A中分液漏斗活塞,向圆底烧瓶中滴加溶液,充分反应。
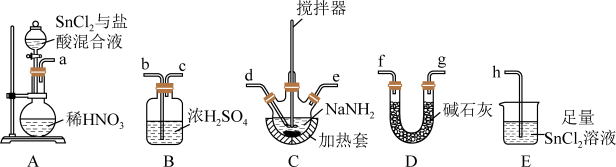
②装置的连接顺序为a→
③A中发生反应的化学方程式为
④C中发生的反应为
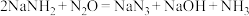 ,反应后待装置冷却,在混合物中加入
,反应后待装置冷却,在混合物中加入A.冷水 B.乙醚 C.热水 D.乙醇
(2)测定产品纯度:取装置C中制得的叠氮化钠样品m克放入圆底烧瓶中进行纯度的测定,如图。
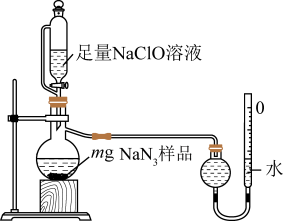
②读取气体体积时,应注意冷却至室温、
③若量气管的初始读数为x mL、末读数为y mL,本实验条件下气体摩尔体积为
 L/mol,则产品中
L/mol,则产品中 的质量分数为
的质量分数为④若对所得产品进行X射线衍射实验得到图谱如图所示,该产品属于
您最近一年使用:0次
名校
解题方法
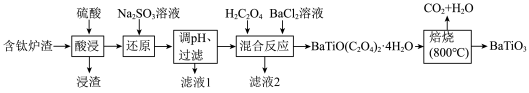
6 . BaTiO3,被用作陶瓷电容器的介电材料、麦克风和其他传感器的压电材料。以含钛炉渣(主要成分是TiO2,含少量Fe2O3、CaO、SiO2等)为原料制备BaTiO3的流程如下:
回答下列问题:
(1)下列为Ba粒子简化电子排布式,其中能量最高的是 (填字母)。
(2)“还原”中发生反应的离子方程式为________ 。若省去“还原”工艺,则________ 。
(3)设计实验检验滤液1中是否含有Fe2+:________ 。
(4)BaTiO(C2O4)2·4H2O中Ti的化合价为________ ,“焙烧”发生反应的化学方程式为________ 。
(5)经X射线分析鉴定,钛酸钡(BaTiO3)的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),已知晶胞边长为 pm,O2-的半径为
pm,O2-的半径为 pm,则Ti4+、Ba2+的半径分别为
pm,则Ti4+、Ba2+的半径分别为______ pm、______ pm。(用含 、
、 的代数式表示)
的代数式表示)
| 金属离子 | TiO2+ | Fe2+ | Fe3+ |
| 开始沉淀的pH | 0.5 | 6.3 | 1.5 |
| 完全沉淀的pH | 2.5 | 8.3 | 2.8 |
(1)下列为Ba粒子简化电子排布式,其中能量最高的是 (填字母)。
| A.[Xe]6s2 | B.[Xe]6s1 | C.[Xe]6s16p1 | D.[Xe]6s0p2 |
(2)“还原”中发生反应的离子方程式为
(3)设计实验检验滤液1中是否含有Fe2+:
(4)BaTiO(C2O4)2·4H2O中Ti的化合价为
(5)经X射线分析鉴定,钛酸钡(BaTiO3)的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),已知晶胞边长为
 pm,O2-的半径为
pm,O2-的半径为 pm,则Ti4+、Ba2+的半径分别为
pm,则Ti4+、Ba2+的半径分别为 、
、 的代数式表示)
的代数式表示)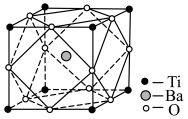
您最近一年使用:0次
解题方法
7 . 某小组同学探究Mg与 溶液的反应。
溶液的反应。
已知:i.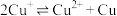
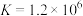
ⅱ.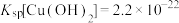
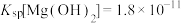
ⅲ. 为无色、
为无色、 为黄色
为黄色
实验I:将长约15cm打磨光亮的镁条放入2mL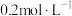
 溶液(溶液呈黄绿色)中,实验记录如下:
溶液(溶液呈黄绿色)中,实验记录如下:
(1)第一阶段析出红色固体发生反应的离子方程式是______ 。
(2)小组同学取第二阶段中淡蓝色溶液,加入少量NaCl固体,溶液颜色逐渐变黄绿色,请用离子方程式表示溶液由淡蓝色变为黄绿色的原因______ 。
(3)查阅资料:CuOH黄色,CuCl白色。
第三阶段产生的黄色沉淀可能含+1价铜的化合物,进行以下实验探究:
①取少量沉淀滴入浓氨水,沉淀完全溶解,溶液呈浅蓝色,在空气中放置一段时间后溶液成深蓝色,证实沉淀中含+1价铜的化合物,溶液由浅蓝色变为深蓝色的离子方程式是______ 。
②甲同学猜想第三阶段反应中先生成CuCl,随着反应的进行,逐渐转化为黄色的CuOH,用离子方程式表示生成CuCl的主要原因是______ 。
③小组同学采用电化学装置进行验证。______ 。从而证明了甲同学的猜想。
(4)查阅资料,CuOH在碱性环境下一部分发生非氧化还原分解反应,第四阶段中产生的橙色沉淀中混有的物质是______ 。
实验Ⅱ:改用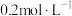
 溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
(5)经验证蓝色沉淀为 ,下列有关产生蓝色沉淀分析合理的是
,下列有关产生蓝色沉淀分析合理的是______ (填序号)。
a.反应放热,促使 水解趋于完全,生成
水解趋于完全,生成 蓝色沉淀
蓝色沉淀
b.存在平衡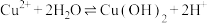 ,Mg与
,Mg与 反应,使
反应,使 下降,平衡移动,产生蓝色沉淀
下降,平衡移动,产生蓝色沉淀
c.由于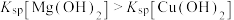 ,Mg与水反应生成的
,Mg与水反应生成的 逐渐转化为
逐渐转化为 蓝色沉淀
蓝色沉淀
(6)综上所述,影响Mg与 溶液反应的影响因素是
溶液反应的影响因素是______ 。
 溶液的反应。
溶液的反应。已知:i.
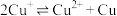
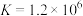
ⅱ.
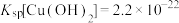
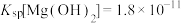
ⅲ.
 为无色、
为无色、 为黄色
为黄色实验I:将长约15cm打磨光亮的镁条放入2mL
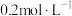
 溶液(溶液呈黄绿色)中,实验记录如下:
溶液(溶液呈黄绿色)中,实验记录如下:| 时间 | 第一阶段 0~1min | 第二阶段 1~8min | 第三阶段 8~25min | 第四阶段 25min~18h |
| 实验现象 | 镁条表面出现红色固体,伴有大量气体产生 | 仍然伴有大量气体,溶液变为淡蓝色,试管底部有蓝色沉淀产生 | 气体量不断减少,沉淀变为黄色 | 沉淀变为橙色,红色铜几乎不可见 |
(2)小组同学取第二阶段中淡蓝色溶液,加入少量NaCl固体,溶液颜色逐渐变黄绿色,请用离子方程式表示溶液由淡蓝色变为黄绿色的原因
(3)查阅资料:CuOH黄色,CuCl白色。
第三阶段产生的黄色沉淀可能含+1价铜的化合物,进行以下实验探究:
①取少量沉淀滴入浓氨水,沉淀完全溶解,溶液呈浅蓝色,在空气中放置一段时间后溶液成深蓝色,证实沉淀中含+1价铜的化合物,溶液由浅蓝色变为深蓝色的离子方程式是
②甲同学猜想第三阶段反应中先生成CuCl,随着反应的进行,逐渐转化为黄色的CuOH,用离子方程式表示生成CuCl的主要原因是
③小组同学采用电化学装置进行验证。
(4)查阅资料,CuOH在碱性环境下一部分发生非氧化还原分解反应,第四阶段中产生的橙色沉淀中混有的物质是
实验Ⅱ:改用
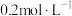
 溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。(5)经验证蓝色沉淀为
 ,下列有关产生蓝色沉淀分析合理的是
,下列有关产生蓝色沉淀分析合理的是a.反应放热,促使
 水解趋于完全,生成
水解趋于完全,生成 蓝色沉淀
蓝色沉淀b.存在平衡
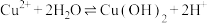 ,Mg与
,Mg与 反应,使
反应,使 下降,平衡移动,产生蓝色沉淀
下降,平衡移动,产生蓝色沉淀c.由于
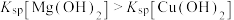 ,Mg与水反应生成的
,Mg与水反应生成的 逐渐转化为
逐渐转化为 蓝色沉淀
蓝色沉淀(6)综上所述,影响Mg与
 溶液反应的影响因素是
溶液反应的影响因素是
您最近一年使用:0次
解题方法
8 . 某实验小组对 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。
资料: 为白色固体,易溶于水。
为白色固体,易溶于水。
【实验1】
I.探究反应的产物
(1)经检验实验中的黑色固体均为 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为_________ 。
【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是_________ 。
②依据实验2,推测S与NaOH反应的离子方程式为_________ 。
③实验2中,加入硝酸的目的是_________ 。
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:_____ 。
□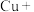 □
□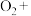 □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
说明:本实验中,电压表的读数越大,氧化剂的氧化性(或还原剂的还原性)越强。
(4)资料表明,对于电极反应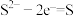 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是_________ 。
(5)小组同学用实验3装置补做实验3-5,排除了 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为_________ 。
(6)综合上述实验可以得到的结论有_________ 。
 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。资料:
 为白色固体,易溶于水。
为白色固体,易溶于水。【实验1】
序号 | 实验操作 | 实验现象 |
 | 向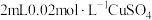 溶液中加入 溶液中加入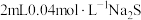 溶液 溶液 | 产生黑色固体 |
 | 向 饱和 饱和 溶液(约为 溶液(约为 , , 约为3)中加入 约为3)中加入 饱和 饱和 溶液(约为 溶液(约为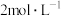 , , 约为13) 约为13) | 迅速产生大量黑色固体、少量红色固体和黄色固体,静置后红色固体减少、黑色固体增多 |
(1)经检验实验中的黑色固体均为
 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是
②依据实验2,推测S与NaOH反应的离子方程式为
③实验2中,加入硝酸的目的是
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:
□
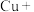 □
□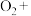 □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
| 序号 | 实验方案 | 实验现象 | |
| 3-1 |
| a:饱和 溶液 溶液b:饱和  溶液 溶液 | 电压表指针偏转,读数为0.85V |
| 3-2 | a: 溶液 溶液b: 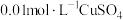 溶液 溶液 | 电压表指针偏转,读数为0.46V | |
| 3-3 | a: 溶液(pH调至13) 溶液(pH调至13)b: 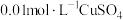 溶液 溶液 | 电压表指针偏转,读数为0.68V | |
| 3-4 | a: 溶液(pH调至13) 溶液(pH调至13)b: 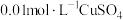 溶液 溶液 | 电压表指针略偏转,读数为0.10V | |
(4)资料表明,对于电极反应
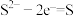 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是(5)小组同学用实验3装置补做实验3-5,排除了
 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为(6)综合上述实验可以得到的结论有
您最近一年使用:0次
解题方法
9 . 某研究小组模拟用硫酸化焙烧—水浸工艺从高砷铜冶炼烟尘中浸出铜、锌的流程如下。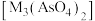 及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与
及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与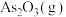 。各元素质量分数如下:
。各元素质量分数如下:
②25℃时,硫酸铅的溶度积常数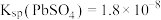 ;
;
③浸出率的计算:浸出率 。
。
回答下列问题:
(1)基态Zn原子的价层电子排布式为___________ 。
(2)“焙烧”时,无烟煤除了为焙烧提供热量外,还表现___________ 的作用。请补全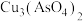 参与反应的化学方程式:
参与反应的化学方程式: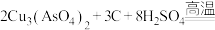
___________ 。
(3)“水浸”时,所得浸渣的主要成分为___________ (写化学式),往浸取液中加入的金属单质是___________ (写化学式)。
(4)高砷铜冶炼烟尘经过焙烧、水浸等工序后,测得浸取液中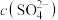 为
为 ,请从理论上分析铅是否沉淀完全?
,请从理论上分析铅是否沉淀完全?___________ (列式计算并得出结论)。
(5)铜浸出率的测定:从上述流程中得到的1L浸取液中取50mL与过量的酸性KI完全反应后,过滤,往滤液中滴加淀粉溶液为指示剂,用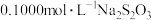 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液21.00mL。(已知:
标准溶液21.00mL。(已知: ,
, )
)
①滴定终点的现象为___________ 。
②忽略流程中的损失,可得铜的浸出率为___________ 。

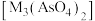 及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与
及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与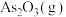 。各元素质量分数如下:
。各元素质量分数如下:| Cu | Zn | As | Pb | In | Ag |
| 5.60% | 15.60% | 28.68% | 22.34% | 0.073% | 0.01% |
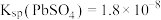 ;
;③浸出率的计算:浸出率
 。
。回答下列问题:
(1)基态Zn原子的价层电子排布式为
(2)“焙烧”时,无烟煤除了为焙烧提供热量外,还表现
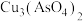 参与反应的化学方程式:
参与反应的化学方程式: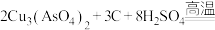
(3)“水浸”时,所得浸渣的主要成分为
(4)高砷铜冶炼烟尘经过焙烧、水浸等工序后,测得浸取液中
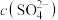 为
为 ,请从理论上分析铅是否沉淀完全?
,请从理论上分析铅是否沉淀完全?(5)铜浸出率的测定:从上述流程中得到的1L浸取液中取50mL与过量的酸性KI完全反应后,过滤,往滤液中滴加淀粉溶液为指示剂,用
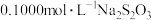 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液21.00mL。(已知:
标准溶液21.00mL。(已知: ,
, )
)①滴定终点的现象为
②忽略流程中的损失,可得铜的浸出率为
您最近一年使用:0次
解题方法
10 . 硫脲 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。
(1)仪器a的名称为__________ 。
(2)从结构角度分析,硫脲可溶于水的原因是__________ 。
(3)多孔球泡的作用是__________ 。
(4)B中反应完全的标志是__________ 。
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为__________ (填标号)。
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:
取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为__________ 。
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成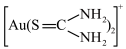 ,反应的离子方程式为
,反应的离子方程式为_______ 。溶解金的过程伴随着溶液变红的现象,原因可能为硫脲发生异构化生成__________ (填化学式)。
 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。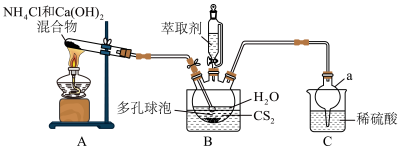
(1)仪器a的名称为
(2)从结构角度分析,硫脲可溶于水的原因是
(3)多孔球泡的作用是
(4)B中反应完全的标志是
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:

取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成
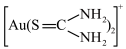 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
7日内更新
|
150次组卷
|
3卷引用:湖北省武汉市2024届高三毕业生四月调研考试(二模)化学试题




