某研究小组模拟用硫酸化焙烧—水浸工艺从高砷铜冶炼烟尘中浸出铜、锌的流程如下。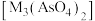 及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与
及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与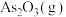 。各元素质量分数如下:
。各元素质量分数如下:
②25℃时,硫酸铅的溶度积常数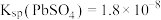 ;
;
③浸出率的计算:浸出率 。
。
回答下列问题:
(1)基态Zn原子的价层电子排布式为___________ 。
(2)“焙烧”时,无烟煤除了为焙烧提供热量外,还表现___________ 的作用。请补全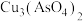 参与反应的化学方程式:
参与反应的化学方程式: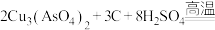
___________ 。
(3)“水浸”时,所得浸渣的主要成分为___________ (写化学式),往浸取液中加入的金属单质是___________ (写化学式)。
(4)高砷铜冶炼烟尘经过焙烧、水浸等工序后,测得浸取液中 为
为 ,请从理论上分析铅是否沉淀完全?
,请从理论上分析铅是否沉淀完全?___________ (列式计算并得出结论)。
(5)铜浸出率的测定:从上述流程中得到的1L浸取液中取50mL与过量的酸性KI完全反应后,过滤,往滤液中滴加淀粉溶液为指示剂,用 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液21.00mL。(已知:
标准溶液21.00mL。(已知: ,
, )
)
①滴定终点的现象为___________ 。
②忽略流程中的损失,可得铜的浸出率为___________ 。

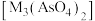 及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与
及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与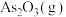 。各元素质量分数如下:
。各元素质量分数如下:| Cu | Zn | As | Pb | In | Ag |
| 5.60% | 15.60% | 28.68% | 22.34% | 0.073% | 0.01% |
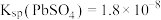 ;
;③浸出率的计算:浸出率
 。
。回答下列问题:
(1)基态Zn原子的价层电子排布式为
(2)“焙烧”时,无烟煤除了为焙烧提供热量外,还表现
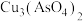 参与反应的化学方程式:
参与反应的化学方程式: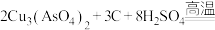
(3)“水浸”时,所得浸渣的主要成分为
(4)高砷铜冶炼烟尘经过焙烧、水浸等工序后,测得浸取液中
 为
为 ,请从理论上分析铅是否沉淀完全?
,请从理论上分析铅是否沉淀完全?(5)铜浸出率的测定:从上述流程中得到的1L浸取液中取50mL与过量的酸性KI完全反应后,过滤,往滤液中滴加淀粉溶液为指示剂,用
 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液21.00mL。(已知:
标准溶液21.00mL。(已知: ,
, )
)①滴定终点的现象为
②忽略流程中的损失,可得铜的浸出率为
更新时间:2024-05-29 20:27:30
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题:
(1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________ 。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N2O5(g)分解反应:
i.2N2O5(g) 4NO2(g)+O2(g)
4NO2(g)+O2(g)
ii.4NO2 2N2O4(g)
2N2O4(g)
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时, N2O5(g)完全分解]:
已知:
2N2O5(g) 2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1
2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1
2NO2(g) N2O4(g) ΔH2=-55.3 kJ·mol-1
N2O4(g) ΔH2=-55.3 kJ·mol-1
①研究表明,N2O5(g)分解的反应速率v=2×10-3×pN2O5(kPa·min-1),t=62 min时,测得体系中pO2=2.9 kPa,则此时的pN2O5=___________ kPa,v=___________ kPa·min-1。
②若提高反应温度至35 ℃,则N2O5(g)完全分解后体系压强p∞(35 ℃)___________ 63.1 kPa(填“大于”“等于”或“小于”),原因是___________ 。
③25 ℃时N2O4(g) = 2NO2(g)反应的平衡常数Kp=___________ kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g) 4NO2(g)+O2(g),R。A.Ogg提出如下反应历程:
4NO2(g)+O2(g),R。A.Ogg提出如下反应历程:
第一步 N2O5 NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3 NO+NO2+O2 慢反应
NO+NO2+O2 慢反应
第三步 NO+NO3 2NO2 快反应
2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是___________(填标号)。
(1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N2O5(g)分解反应:
i.2N2O5(g)
 4NO2(g)+O2(g)
4NO2(g)+O2(g)ii.4NO2
 2N2O4(g)
2N2O4(g)其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时, N2O5(g)完全分解]:
| t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 |  |
| p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
2N2O5(g)
 2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1
2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-12NO2(g)
 N2O4(g) ΔH2=-55.3 kJ·mol-1
N2O4(g) ΔH2=-55.3 kJ·mol-1①研究表明,N2O5(g)分解的反应速率v=2×10-3×pN2O5(kPa·min-1),t=62 min时,测得体系中pO2=2.9 kPa,则此时的pN2O5=
②若提高反应温度至35 ℃,则N2O5(g)完全分解后体系压强p∞(35 ℃)
③25 ℃时N2O4(g) = 2NO2(g)反应的平衡常数Kp=
(3)对于反应2N2O5(g)
 4NO2(g)+O2(g),R。A.Ogg提出如下反应历程:
4NO2(g)+O2(g),R。A.Ogg提出如下反应历程:第一步 N2O5
 NO2+NO3 快速平衡
NO2+NO3 快速平衡第二步 NO2+NO3
 NO+NO2+O2 慢反应
NO+NO2+O2 慢反应第三步 NO+NO3
 2NO2 快反应
2NO2 快反应其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是___________(填标号)。
| A.v(第一步的逆反应)>v(第二步反应) |
| B.反应的中间产物只有NO3 |
| C.第二步中NO2与NO3的碰撞仅部分有效 |
| D.第三步反应活化能较高 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某学习小组对氮的氢化物和氧化物的性质进行了深入的研究。
I. 的性质探究
的性质探究
该小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气与氧化铜反应的产物(装置A是实验室加热氯化铵与氢氧化钙制取氨气的装置)。___________ 。
(2)装置C的作用___________ 。
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是___________ 。
(4)利用改进后的装置进行实验,观察到氧化铜变为红色物质,说明氨气有___________ 性;有同学认为氨气与氧化铜反应生成的红色物质中可能除了铜,还可能含有氧化亚铜,请设计一个简单的实验检验该红色物质中是否含有氧化亚铜___________ 。(已知: 在酸性溶液中,发生反应:
在酸性溶液中,发生反应: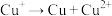 )
)
II. 的性质探究
的性质探究
该小组的同学还设计了如图所示装置,用以制取二氧化氮。并验证二氧化氮能否支持木条燃烧(忽略四氧化二氮的存在,图中铁架台等夹持仪器均已略去)。已知∶硝酸铜受热分解生成氧化铜、二氧化氮和氧气,当温度达到800度时,氧化铜开始分解生成氧化亚铜,至1000度,氧化铜完全分解。___________ (填“正确”或“不正确”,理由是___________ 。
(6)与二氧化氮一定条件下可以反应生成无污染性气体,体现了氨气的还原性,化学方程式为___________ 。
I.
 的性质探究
的性质探究该小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气与氧化铜反应的产物(装置A是实验室加热氯化铵与氢氧化钙制取氨气的装置)。
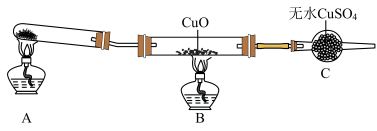
(2)装置C的作用
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(4)利用改进后的装置进行实验,观察到氧化铜变为红色物质,说明氨气有
 在酸性溶液中,发生反应:
在酸性溶液中,发生反应: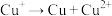 )
)II.
 的性质探究
的性质探究该小组的同学还设计了如图所示装置,用以制取二氧化氮。并验证二氧化氮能否支持木条燃烧(忽略四氧化二氮的存在,图中铁架台等夹持仪器均已略去)。已知∶硝酸铜受热分解生成氧化铜、二氧化氮和氧气,当温度达到800度时,氧化铜开始分解生成氧化亚铜,至1000度,氧化铜完全分解。
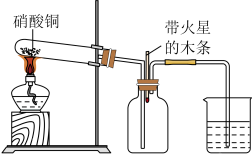
(6)与二氧化氮一定条件下可以反应生成无污染性气体,体现了氨气的还原性,化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学兴趣小组设计了如图装置,该装置能制取 ,并进行相关性质实验,且可利用装置G储存多余的氯气。
,并进行相关性质实验,且可利用装置G储存多余的氯气。

(1)A中发生反应的化学方程式为___________ 。
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①在装置D中能看到的实验现象是___________ 。
②在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为 和HCl,则E中发生反应的化学方程式为
和HCl,则E中发生反应的化学方程式为___________ 。
③装置F中球形干燥管的作用是___________ 。
(3)储气瓶b内盛放的试剂是___________ 。
(4)装置B中 被
被 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(5)装置C中反应的化学方程式为___________ 。
 ,并进行相关性质实验,且可利用装置G储存多余的氯气。
,并进行相关性质实验,且可利用装置G储存多余的氯气。
(1)A中发生反应的化学方程式为
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①在装置D中能看到的实验现象是
②在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为
 和HCl,则E中发生反应的化学方程式为
和HCl,则E中发生反应的化学方程式为③装置F中球形干燥管的作用是
(3)储气瓶b内盛放的试剂是
(4)装置B中
 被
被 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为(5)装置C中反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某工厂利用废催化剂(含 及MnO2等)回收金属铜并制取锌白(
及MnO2等)回收金属铜并制取锌白( )的工艺流程如下:
)的工艺流程如下:

已知:
①
②
请回答下列问题:
(1)为了加快废催化剂酸浸的速率,可以采取的措施是______ (任写一条)。
(2)浸渣的主要成分是______ (填化学式,下同),粗铜粉中含有的杂质是______ 。
(3)“酸浸”过程中生成 ,同时还有氧气逸出,写出
,同时还有氧气逸出,写出 与浓
与浓 反应的化学方程式:
反应的化学方程式:______ 。
(4)“氧化”过程中 被氧化的离子方程式为
被氧化的离子方程式为______ 。
(5)加入氨水调节溶液 时,要使
时,要使 沉淀完全,则应调节溶液
沉淀完全,则应调节溶液 的最小值为
的最小值为______ (结果保留两位小数)(已知:当 时,认为
时,认为 沉淀完全;常温下
沉淀完全;常温下 ;
; )。
)。
(6)在加入氨水“中和、沉淀”的过程中,沉淀的析出率与溶液温度的关系如图所示:

当溶液温度高于 时,
时, 的沉淀率随着温度升高而降低的原因是
的沉淀率随着温度升高而降低的原因是______ 。
 及MnO2等)回收金属铜并制取锌白(
及MnO2等)回收金属铜并制取锌白( )的工艺流程如下:
)的工艺流程如下:
已知:
①

②

请回答下列问题:
(1)为了加快废催化剂酸浸的速率,可以采取的措施是
(2)浸渣的主要成分是
(3)“酸浸”过程中生成
 ,同时还有氧气逸出,写出
,同时还有氧气逸出,写出 与浓
与浓 反应的化学方程式:
反应的化学方程式:(4)“氧化”过程中
 被氧化的离子方程式为
被氧化的离子方程式为(5)加入氨水调节溶液
 时,要使
时,要使 沉淀完全,则应调节溶液
沉淀完全,则应调节溶液 的最小值为
的最小值为 时,认为
时,认为 沉淀完全;常温下
沉淀完全;常温下 ;
; )。
)。(6)在加入氨水“中和、沉淀”的过程中,沉淀的析出率与溶液温度的关系如图所示:

当溶液温度高于
 时,
时, 的沉淀率随着温度升高而降低的原因是
的沉淀率随着温度升高而降低的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】以菱锰矿(主要成分MnCO3,还含有FeCO3、CaCO3、SiO2、Al2O3、Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如图:
已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10、Ksp(MnF2)=5.0×10-3
(1)酸浸时为了提高浸出效率,除升温外,还可以采取____ 措施。
(2)“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用____ (填编号)。
(3)“除杂2”除去的主要离子是____ (填离子符号)。
(4)除MnO2外该流程中可以循环使用的物质是____ 。
(5)工业上采用如图所示的方法获得MnO2,Mn2+将在____ 极(填“C”或“D”)发生反应生成MnO2,电极反应式为____ 。

(6)电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=____ 。已知:H2S的电离常数K1=1.0×10-7,K2=7.0×10-15;Ksp(MnS)=1.4×10-15]

已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10、Ksp(MnF2)=5.0×10-3
(1)酸浸时为了提高浸出效率,除升温外,还可以采取
(2)“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用
| A.Cu | B.CuCO3 | C.NaOH | D.MnCO3 |
(4)除MnO2外该流程中可以循环使用的物质是
(5)工业上采用如图所示的方法获得MnO2,Mn2+将在

(6)电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】一种硫酸镍粗品中含有 、
、 、
、 、
、 、
、 等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。
等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。 ;
;
②部分金属离子(起始浓度为0.1 ,沉淀完全的浓度为
,沉淀完全的浓度为 )生成氢氧化物沉淀的pH范围如下表:
)生成氢氧化物沉淀的pH范围如下表:
回答下列问题:
(1)“水浸”时常适当加热,加热的目的是___________ 。
(2)常温下,X是一种气体,则X、 、
、 中键角从大到小的顺序是
中键角从大到小的顺序是___________ (用化学式表示),其原因是______________ 。
(3)“沉铁”时,总反应的离子方程式为______________ ;其中加入 的作用是调节溶液pH=
的作用是调节溶液pH=___________ (填字母)。
A.1.5 B.4.0 C.6.3 D.6.9
(4)若某次工艺生产中,“沉铁”后,1.0t(体积约为 L)滤液中
L)滤液中 ,“沉钙”后,
,“沉钙”后,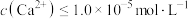 ,则最少加入
,则最少加入___________ g (保留三位有效数字)。
(保留三位有效数字)。
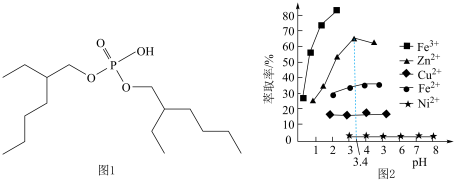
(5)萃取剂P204的结构简式如图1所示,1mol P204中含___________ mol手性碳原子;萃取时,萃取液pH对相关金属离子的影响如图2所示,则最适宜的pH为___________ 。
 、
、 、
、 、
、 、
、 等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。
等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。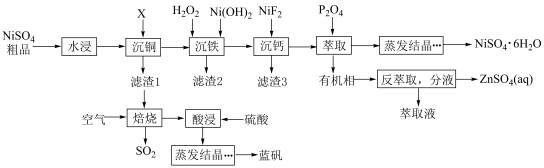
 ;
;②部分金属离子(起始浓度为0.1
 ,沉淀完全的浓度为
,沉淀完全的浓度为 )生成氢氧化物沉淀的pH范围如下表:
)生成氢氧化物沉淀的pH范围如下表:金属离子 |
|
|
|
|
|
|
开始沉淀的pH | 1.5 | 4.2 | 6.2 | 6.3 | 6.9 | 11.8 |
完全沉淀的pH | 2.8 | 6.2 | 8.2 | 8.3 | 8.9 | 13.8 |
(1)“水浸”时常适当加热,加热的目的是
(2)常温下,X是一种气体,则X、
 、
、 中键角从大到小的顺序是
中键角从大到小的顺序是(3)“沉铁”时,总反应的离子方程式为
 的作用是调节溶液pH=
的作用是调节溶液pH=A.1.5 B.4.0 C.6.3 D.6.9
(4)若某次工艺生产中,“沉铁”后,1.0t(体积约为
 L)滤液中
L)滤液中 ,“沉钙”后,
,“沉钙”后,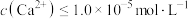 ,则最少加入
,则最少加入 (保留三位有效数字)。
(保留三位有效数字)。(5)萃取剂P204的结构简式如图1所示,1mol P204中含
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】中科大研制出Ni-Mo-O纳米棒复合催化剂,利用其进行尿素电解,可实现富尿素废水的净化,同时低能耗制得H2。总反应为:CO(NH2)2 + H2O 3H2↑ + N2↑ + CO2↑。
3H2↑ + N2↑ + CO2↑。
完成下列填空:
(1)上述反应涉及的元素中,质子数最多的原子其核外电子排布式是___________ ;写出同周期元素的原子半径大小关系____________ (用元素符号表示)。
(2)上述反应物与产物中,属于电解质的是_____________ (填化学式);写出可以冷冻待移植器官的物质的电子式_______________ 。
(3)C与N的非金属性强弱顺序为____________ (用元素符号表示),用一个化学方程式进行证明________________ 。
(4)已知常压下,二氧化硅熔点为1723℃,而干冰在-78.5℃时就升华,解释二者性质差异大的原因___________________ 。
(5)电解富尿素废水时,氢气在____ 极产生。若转移0.3 mol电子,两极产生的气体共__________ L(标准状况)。
 3H2↑ + N2↑ + CO2↑。
3H2↑ + N2↑ + CO2↑。完成下列填空:
(1)上述反应涉及的元素中,质子数最多的原子其核外电子排布式是
(2)上述反应物与产物中,属于电解质的是
(3)C与N的非金属性强弱顺序为
(4)已知常压下,二氧化硅熔点为1723℃,而干冰在-78.5℃时就升华,解释二者性质差异大的原因
(5)电解富尿素废水时,氢气在
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铁能形成多种化合物,如Fe(SCN)3,[Fe(CO)5](羰基铁),它们在生活生产中有广泛应用。
(1)Fe3+基态核外电子排布式为_____ 。
(2)实验室用KSCN溶液、苯酚溶液检验Fe3+.N、O、S的第一电离能由大到小的顺序为____ 。SCN﹣中的碳原子的杂化轨道类型为_____ 。与SCN﹣互为等电子体的分子是_____ 。
(3)羰基铁[Fe(CO)5]可用作催化剂。1mol[Fe(CO)5]分子中含σ键数目为_____ 。
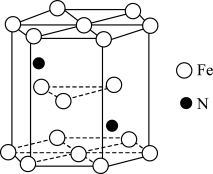
(4)某种氮化铁晶胞的晶体如图所示,该氮化铁晶体的化学式为_____ 。
(1)Fe3+基态核外电子排布式为
(2)实验室用KSCN溶液、苯酚溶液检验Fe3+.N、O、S的第一电离能由大到小的顺序为
(3)羰基铁[Fe(CO)5]可用作催化剂。1mol[Fe(CO)5]分子中含σ键数目为
(4)某种氮化铁晶胞的晶体如图所示,该氮化铁晶体的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F元素的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________ ;基态E元素原子价层电子排布图为___________ 。
(2)A的氢化物A2H4分子属于___________ 分子(填“极性或非极性”);A与B形成的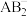 的空间构型为
的空间构型为___________ 。
(3)火箭推动剂由A2H4和H2B2组成,加热反应时有A元素的单质生成,写出该化学反应方程式:___________ 。
(4)酸性条件下,E元素的离子 和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:
和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:___________ 。
(5)元素C和D组成的简单化合物空间构型为___________ ,基态F3+未成对电子数为___________ 个。
(6)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数(边长)为a pm,NA为阿伏加德罗常数的值,则该晶胞的密度为___________ g·cm-3。
(1)A元素单质的结构式为
(2)A的氢化物A2H4分子属于
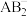 的空间构型为
的空间构型为(3)火箭推动剂由A2H4和H2B2组成,加热反应时有A元素的单质生成,写出该化学反应方程式:
(4)酸性条件下,E元素的离子
 和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:
和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:(5)元素C和D组成的简单化合物空间构型为
(6)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数(边长)为a pm,NA为阿伏加德罗常数的值,则该晶胞的密度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.由三种短周期元素组成的化合物A,按如下流程进行实验。已知相同条件下气态A物质的密度为氢气密度的49.5倍。
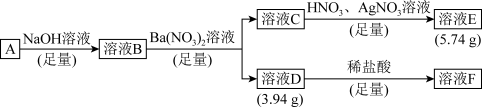
请回答:
(1)组成A的三种元素为__________ ,A的化学式为__________ 。
(2)A与足量NaOH溶液反应的化学方程式为__________ 。
(3)A与足量氨气在一定条件下可以反应生成2种常见的氮肥,该反应的化学方程式为________ 。
Ⅱ.二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于 10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(4)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式为____________ 。
(5)某小组按照文献中制备ClO2的方法,设计了如图所示的实验装置,用于制备ClO2并验证其某些性质。
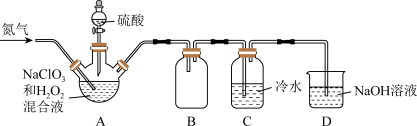
①通入氮气的主要作用有 2 个,一是可以起到搅拌作用,二是____________________ ;
②关于该实验,以下说法正确的是______________ 。
A.装置 A 用适量 H2O2制取 ClO2气体,其反应的化学方程式为2NaClO3+3H2O2+H2SO4=2ClO2↑+Na2SO4+2O2↑+4H2O
B.装置 B 用来收集二氧化氯气体
C.当看到装置 C 中导管液面上升时应加大氮气的通入量
D.二氧化氯能杀菌消毒,但不会与有机物发生取代反应

请回答:
(1)组成A的三种元素为
(2)A与足量NaOH溶液反应的化学方程式为
(3)A与足量氨气在一定条件下可以反应生成2种常见的氮肥,该反应的化学方程式为
Ⅱ.二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于 10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(4)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式为
(5)某小组按照文献中制备ClO2的方法,设计了如图所示的实验装置,用于制备ClO2并验证其某些性质。

①通入氮气的主要作用有 2 个,一是可以起到搅拌作用,二是
②关于该实验,以下说法正确的是
A.装置 A 用适量 H2O2制取 ClO2气体,其反应的化学方程式为2NaClO3+3H2O2+H2SO4=2ClO2↑+Na2SO4+2O2↑+4H2O
B.装置 B 用来收集二氧化氯气体
C.当看到装置 C 中导管液面上升时应加大氮气的通入量
D.二氧化氯能杀菌消毒,但不会与有机物发生取代反应
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】科学家舍勒和戴维对氯气的制取和研究做出了重大贡献。某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气,并模拟工业制漂白粉。请回答下列问题:
Ⅰ.实验室制备和收集氯气的常用装置如下图。
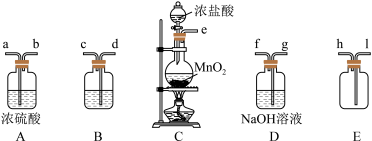
(1)利用该装置制备氯气的离子方程式为___________________________ 。
(2)B中试剂为_________ ,其作用是______________________ 。
(3)实验装置接口的连接顺序为e→______________________ (按气流方向填写)。
(4)实验室除了可用二氧化锰和浓盐酸反应制取氧气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为: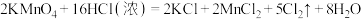 ,该反应中HCl的作用是还原性和
,该反应中HCl的作用是还原性和___________ ,若反应产生0.5mol Cl2,则反应转移的电子数是_______________ 。
Ⅱ.漂白粉的制备(装置如图所示)
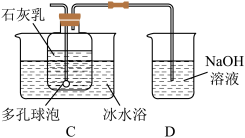
查阅资料可知:
①氯气与碱反应放出热量;
②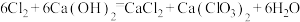 。
。
(5)装置C中发生反应的化学方程式为_______________________ 。
(6)使用冰水浴的目的是_______________________ 。
Ⅰ.实验室制备和收集氯气的常用装置如下图。

(1)利用该装置制备氯气的离子方程式为
(2)B中试剂为
(3)实验装置接口的连接顺序为e→
(4)实验室除了可用二氧化锰和浓盐酸反应制取氧气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为:
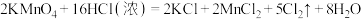 ,该反应中HCl的作用是还原性和
,该反应中HCl的作用是还原性和Ⅱ.漂白粉的制备(装置如图所示)

查阅资料可知:
①氯气与碱反应放出热量;
②
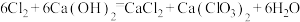 。
。(5)装置C中发生反应的化学方程式为
(6)使用冰水浴的目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。

(1)A装置为CO2的发生装置,其中装稀盐酸的仪器名称是_______ ,A中反应的离子方程式_______ 。
(2)B装置可除去A装置中可能挥发出的HCl,反应的离子方程式为_______ 。
(3)C装置为O2的发生装置,同时该反应生成一种正盐,则反应的化学方程式为_______ 。
(4)D装置的作用_______ ,反应的化学方程式为_______ 。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为:_______ 。

(1)A装置为CO2的发生装置,其中装稀盐酸的仪器名称是
(2)B装置可除去A装置中可能挥发出的HCl,反应的离子方程式为
(3)C装置为O2的发生装置,同时该反应生成一种正盐,则反应的化学方程式为
(4)D装置的作用
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为:
您最近一年使用:0次




