10-11高三·山东聊城·阶段练习
名校
解题方法
1 . 高铁酸钾(K2FeO4)是一种既能杀菌消毒又能絮凝净水的水处理剂。工业制备高铁酸钾反应的离子方程式为Fe(OH)3+ClO-+OH-→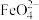 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是
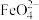 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是| A.上述反应中氧化剂和还原剂的物质的量之比为3:2 |
| B.高铁酸钾中铁显+6价 |
C.由上述反应可知,Fe(OH)3的氧化性强于FeO |
| D.K2FeO4处理水时,不仅能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近一年使用:0次
2023-08-23更新
|
430次组卷
|
26卷引用:2012届山东莘县实验高中高三第三次月考化学试卷
(已下线)2012届山东莘县实验高中高三第三次月考化学试卷2016届北京市通州区潞河中学高三上学期期中测试化学试卷2017届四川省泸州市泸化中学高三上10月月考化学卷新疆生产建设兵团第二中学2017-2018学年高一上学期期中考试化学试题福建省龙海市第二中学2019届高三年级上学期开学考化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第二次调研考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一上学期12月月考化学试题广东省佛山市第一中学2020届高三10月月考化学试题甘肃省武威市第六中学2019-2020学年高一上学期第二次段考化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应福建省永春第一中学2018-2019学年高二下学期期末考试化学试题内蒙古包钢第一中学2020届高三上学期10月月考化学试题山东省潍坊第四中学2021-2022学年高三上学期10月月考化学试题山东省潍坊市昌乐二中2021-2022学年高三10月月考化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)辽宁省沈阳市新民市第一高级中学2021-2022学年高三上学期第二次阶段测试化学试题浙江省杭州地区(含周边)重点中学2022-2023学年高一上学期期中考试化学试卷【2022】【高一上】【杭师大附中】【期中考】【高中化学】【徐外兰收集】(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)(已下线)第二章 单元测试卷黑龙江省黑河市第九中学2023-2024学年高三上学期摸底考试化学试题河北省衡水市武强中学2023-2024学年高一上学期期中考试化学试题河北省石家庄精英中学2023-2024学年高一上学期期中考试化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-20024学年高三上学期第一次月考化学试题河南省郑州市第四高级中学2023-2024学年高一上学期第二次月考 化学试题陕西省兴平市南郊高级中学2023-2024学年高一上学期第三次化学质量检测题
名校
解题方法
2 . 煤燃烧排放的烟气中含有 和
和 ,是大气的主要污染源之一。用
,是大气的主要污染源之一。用 溶液对烟气
溶液对烟气 同时脱硫脱硝(分别生成
同时脱硫脱硝(分别生成 、
、 ,得到
,得到 、
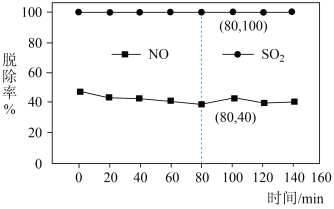
、 )脱除率如图,下列说法不正确的是
)脱除率如图,下列说法不正确的是
 和
和 ,是大气的主要污染源之一。用
,是大气的主要污染源之一。用 溶液对烟气
溶液对烟气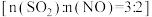 同时脱硫脱硝(分别生成
同时脱硫脱硝(分别生成 、
、 ,得到
,得到 、
、 )脱除率如图,下列说法不正确的是
)脱除率如图,下列说法不正确的是
A.脱除 的反应: 的反应: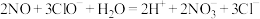 |
B.依据图中信息,在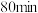 时,吸收液中 时,吸收液中 |
C. 脱除率高于 脱除率高于 的原因可能是 的原因可能是 在水中的溶解度大于 在水中的溶解度大于 |
D.随着脱除反应的进行,吸收剂溶液的 逐渐减小 逐渐减小 |
您最近一年使用:0次
2023-08-16更新
|
163次组卷
|
10卷引用:北京大兴区2020届高三一模考试化学试题
北京大兴区2020届高三一模考试化学试题山东省师范大学附属中学2021届高三上学期第二次考试化学试题河南省三门峡市2021届高三10月阶段性考试化学试题辽宁省丹东市2021届高三上学期10月阶段测试化学试题黑龙江省大庆铁人、鸡西一中、鹤岗一中三校2021届高三上学期联考化学试题(已下线)专项特训2 非金属及其化合物对环境的影响黑龙江省齐齐哈尔市实验中学等3校2022-2023学年高三上学期11月期中考试化学试题山东省滕州市2023-2024学年高三上学期期中考试化学试题河南省周口恒大中学2023-2024学年高一上学期10月月考化学试题北京市顺义区第一中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
3 . 将标准状况下的22.4L SO2通入4mol NaOH溶液中,下列用来解释事实的方程式中不合理的是(已知室温下饱和Na2SO3溶液的pH约为8.3)
A.标准状况下的22.4L SO2通入含4mol NaOH的溶液:2OH-+SO2=SO +H2O +H2O |
B.上述反应后所得溶液的pH约为12:SO +H2O +H2O HSO HSO +OH- +OH- |
C.向上述反应后所得溶液中,通入氯气,pH下降:SO +Cl2+2OH-=SO +Cl2+2OH-=SO +2Cl-+H2O +2Cl-+H2O |
D.向上述反应后所得溶液中,滴加少量H2O2和BaCl2溶液的混合液,产生白色沉淀:SO +Ba2++H2O2=BaSO4↓+H2O +Ba2++H2O2=BaSO4↓+H2O |
您最近一年使用:0次
2023-04-21更新
|
244次组卷
|
2卷引用:北京市中国人民大学附属中学2017-2018学年高三上学期12月月考化学试题
9-10高三·湖南衡阳·阶段练习
名校
解题方法
4 . 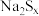 在碱性溶液中可被
在碱性溶液中可被 氧化为
氧化为 ,而
,而 被还原为
被还原为 ,若反应中
,若反应中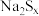 ,与
,与 的物质的量之比为
的物质的量之比为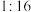 ,则x的值为
,则x的值为
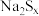 在碱性溶液中可被
在碱性溶液中可被 氧化为
氧化为 ,而
,而 被还原为
被还原为 ,若反应中
,若反应中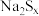 ,与
,与 的物质的量之比为
的物质的量之比为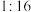 ,则x的值为
,则x的值为| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2023-02-08更新
|
632次组卷
|
36卷引用:湖南省衡阳市第八中学2010届高三年级第五次月考化学试题
(已下线)湖南省衡阳市第八中学2010届高三年级第五次月考化学试题(已下线)2012届高三上学期一轮复习化学单元验收试卷(4)(新人教版)(已下线)2012届黑龙江省大庆实验中学高三上学期期中考试化学试卷(已下线)2011-2012学年湖南衡阳一、八中高一下学期期中联考化学试卷(已下线)2013届河北省邯郸一中高三9月月考化学化学试卷(已下线)2014届浙江省湖州市八校高三上学期第二次联考化学试卷福建省德化一中、永安一中、漳平一中2018届高三上学期三校联考化学试题黑龙江省齐齐哈尔市实验中学2017-2018学年高一上学期期中考试化学试题安徽省六安市霍邱县第二中学2019-2020学年高一上学期段考化学试题辽宁省辽河油田第二高级中学2020届高三12月考试化学试题2019年秋高三化学复习强化练习—— 氧化还原反应(强化练)2020届高三化学二轮复习 氧化还原反应过关检测(强化训练)湖南省岳阳市岳阳楼区岳阳楼市第一中学2020届高三考前模拟理科综合化学试题(已下线)【南昌新东方】2019 南昌五中 高一上期中辽宁省丹东市2020届高三总复习阶段测试化学试题黑龙江省哈尔滨市三中2020届高三第二次月考化学试题辽宁省东北育才学校科学高中部2020-2021学年高一上学期第一学段检测化学试题河南省周口市中英文学校2020-2021学年高三上学期第一次月考化学试题甘肃省张掖市第二中学2020-2021学年高一上学期期中考试化学试题山东省济南市历城第一中学2021届高三上学期10月月考化学试题陕西省宝鸡市千阳县千阳中学2020-2021学年高一上学期期中考试化学试题山西省临汾市县底中学校2020-2021学年高三上学期开学考试化学试题吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练山西省运城市稷山中学2022届高三上学期月考(一)化学试题河北省沧州市第一中学2020-2021学年高一下学期开学测试化学试题陕西省韩城市西庄中学2021-2022学年高三上学期9月月考化学试题江苏省常州市第一中学2021-2022学年高一上学期期中考试化学试题四川省成都市树德中学2021-2022学年高一上学期11月阶段性测试(期中)化学试题重庆市南开中学校2021-2022学年高一上学期阶段性测试化学试题重庆市璧山中学校2021-2022学年高一上学期期中考试化学试题吉林省吉林市第一中学2021-2022学年高二6月月考(平行班)化学试题湖北省武汉中学2022-2023学年高一上学期期中阶段性考试化学试题第一章 化学物质及其变化 第5讲 氧化还原反应的计算与方程式的配平(已下线)题型18 氧化还原反应规律的应用(已下线)专题05 氧化还原反应方程式的配平与计算(一题多问)
名校
解题方法
5 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入
和空气的混合气体通入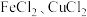 的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是
的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是

 和空气的混合气体通入
和空气的混合气体通入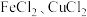 的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是
的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是
A.在图示的转化中, 和 和 是中间产物 是中间产物 |
| B.在图示的转化中,化合价不变的元素只有铜 |
C.图示转化的总反应是 |
D.当有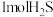 转化为硫单质时,需要消耗 转化为硫单质时,需要消耗 的物质的量为 的物质的量为 |
您最近一年使用:0次
2023-02-01更新
|
595次组卷
|
12卷引用:河南省开封市2020届高三下学期3月模拟考试理综化学试题
河南省开封市2020届高三下学期3月模拟考试理综化学试题辽宁省丹东市2020届高三第一次模拟考试理科综合化学试题江苏省连云港市赣榆区2020届高三高考仿真训练化学试题四川省宜宾市叙州区第二中学校2021届高三上学期阶段二考试理综化学试题人教版2019必修第二册 第五章 第一节综合拔高练四川省广安友谊中学2020-2021学年高一下学期3月月考化学试题辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题重庆市南开中学校2021-2022学年高一下学期3月月考化学试题(已下线)第一部分 二轮专题突破 专题8 常见无机物性质的转化江苏省南京市燕子矶中学2022-2023 学年高一下学期期中考试化学试题广东省广州市第十六中学2022-2023学年高一下学期期中考试化学试题新疆生产建设兵团第一师高级中学2022-2023学年高一下学期3月月考化学试题
6 . 某温度下将Cl₂通入NaOH溶液中,得到NaCl、NaClO、NaClO₃的混合液,经测定 与
与 的离子数目之比为1:3,则Cl₂与NaOH溶液反应时,被还原的Cl与被氧化的Cl的个数之比为
的离子数目之比为1:3,则Cl₂与NaOH溶液反应时,被还原的Cl与被氧化的Cl的个数之比为
 与
与 的离子数目之比为1:3,则Cl₂与NaOH溶液反应时,被还原的Cl与被氧化的Cl的个数之比为
的离子数目之比为1:3,则Cl₂与NaOH溶液反应时,被还原的Cl与被氧化的Cl的个数之比为| A.4:1 | B.11:3 | C.3:1 | D.21:5 |
您最近一年使用:0次
2022-11-12更新
|
150次组卷
|
2卷引用:辽宁省新民市第一高级中学2020-2021学年高一10月月考化学试题
名校
解题方法
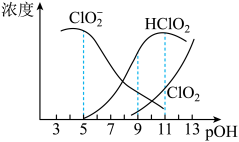
7 . 亚氯酸钠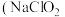 )在溶液中会生成
)在溶液中会生成 、
、 、
、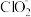 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
,经测定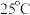 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
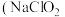 )在溶液中会生成
)在溶液中会生成 、
、 、
、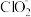 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
,经测定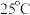 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
A. 的电离平衡常数的数值 的电离平衡常数的数值 |
B. 时, 时,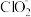 部分转化成 部分转化成 和 和 离子的方程式为: 离子的方程式为: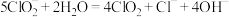 |
C. 时,溶液中含氯微粒的浓度大小为: 时,溶液中含氯微粒的浓度大小为: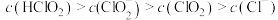 |
D.同浓度 溶液和 溶液和 溶液等体积混合,则混合溶液中有: 溶液等体积混合,则混合溶液中有: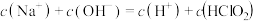 |
您最近一年使用:0次
2022-11-02更新
|
416次组卷
|
9卷引用:辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题
辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题四川省遂宁市2018届高三第一次诊断考试理综化学试题【全国百强校】四川省棠湖中学2019届高三二诊模拟理综-化学试题【全国百强校】四川省棠湖中学2019届高三下学期4月月考理科综合化学试题四川省泸县第四中学2018-2019学年高二下学期下学期期中考试化学试题【懂做原理题】2020届高三化学选修4二轮专题练——电解质溶液中的曲线分析【精编23题】天津市耀华中学2022-2023学年高二上学期期中调研化学试题山东省济南大学城实验高中2021-2022学年高三3月阶段性调研化学试题河南省南阳市第一中学校2022-2023学年高三上学期12月月考化学试题
名校
解题方法
8 . 实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知Fe3+在pH=5时沉淀完全)。其中分析错误的是


| A.步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O |
| B.步骤②可用氯水、硝酸等强氧化剂代替H2O2 |
| C.步骤③用CuCO3代替CuO也可调节溶液的pH |
| D.步骤⑤的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作2~3次 |
您最近一年使用:0次
2022-10-18更新
|
194次组卷
|
18卷引用:2015届湖北省武汉市高三五月模拟考试理综化学试卷
2015届湖北省武汉市高三五月模拟考试理综化学试卷2015-2016学年湖南二校高一理科实验班上联考2化学卷2017届湖南衡阳八中高三实验班暑期第一次月考理综化学2017届江西省上高二中高三上第一次月考(开学考试)化学2016-2017学年云南省临沧一中高二上起点考试化学卷吉林省实验中学2016-2017学年高二下学期第二次月考(5月)化学试题江西省上饶县中学2018届高三上学期第一次月考化学试题四川省成都实验高级中学2020届高三上学期入学考试化学试题江西省上高县第二中学2020届高三上学期第二次月考化学试题江西省上饶市“山江湖”协作体2019-2020学年高一上学期期中联考化学(自主班)试题2019-2020学年人教版高中化学高考基础复习专题10《无机化学基础》测试卷2020届人教版本高三化学第一轮复习第十章《化学实验热点》测试卷2020届高中化学第一轮复习第十章《化学实验热点》测试卷B内蒙古壮族自治区乌兰察布市化德县第一中学2021届高三上学期期中考试化学试题广东省汕头市澄海中学2021届高三上学期第一次学段考试化学试题(已下线)第9周 周测卷-备战2022年高考化学周测与晚练(新高考专用)四川省广安市邻水县二中2022-2023学年高三上学期10月月考化学试题湖北省十堰市部分重点中学2022-2023学年高一下学期5月联考化学试题
名校
解题方法
9 .  具有还原性,加碘食盐中的碘元素主要以
具有还原性,加碘食盐中的碘元素主要以 的形式存在,
的形式存在, 、
、 、
、 在一定条件下可发生如图转化关系。下列说法不正确的是
在一定条件下可发生如图转化关系。下列说法不正确的是
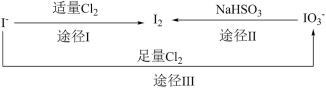
 具有还原性,加碘食盐中的碘元素主要以
具有还原性,加碘食盐中的碘元素主要以 的形式存在,
的形式存在, 、
、 、
、 在一定条件下可发生如图转化关系。下列说法不正确的是
在一定条件下可发生如图转化关系。下列说法不正确的是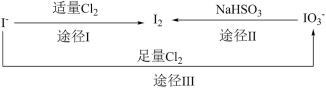
| A.生成等质量的碘,途径I和途径II转移电子数目之比为2∶5 |
B.由图可知氧化性的强弱顺序为 |
C.用淀粉-KI试纸和食醋可检验食盐是否加碘( 遇淀粉呈蓝色) 遇淀粉呈蓝色) |
D.途径Ⅲ反应的离子方程式: |
您最近一年使用:0次
2022-10-12更新
|
611次组卷
|
24卷引用:山东省德州市2019-2020学年高三上学期期末考试化学试题
山东省德州市2019-2020学年高三上学期期末考试化学试题北京市海淀区2020届高三下学期4月联考化学试题(已下线)考点16 非金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编山东省淄博市部分学校2020届高三6月阶段性诊断考试(二模)化学试题山东省德州市夏津第一中学2019-2020学年高一下学期7月月考化学试题(已下线)1.3.4 氧化还原反应方程式的配平-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)【浙江新东方】HZOMO化学002(已下线)练习2 氧化还原反应-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅰ卷)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)微专题07 氧化性和还原性强弱的实验探究及应用-备战2022年高考化学考点微专题(已下线)第10讲 氯及其化合物(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)章末培优 第1章 物质及其变化-2021-2022学年高一化学课后培优练(人教版2019必修第一册)黑龙江省大庆铁人中学2021-2022学年高一上学期第一次月考化学试题(已下线)必考点05 氧化还原反应的规律及综合判断-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)吉林省吉林实验中学2021-2022学年高三上学期第二次诊断测试化学试题(已下线)微专题08 氧化性和还原性强弱的实验探究及应用-备战2023年高考化学一轮复习考点微专题辽宁省实验中学2022-2023学年高一上学期10月月考化学试题辽宁省实验中学2022-2023学年高一上学期10月份阶段测试化学试题湖南省邵阳市第二中学2022-2023学年高二上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高三上学期第一次月考化学试题【精品卷】1.3.2 氧化剂和还原剂课堂例题-人教版2023-2024学年必修第一册陕西省咸阳市实验中学2023-2024学年高一上学期段性检测(一)化学试题
11-12高三上·河南许昌·阶段练习
名校
10 . 亚硝酸钠( )具有致癌作用,许多腌制食品中含
)具有致癌作用,许多腌制食品中含 。酸性
。酸性 溶液与亚硝酸钠反应的离子反应为
溶液与亚硝酸钠反应的离子反应为 (未配平)。下列叙述错误的是
(未配平)。下列叙述错误的是
 )具有致癌作用,许多腌制食品中含
)具有致癌作用,许多腌制食品中含 。酸性
。酸性 溶液与亚硝酸钠反应的离子反应为
溶液与亚硝酸钠反应的离子反应为 (未配平)。下列叙述错误的是
(未配平)。下列叙述错误的是A.生成1mol ,转移5mol电子 ,转移5mol电子 |
| B.该反应中氮元素被氧化 |
| C.该反应氧化产物与还原产物的物质的量之比为2∶5 |
D.配平后, 的化学计量数为3 的化学计量数为3 |
您最近一年使用:0次
2022-09-23更新
|
336次组卷
|
7卷引用:2012届河南省长葛市第三实验高中高三上学期第二次考试化学试卷



