名校
解题方法
1 . 已知Mn2O 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是
 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是| A.+2 | B.+4 | C.+3 | D.+6 |
您最近一年使用:0次
2022-02-28更新
|
850次组卷
|
36卷引用:广东省2020年普通高中学业水平考试化学合格性考试模拟试题(七)
广东省2020年普通高中学业水平考试化学合格性考试模拟试题(七)广东省珠海市第二中学2019-2020学年高一上学期期中考试化学试题广东省中山纪念中学2019-2020学年高一上学期第二次段考化学试题广东省湛江市第四中学2020-2021学年高一上学期期中考试化学试题河南省安阳市第三十六中学2017-2018学年高一上学期期中考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期开学考试化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用陕西省汉中市龙岗学校2019-2020学年高一上学期期末考试化学试题(已下线)【南昌新东方】江西省九江一中2013-2014学年高一上学期期中考试化学试题山东省济宁市邹城兖矿一中2020-2021学年度高一9月月考化学试题吉林公主岭范家屯一中2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】30湖南省岳阳市楚雄中学2020-2021学年高一上学期期中考试化学试题北京市铁路第二中学2020-2021学年高一上学期期中考试化学试题(已下线)【南昌新东方】9. 2020 高一上 铁路一中 刘惠文 钟欣(已下线)【浙江新东方】双师 (55)宁夏青铜峡市高级中学2020-2021学年高一12月月考化学试题河北衡水市第十四中学2020-2021学年高一上学期三调考试化学试题河北省衡水市武邑武罗学校2020-2021学年高一上学期期中考试化学试题河北省衡水市武强中学2020-2021学年高一上学期第一次月考化学试题黑龙江省鸡西市第一中学2020-2021学年高一上学期第一次月考化学试题广东省梅州市兴宁市叶塘中学2021-2022学年高一上学期摸底考试化学试题云南省昆明市第八中学2020-2021学年高一上学期期中考试化学试题天津市滨海新区2020-2021学年高一上学期期末考试化学试题新疆巴音郭楞蒙古自治州第二中学2021届高三上学期第一次摸底考试化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期竞赛化学试题四川省成都市第七中学2021-2022学年高一上学期期中考试化学试题四川省攀枝花市第十五中学校2021-2022学年高一上学期期中考试化学试题安徽省安庆市第十中学2021-2022学年高一上学期10月月考化学试题江苏省宿迁市泗阳县实验高级中学2021-2022学年高一上学期第二次调研测试化学试题浙江省绿谷联盟2022-2023学年高一上学期10月份考试化学试题 黑龙江省鹤岗市第一中学2022-2023学年高一上学期10月月考化学试题山西省晋城市第一中学校2022-2023学年高一上学期第二次调研考试化学试题四川省仁寿县铧强中学2021-2022学年高一上学期半期考试化学试题(已下线)专题七 氧化还原反应天津市宁河区2023-2024学年高一上学期期末考试化学试题
名校
解题方法
2 . 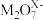 与S2-能在酸性溶液中反应:
与S2-能在酸性溶液中反应: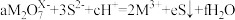 ,则
,则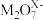 中M的化合价为
中M的化合价为
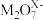 与S2-能在酸性溶液中反应:
与S2-能在酸性溶液中反应: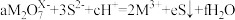 ,则
,则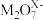 中M的化合价为
中M的化合价为| A.+4 | B.+5 | C.+6 | D.+7 |
您最近一年使用:0次
2021-11-04更新
|
268次组卷
|
13卷引用:2016-2017学年广东省普宁一中高二上第二次月考化学试卷
2016-2017学年广东省普宁一中高二上第二次月考化学试卷(已下线)2011-2012学年河北省衡水中学高一上学期期末考试化学试卷(已下线)2013-2014山西省大同一中高一12月月考化学试卷2014-2015四川省广安市高一期末考试化学试卷2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷2015-2016学年甘肃省会宁一中高一上期末考试化学试卷2016-2017学年安徽省六安一中高一上阶段测二化学卷黑龙江省哈尔滨市第六中学2017-2018学年高一上学期期中考试化学试题【市级联考】河南省信阳市2018-2019学年高一上学期期中联考化学试题【全国百强校】湖北省孝感市高级中学2018-2019学年高一上学期期中考试化学试题黑龙江省大庆市第一中学高中化学必修一第二章 第三节 氧化还原第3课时(习题课)山西省应县第一中学2021-2022学年高一第二次月考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题
13-14高二上·广东·期中
名校
3 . KI淀粉溶液在酸性条件下能与氧气反应。现有以下实验记录:
回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)该实验的目的是___________ 。
(3)实验试剂除了1 KI溶液、0.1
KI溶液、0.1 H2SO4溶液外,还需要的试剂是
H2SO4溶液外,还需要的试剂是___________ ,实验现象为___________ 。
(4)实验操作中除了需要上述条件外,还必须控制___________ (填字母)不变。
A.温度B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是___________ 。
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的实验方案是___________ 。
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为
(2)该实验的目的是
(3)实验试剂除了1
 KI溶液、0.1
KI溶液、0.1 H2SO4溶液外,还需要的试剂是
H2SO4溶液外,还需要的试剂是(4)实验操作中除了需要上述条件外,还必须控制
A.温度B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的实验方案是
您最近一年使用:0次
2021-10-19更新
|
147次组卷
|
21卷引用:2013-2014学年广东省执信中学高二上学期期中考试理科化学试卷
(已下线)2013-2014学年广东省执信中学高二上学期期中考试理科化学试卷广东省揭阳市惠来县第一中学2019-2020学年高二上学期第一次阶段考试化学试题2015-2016学年安徽师大附中高二下期中化学试卷江西省赣县三中2018-2019学年高二上学期9月月考化学试题【校级联考】安徽省定远重点中学2018-2019学年高二下学期开学考试化学试题2019年10月21日《每日一题》2019-2020学年高二化学人教选修4——化学反应速率的实验探究山西省阳泉市2019-2020学年高二上学期期末考试化学试题(已下线)2.2+影响化学反应速率的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)陕西省汉中市五校2020-2021学年高二上学期第一次月考化学试题四川省凉山宁南中学2019-2020学年高二上学期第一次月考化学试题云南省新平县一中2020-2021学年高二下学期期中考试化学试题福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)云南省丘北县第一中学2021-2022学年高二下学期3月份考试 化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题(已下线)2.3.3 化学反应速率综合分析-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)四川省广元市八二一中学2021-2022学年高二上学期期中考试化学试题云南省广南县二中2021-2022年学年高二下学期开学考试化学试题云南省楚雄第一中学2022-2023学年高二下学期期末考试化学试题安徽省滁州市定远县第三中学等2校2022-2023学年高二上学期12月月考化学试题(已下线)专题03 化学反应速率及影响因素、活化能【考题猜想】(9大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)(已下线)考向21 化学反应速率及影响因素-备战2022年高考化学一轮复习考点微专题
名校
4 . 碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如下:
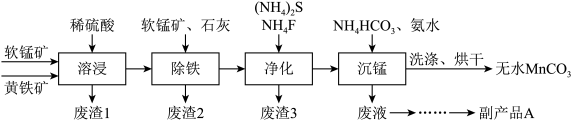
已知:几种金属离子沉淀的pH如下表:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有___________ (至少2条)。
(2)请写出“溶浸”过程中反应的离子方程式:___________ 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。请写出除去Cu2+的离子方程式:___________ 。若测得滤液中c(Fˉ)=0.01mol·Lˉ1,则滤液中残留c(Ca2+)=___________ mol·Lˉ1.[已知:Ksp(CaF2)=1.5×10ˉ10]
(4)除铁工序中,先加入适量的软锰矿,其作用是___________ ,再加入石灰调节溶液的pH的范围为___________ 。
(5)副产品A的主要成分是___________ 。

已知:几种金属离子沉淀的pH如下表:
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有
(2)请写出“溶浸”过程中反应的离子方程式:
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。请写出除去Cu2+的离子方程式:
(4)除铁工序中,先加入适量的软锰矿,其作用是
(5)副产品A的主要成分是
您最近一年使用:0次
2021-10-09更新
|
719次组卷
|
4卷引用:广东省梅州市梅州中学2021-2022学年高二上学期11月段考化学试题
名校
解题方法
5 . 硼酸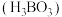 在食品、医药领域应用广泛。
在食品、医药领域应用广泛。
(1)硼在元素周期表中的位置_______
(2)请完成 气体与水反应的化学方程式:
气体与水反应的化学方程式:
_______
(3)在其他条件相同时,反应 中,
中, 的转化率
的转化率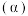 在同温度下随反应时间
在同温度下随反应时间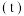 的变化见图,由此可得出:
的变化见图,由此可得出:

①温度对该反应的反应速率和平衡移动的影响是_______
②该反应的
_______ 0(填“<”“=”或“>”)。
(4) 溶液中存在如下反应:
溶液中存在如下反应: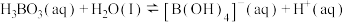 ,已知
,已知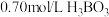 溶液中,上述反应于
溶液中,上述反应于 达到平衡时,
达到平衡时,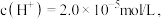
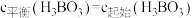 ,水的电离可忽略不计,此温度下该反应的平衡常数
,水的电离可忽略不计,此温度下该反应的平衡常数
_______ ( 的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。
的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。
(5)已知室温下, 的电离常数为
的电离常数为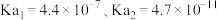 。向盛有饱和硼酸溶液的试管中,滴加
。向盛有饱和硼酸溶液的试管中,滴加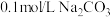 溶液,
溶液,_______ (填“能”或“不能”)观察到气泡逸出。
(6) 与足量
与足量 溶液反应的离子方程式为
溶液反应的离子方程式为_______
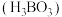 在食品、医药领域应用广泛。
在食品、医药领域应用广泛。(1)硼在元素周期表中的位置
(2)请完成
 气体与水反应的化学方程式:
气体与水反应的化学方程式:
(3)在其他条件相同时,反应
 中,
中, 的转化率
的转化率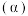 在同温度下随反应时间
在同温度下随反应时间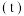 的变化见图,由此可得出:
的变化见图,由此可得出:
①温度对该反应的反应速率和平衡移动的影响是
②该反应的

(4)
 溶液中存在如下反应:
溶液中存在如下反应: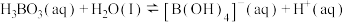 ,已知
,已知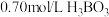 溶液中,上述反应于
溶液中,上述反应于 达到平衡时,
达到平衡时,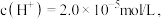
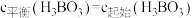 ,水的电离可忽略不计,此温度下该反应的平衡常数
,水的电离可忽略不计,此温度下该反应的平衡常数
 的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。
的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。(5)已知室温下,
 的电离常数为
的电离常数为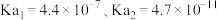 。向盛有饱和硼酸溶液的试管中,滴加
。向盛有饱和硼酸溶液的试管中,滴加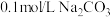 溶液,
溶液,(6)
 与足量
与足量 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
名校
6 . 某实验小组利用 酸性溶液与
酸性溶液与 溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用
溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用 溶液均已加入
溶液均已加入 ):通过测定
):通过测定 溶液褪色所需时间的多少来比较化学反应速率,为了探究
溶液褪色所需时间的多少来比较化学反应速率,为了探究 与
与 浓度对反应速率的影响,某同学在室温下完成以下实验。
浓度对反应速率的影响,某同学在室温下完成以下实验。
(1)该反应的离子方程式为_______ 。
(2)X=_______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是:_______ 。
(3)2号反应中, 的反应速率为
的反应速率为_______ 。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
结合实验目的与表中数据,你得出的结论是_______ 。
(5)从影响化学反应速率的因素看,你的猜想还可能是_______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是_______ 填字母)。
A.硫酸钾B.水C.二氧化锰D.硫酸锰
 酸性溶液与
酸性溶液与 溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用
溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用 溶液均已加入
溶液均已加入 ):通过测定
):通过测定 溶液褪色所需时间的多少来比较化学反应速率,为了探究
溶液褪色所需时间的多少来比较化学反应速率,为了探究 与
与 浓度对反应速率的影响,某同学在室温下完成以下实验。
浓度对反应速率的影响,某同学在室温下完成以下实验。| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
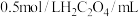 | 5 | 10 | 10 | 5 |
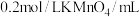 | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | - |
(2)X=
(3)2号反应中,
 的反应速率为
的反应速率为(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
(5)从影响化学反应速率的因素看,你的猜想还可能是
A.硫酸钾B.水C.二氧化锰D.硫酸锰
您最近一年使用:0次
2021-09-22更新
|
716次组卷
|
5卷引用:天津市新华中学2020-2021学年高二上学期第一次月考化学试题
解题方法
7 . 钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等]。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如图:
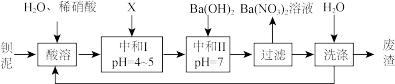
(1)酸溶后溶液的pH=1,Ba(FeO2)2与HNO3反应的化学方程式为___ 。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是___ ;___ 。
(3)该厂结合本厂实际,选用的X为__ (填化学式);中和I使溶液中___ 离子符号)的浓度减小(中和I引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是___ 。
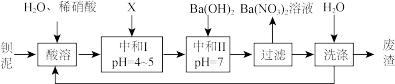
(1)酸溶后溶液的pH=1,Ba(FeO2)2与HNO3反应的化学方程式为
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
(3)该厂结合本厂实际,选用的X为
(4)上述流程中洗涤的目的是
您最近一年使用:0次
解题方法
8 . 下列反应方程式中,书写正确的是
| A.C6H12O6+9O2=6H2O+ 6CO2↑ |
| B.5FeCl2+8HCl+KMnO4=5FeCl3+MnCl2+4H2O |
| C.AgNO3 + K2CrO4 = Ag2CrO4↓+ 2 KNO3 |
| D.Na2SO4 + Ba(NO3)2 = BaSO4↓+ 2 NaNO3 |
您最近一年使用:0次
解题方法
9 . 钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、CaO和SiO2等杂质)来制备,其工艺流程如下:

请回答下列问题:
(1)已知FeTiO3与盐酸反应后有TiOCl 生成, 写出该反应的离子方程式
生成, 写出该反应的离子方程式______ 。
(2)流程中的“氧化剂”最好选用什么试剂?为什么______ ?
(3)写出由FePO4制备LiFePO4的化学反应方程式______ 。
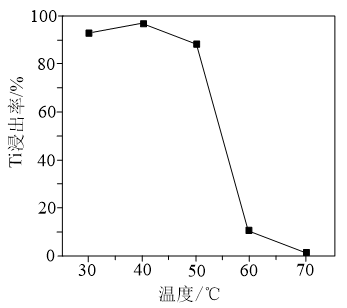
(4)用双氧水和氨水溶解TiO2固体时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降,为什么______ ?
(5)过氧化钛酸锂Li2Ti5O15为一种配合物,请分析说明其中的过氧键(O- O)数目有多少_____ 个。
(6)“浸出”步骤中,温度对铁、钛的浸出效果如下图所示:
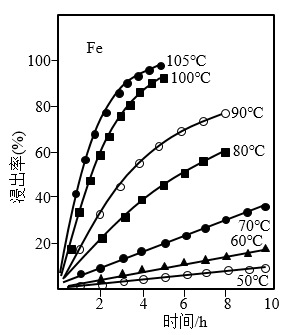

总结温度的影响规律:温度对铁和钛浸出效果的影响相似。请另写出两条规律_____ 。
(7) 25 °C 下,已知FePO4、Ca3(PO4)2与Mg3(PO4)2的标准溶度积常数K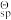 (简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K
(简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K (简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成
(简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成_____ ?
(8)若采用钛酸锂和磷酸亚铁锂作电极组成电池,充电时发生反应为:Li4Ti5O12 + LiFePO4 = Li4+xTi5O12 +Li 1-xFePO4 (0<x<1),请写出该电池放电时的阳极反应方程式_____ 。

请回答下列问题:
(1)已知FeTiO3与盐酸反应后有TiOCl
 生成, 写出该反应的离子方程式
生成, 写出该反应的离子方程式(2)流程中的“氧化剂”最好选用什么试剂?为什么
(3)写出由FePO4制备LiFePO4的化学反应方程式
(4)用双氧水和氨水溶解TiO2固体时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降,为什么

(5)过氧化钛酸锂Li2Ti5O15为一种配合物,请分析说明其中的过氧键(O- O)数目有多少
(6)“浸出”步骤中,温度对铁、钛的浸出效果如下图所示:


总结温度的影响规律:温度对铁和钛浸出效果的影响相似。请另写出两条规律
(7) 25 °C 下,已知FePO4、Ca3(PO4)2与Mg3(PO4)2的标准溶度积常数K
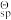 (简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K
(简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K (简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成
(简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成(8)若采用钛酸锂和磷酸亚铁锂作电极组成电池,充电时发生反应为:Li4Ti5O12 + LiFePO4 = Li4+xTi5O12 +Li 1-xFePO4 (0<x<1),请写出该电池放电时的阳极反应方程式
您最近一年使用:0次
10 . 钯(Pd)是一种不活泼金属,性质与铂相似。含钯催化剂不仅在科研和工业生产中用途广泛,而且用量大,因此从废催化剂中回收钯具有巨大的经济效益。已知某废催化剂的主要成分是钯和活性炭,还含有少量铁、镁、铝、硅、铜等杂质元素,提取海绵钯的工艺流程如下:
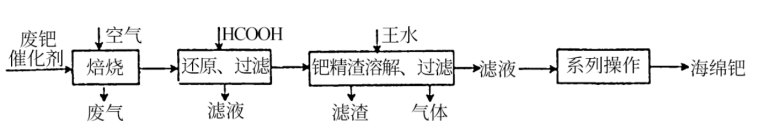
(1)Pd的价电子排布式为4d10,指出它在元素周期表中的位置_______ 。
(2)“焙烧”步骤中,通入的空气一定要足量,理由是_______ 。
(3)写出甲酸还原过程发生反应的化学方程式_______ 。
(4)钯在王水中溶解生成化合物X(由3种元素组成)、种无色有毒的气体Y和水。
①如何配置王水_______ 。
②写出钯与王水反应的化学方程式_______ 。
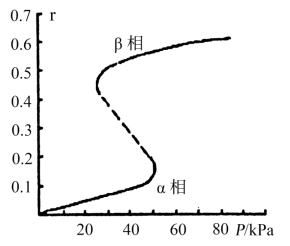
(5)金属钯具有显著的吸氢性能,其密度为12.0g·cm-3。
①在标准状况下,海绵钯吸收氢气的体积约为其体积的840倍,求海绵钯的吸附容量R=_______ (mL·g-1)、氢气的浓度r=_______ (1molPd吸收氢气的物质的量)。
②金属钯中,氢气的r与压强之间的变化关系如图所示,试解释该图的变化趋势_______ 。
(相对原子质量:Pd106.4,理想气体常数R=8.314J·mol-l·K-1)

(1)Pd的价电子排布式为4d10,指出它在元素周期表中的位置
(2)“焙烧”步骤中,通入的空气一定要足量,理由是
(3)写出甲酸还原过程发生反应的化学方程式
(4)钯在王水中溶解生成化合物X(由3种元素组成)、种无色有毒的气体Y和水。
①如何配置王水
②写出钯与王水反应的化学方程式
(5)金属钯具有显著的吸氢性能,其密度为12.0g·cm-3。
①在标准状况下,海绵钯吸收氢气的体积约为其体积的840倍,求海绵钯的吸附容量R=
②金属钯中,氢气的r与压强之间的变化关系如图所示,试解释该图的变化趋势

(相对原子质量:Pd106.4,理想气体常数R=8.314J·mol-l·K-1)
您最近一年使用:0次



