1 . 与氮元素同主族的磷元素化合物有如下反应,其中反应物有:PH3、H2SO4、KClO3;生成物有:K2SO4、H3PO4、H2O和一种未知物质X。
(1)已知KClO3在反应中得到电子,则该反应的还原剂是___________ ,被氧化的元素是___________ 。
(2)已知0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式为___________ 。
(3)完成并配平上述反应的化学方程式,标出电子转移方向和数目。___________
___________PH3+___________H2SO4+___________KClO3=___________K2SO4+___________H3PO4+___________H2O+___________
(4)根据上述反应可推知___________。
(5)在该反应中转移电子2mol时,生成H3PO4___________ mol。
(1)已知KClO3在反应中得到电子,则该反应的还原剂是
(2)已知0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式为
(3)完成并配平上述反应的化学方程式,标出电子转移方向和数目。
___________PH3+___________H2SO4+___________KClO3=___________K2SO4+___________H3PO4+___________H2O+___________
(4)根据上述反应可推知___________。
| A.氧化性:KClO3 > H3PO4 | B.氧化性:KClO3 > H2O |
| C.还原性:PH3 > X | D.还原性:PH3 > K2SO4 |
您最近一年使用:0次
2 .  在工业上有广泛的用途。以硫铁矿(主要成分为
在工业上有广泛的用途。以硫铁矿(主要成分为 )为原料制备
)为原料制备 的工艺流程如下图:
的工艺流程如下图:_______ (写出一种)。
(2)“操作”在实验室的名称为_______ ,需用到的玻璃仪器是_______ 、玻璃棒和烧杯。
(3)黄铁矿焙烧后得到的主要固体为 ,写出“焙烧”的化学方程式为
,写出“焙烧”的化学方程式为_______ 。
(4)“……”表示的操作为在_______ 气流中蒸发浓缩、_______ 、过滤。
(5)为防治 引起的污染,某工厂设计了新的治污方法,同时可得到化工产品
引起的污染,某工厂设计了新的治污方法,同时可得到化工产品 。该工艺流程如图所示,过程中起催化作用的物质是
。该工艺流程如图所示,过程中起催化作用的物质是_______ ,生成化工产品 的化学方程式为
的化学方程式为_______ 。 生产硫酸。用
生产硫酸。用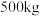 含
含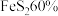 的硫铁矿,生产过程中硫损失
的硫铁矿,生产过程中硫损失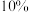 ,则可得
,则可得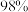 的硫酸
的硫酸_______  。
。
 在工业上有广泛的用途。以硫铁矿(主要成分为
在工业上有广泛的用途。以硫铁矿(主要成分为 )为原料制备
)为原料制备 的工艺流程如下图:
的工艺流程如下图: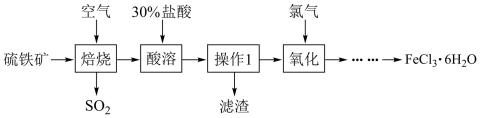
(2)“操作”在实验室的名称为
(3)黄铁矿焙烧后得到的主要固体为
 ,写出“焙烧”的化学方程式为
,写出“焙烧”的化学方程式为(4)“……”表示的操作为在
(5)为防治
 引起的污染,某工厂设计了新的治污方法,同时可得到化工产品
引起的污染,某工厂设计了新的治污方法,同时可得到化工产品 。该工艺流程如图所示,过程中起催化作用的物质是
。该工艺流程如图所示,过程中起催化作用的物质是 的化学方程式为
的化学方程式为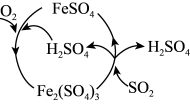
 生产硫酸。用
生产硫酸。用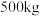 含
含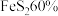 的硫铁矿,生产过程中硫损失
的硫铁矿,生产过程中硫损失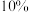 ,则可得
,则可得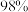 的硫酸
的硫酸 。
。
您最近一年使用:0次
名校
解题方法
3 . 磷酸锌[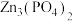 ]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示: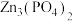 在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
(1)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是___________ (填一条)。
(2)加入H2O2的作用___________
(3)经过滤2得到滤渣的主要成分是 和
和 ,则用NaOH溶液调节pH的范围是
,则用NaOH溶液调节pH的范围是___________ 。
(4)加入Na2HPO4溶液发生反应的离子方程式为___________ 。
(5)洗涤磷酸锌沉淀时应选用___________ (填“冷水”或“热水”),确认磷酸锌洗涤干净的操作是___________ 。
(6)通入H2S是为了除铜离子,25℃时,当通入H2S达到饱和时测得溶液的pH=1,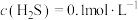 ,此时溶液中
,此时溶液中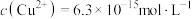 ,则CuS的溶度积
,则CuS的溶度积
___________ (已知:25℃时,H2S的电离平衡常数 ,
, )。
)。
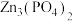 ]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示: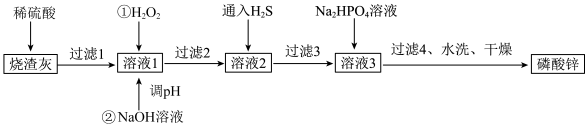
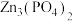 在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
在水中几乎不溶,其在水中的溶解度随温度的升高而降低;②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(1)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是
(2)加入H2O2的作用
(3)经过滤2得到滤渣的主要成分是
 和
和 ,则用NaOH溶液调节pH的范围是
,则用NaOH溶液调节pH的范围是(4)加入Na2HPO4溶液发生反应的离子方程式为
(5)洗涤磷酸锌沉淀时应选用
(6)通入H2S是为了除铜离子,25℃时,当通入H2S达到饱和时测得溶液的pH=1,
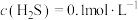 ,此时溶液中
,此时溶液中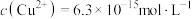 ,则CuS的溶度积
,则CuS的溶度积
 ,
, )。
)。
您最近一年使用:0次
名校
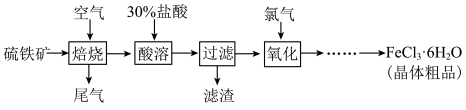
4 . 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:___________ ,检验氧化生成的阳离子的试剂是___________ 。
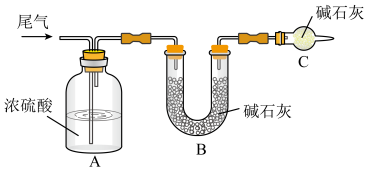
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气VL测定SO2含量:
方案一:让尾气缓慢通过以下装置。___________ ,该装置的作用是___________ 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理___________ (填“是”或“否”)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是___________ 。
②进行沉淀洗涤的方法是___________ 。
③SO2含量的表达式是___________ (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3·6H2O晶体的操作包括___________ 、冷却结晶、过滤,该过程需保持盐酸过量,抑制Fe3+水解。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气VL测定SO2含量:
方案一:让尾气缓慢通过以下装置。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是
②进行沉淀洗涤的方法是
③SO2含量的表达式是
(3)从FeCl3溶液中得到FeCl3·6H2O晶体的操作包括
您最近一年使用:0次
名校
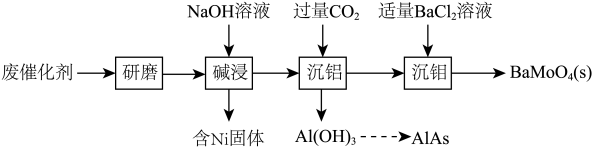
5 . 一种回收利用某废催化剂[主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物]中Al、Mo的工艺流程如下:
(1)“研磨”的目的是_______ 。
(2)“碱浸”中,有 生成,其中Mo元素的化合价为
生成,其中Mo元素的化合价为_______ 。
(3)“沉铝”中,发生反应的离子方程式为_______ 。“沉钼”中,发生反应的离子方程式为_______ 。
(4)“沉钼”后所得滤液中主要存在的钠盐有NaCl和Y,Y受热分解可制得纯碱,Y为______ 。
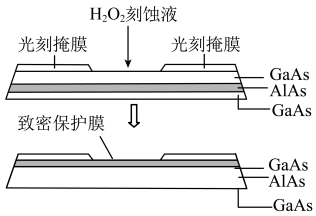
(5)高纯AIAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示。 与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为
与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为_______ 。
②图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层GaAs反应,该氧化物为
刻蚀液与下层GaAs反应,该氧化物为_____ 。
(1)“研磨”的目的是
(2)“碱浸”中,有
 生成,其中Mo元素的化合价为
生成,其中Mo元素的化合价为(3)“沉铝”中,发生反应的离子方程式为
(4)“沉钼”后所得滤液中主要存在的钠盐有NaCl和Y,Y受热分解可制得纯碱,Y为
(5)高纯AIAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示。
 与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为
与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为②图中所示致密保护膜为一种氧化物,可阻止
 刻蚀液与下层GaAs反应,该氧化物为
刻蚀液与下层GaAs反应,该氧化物为
您最近一年使用:0次
名校
解题方法
6 . 水处理:水是身体的重要组成部分,具有重要的生理功能。河流湖泊水是人类用水的主要来源,但使用前需要经过净化处理。
(1)常见的水处理剂包括氯气、臭氧、漂白粉、活性炭等,游泳场馆常用臭氧、活性炭对游泳池进行消毒和净化。下列说法错误的是_______。
(2)明矾溶于水可以得到 胶体,明矾能用于净水的原因是胶体具有
胶体,明矾能用于净水的原因是胶体具有_______ 。现将此法制得的 胶体装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
胶体装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明 能够透过半透膜:
能够透过半透膜:_______ 。
(3)亚氯酸钠( )是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出
)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出 ,
, 有类似
有类似 的性质。某兴趣小组探究亚氯酸钠的制备。
的性质。某兴趣小组探究亚氯酸钠的制备。
①关闭止水夹②,打开止水夹①,从进气口通入足量 ,充分反应。仪器a的名称为
,充分反应。仪器a的名称为_______ ,仪器b的作用是_______ 。
②装置A中生成 的化学方程式为
的化学方程式为_______ ,B中的现象为_______ 。
③若从装置A反应后的溶液中获得 晶体,则主要操作有:减压蒸发浓缩、
晶体,则主要操作有:减压蒸发浓缩、_______ 、过滤、洗涤、干燥等。
(1)常见的水处理剂包括氯气、臭氧、漂白粉、活性炭等,游泳场馆常用臭氧、活性炭对游泳池进行消毒和净化。下列说法错误的是_______。
| A.臭氧、活性炭处理水的原理不同 |
| B.用氯气消毒后的水,可用于配制各种化学试剂 |
| C.用漂白粉漂白时,向其中滴入浓盐酸或通入二氧化碳可以增强漂白效果 |
| D.漂白粉长期露置在空气中会失效 |
(2)明矾溶于水可以得到
 胶体,明矾能用于净水的原因是胶体具有
胶体,明矾能用于净水的原因是胶体具有 胶体装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
胶体装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明 能够透过半透膜:
能够透过半透膜:(3)亚氯酸钠(
 )是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出
)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出 ,
, 有类似
有类似 的性质。某兴趣小组探究亚氯酸钠的制备。
的性质。某兴趣小组探究亚氯酸钠的制备。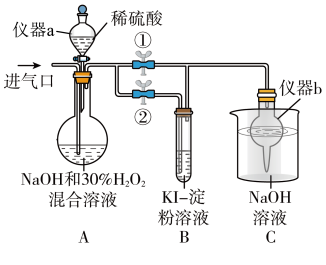
①关闭止水夹②,打开止水夹①,从进气口通入足量
 ,充分反应。仪器a的名称为
,充分反应。仪器a的名称为②装置A中生成
 的化学方程式为
的化学方程式为③若从装置A反应后的溶液中获得
 晶体,则主要操作有:减压蒸发浓缩、
晶体,则主要操作有:减压蒸发浓缩、
您最近一年使用:0次
名校
7 . 回答下列问题
(1)现有以下物质:a.NaOH溶液,b.液氨,c.Ba(OH)2固体,d.NaHSO4,e.Fe(OH)3胶体,f.铜,g.CO2,h.CH3COOH。
①以上物质中属于电解质的是___________ (填字母)。
②写出d在熔融时的电离方程式:___________ 。
③在d的水溶液中加入过量c的水溶液,发生反应的离子方程式为___________ 。
(2)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4,再用KMnO4溶液滴定。
①高锰酸钾(硫酸酸化)溶液和草酸溶液的反应的化学方程式为:___________ ;
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是___________ 。
(3)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________ 。
(4)①钢铁在自然界中发生电化学腐蚀时的负极反应式为___________ ;
②碱性条件下,甲醇空气燃料电池的负极反应式为___________ 。
(1)现有以下物质:a.NaOH溶液,b.液氨,c.Ba(OH)2固体,d.NaHSO4,e.Fe(OH)3胶体,f.铜,g.CO2,h.CH3COOH。
①以上物质中属于电解质的是
②写出d在熔融时的电离方程式:
③在d的水溶液中加入过量c的水溶液,发生反应的离子方程式为
(2)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4,再用KMnO4溶液滴定。
①高锰酸钾(硫酸酸化)溶液和草酸溶液的反应的化学方程式为:
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是
(3)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为
(4)①钢铁在自然界中发生电化学腐蚀时的负极反应式为
②碱性条件下,甲醇空气燃料电池的负极反应式为
您最近一年使用:0次
名校
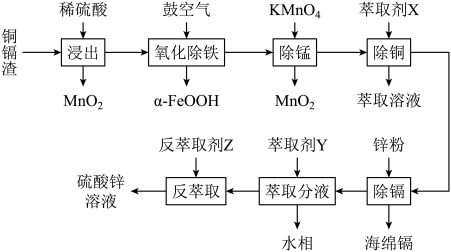
8 . 某铜镉渣的主要成分为单质Zn、ZnSO4以及铜、镉(Cd)、铁、钴(Co)等金属单质或它们的氧化物。某同学以其为原料设计如图工艺流程回收铜、镉、铁、钴。
(1)“浸出”过程生成大量气体是___________ (填化学式),写出一种提高“浸出”效率和浸出率的措施:___________ 。
(2)“氧化除铁”原理是空气中的氧气将浸出液中的Fe2+氧化为α-FeOOH,写出该反应的离子方程式:___________ 。
(3)“除锰”时,参加反应的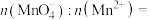
___________ 。
(4)若在实验室进行萃取“除铜”,所必须用到的仪器是___________ ,萃取前对仪器进行的操作是___________ ,放液时,上层液体由___________ (填“上口”或“下口”)倒(放)出。
(5)水相中主要含Co2+,经检测c(Co2+)=0.01mol·L-1。向水相通入氨气调节pH=___________ 时,水相中Co2+沉淀完全(已知常温下,Ksp[Co(OH)2]=1.0×10-15;溶液中c(Co2+)=1×10-5mol·L-1视为沉淀完全)。
(6)控制一定条件,用惰性电极电解ZnSO4溶液可制备单质锌,电解时阳极反应式为___________ 。
(1)“浸出”过程生成大量气体是
(2)“氧化除铁”原理是空气中的氧气将浸出液中的Fe2+氧化为α-FeOOH,写出该反应的离子方程式:
(3)“除锰”时,参加反应的
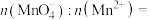
(4)若在实验室进行萃取“除铜”,所必须用到的仪器是
(5)水相中主要含Co2+,经检测c(Co2+)=0.01mol·L-1。向水相通入氨气调节pH=
(6)控制一定条件,用惰性电极电解ZnSO4溶液可制备单质锌,电解时阳极反应式为
您最近一年使用:0次
解题方法
9 . 回答下列问题
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是___________ 。
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐( )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
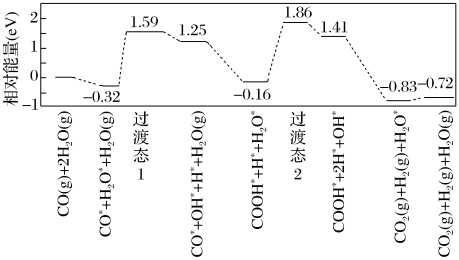
体积比为___________ 。___________ 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=___________ eV,写出该步骤的化学方程式___________ 。
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐(
 )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
体积比为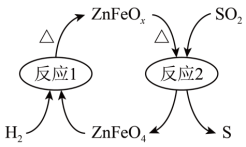
您最近一年使用:0次
名校
解题方法
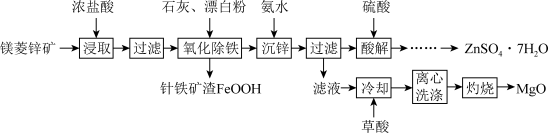
10 . 镁菱锌矿(主要成分为ZnCO3、MgCO3等,含有少量FeCO3、CaCO3等杂质)可用于生产媒染剂、防腐剂ZnSO4•7H2O以及耐火材料MgO。制备工艺流程如图:
回答下列有关问题:
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是_______ 。
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为_______ 。
(3)“沉锌”时,加入氨水调节pH的范围是_______ 。
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、_______ 制得的ZnSO4•7H2O在烘干时需减压烘干的原因是_______ 。
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:_______ 。
| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Mg2+ | Ca2+ |
| 开始沉淀 | 2.7 | 7.6 | 6.2 | 9.4 | 13 |
| 完全沉淀 | 3.7 | 9.6 | 8.2 | 12.4 | _______ |
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为
(3)“沉锌”时,加入氨水调节pH的范围是
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:
您最近一年使用:0次



