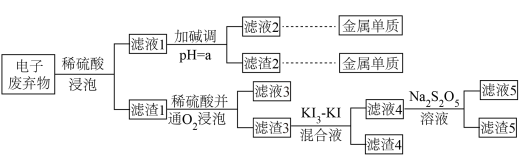
1 . 以电子废弃物(主要含Au、Cu、Co、Ni等金属单质)为原料绿色化回收这些金属的工艺流程如下。 (离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。
(离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。
(1)滤渣3的主要成分是_______ 。
(2)Co(OH)₂的酸式电离方程式为_______ ,其平衡常数为_______ ,滤液1中金属离子的浓度均为10⁻³mol⋅L⁻¹,加碱调pH的过程中溶液体积变化忽略平计,则a=_______ ,此时Ni²⁺的浓度为_______ mol·L⁻¹。
(3)滤液4的主要阴离子是Aul ,加入Na2S2O5溶液反应的离子方程式是
,加入Na2S2O5溶液反应的离子方程式是_______ 。
(4)已知: 滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是
滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是_______ 。
 (离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。
(离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。(1)滤渣3的主要成分是
(2)Co(OH)₂的酸式电离方程式为
(3)滤液4的主要阴离子是Aul
 ,加入Na2S2O5溶液反应的离子方程式是
,加入Na2S2O5溶液反应的离子方程式是(4)已知:
 滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是
滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是
您最近一年使用:0次
名校
2 . 利用锌灰(主要成分为ZnO,含有CuO、PbO、SiO2、FeO、Fe2O3等杂质)制备高纯ZnO的工艺流程如图:(已知PbSO4为难溶物)
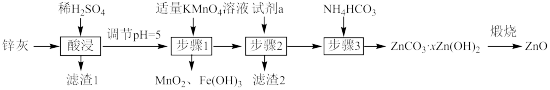
| A.滤渣1的成分只有H2SiO3和PbSO4 |
| B.加入的试剂a可为Zn,目的是除去Cu2+ |
C.步骤1中发生反应的离子方程式为MnO +3Fe3++7H2O=3Fe(OH)3↓+MnO2↓+5H+ +3Fe3++7H2O=3Fe(OH)3↓+MnO2↓+5H+ |
| D.若取步骤3后的干燥滤饼11.2g煅烧,得到产品8.1g,则x=2 |
您最近一年使用:0次
名校
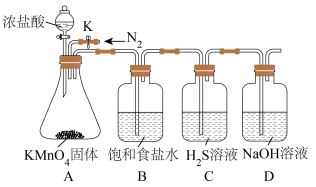
3 . 甲乙两个兴趣小组分别设计了以下两组实验:
(一)甲组同学设计实验探究Cl和S元素的非金属性。__________________ 。
(2)B中饱和食盐水的作用是__________________ 。
(3)C中证明元素非金属性Cl大于S的化学方程式为____________ 。
(二)实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各小题。
(4)实验装置:______
(5)实验步骤:
连接仪器、______ 、加药品后,打开a,然后滴入浓硫酸,加热(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是__________________ ;
装置E中足量酸性 溶液的作用是
溶液的作用是__________________ ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是____________ ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性______ (填“能”或“否”),理由是__________________ 。
(一)甲组同学设计实验探究Cl和S元素的非金属性。
(2)B中饱和食盐水的作用是
(3)C中证明元素非金属性Cl大于S的化学方程式为
(二)实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各小题。
(4)实验装置:
(5)实验步骤:
连接仪器、
①铜与浓硫酸反应的化学方程式是
装置E中足量酸性
 溶液的作用是
溶液的作用是②能说明碳元素的非金属性比硅元素非金属性强的实验现象是
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性
您最近一年使用:0次
名校
解题方法
4 . 焦亚硫酸钠( )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1) 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为__________ 。
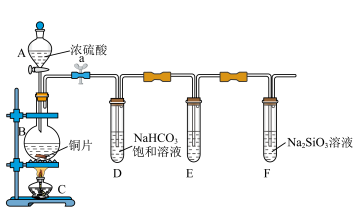
(2)“ 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图:__________ 。
②饱和碳酸氢钠溶液的作用是__________ 。
③三颈烧瓶中生成 反应的化学方程式为
反应的化学方程式为__________ ( 为沉淀物)。
为沉淀物)。
(3)“ 制备”反应过程分四步:
制备”反应过程分四步:
步骤Ⅰ.在碳酸钠溶液中通入 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;
步骤Ⅱ.停止通 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;
步骤Ⅲ.继续通入 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;
步骤Ⅳ.当溶液中 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。
①步骤Ⅰ测量溶液的pH=4.1所用仪器是__________ 。
②写出步骤Ⅱ中反应的离子方程式:__________ 。
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:__________ 。
 )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1)
 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为(2)“
 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图: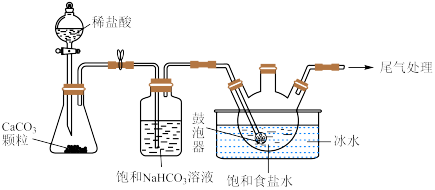
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成
 反应的化学方程式为
反应的化学方程式为 为沉淀物)。
为沉淀物)。(3)“
 制备”反应过程分四步:
制备”反应过程分四步:步骤Ⅰ.在碳酸钠溶液中通入
 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;步骤Ⅱ.停止通
 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;步骤Ⅲ.继续通入
 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;步骤Ⅳ.当溶液中
 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。①步骤Ⅰ测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:
您最近一年使用:0次
2024-03-30更新
|
287次组卷
|
5卷引用:山东省泰安市泰山国际学校2023-2024学年高二下学期3月月考化学试题
名校
解题方法
5 . 宏观—微观—符号是化学的三重表征,下列有关化学符号表征正确的是
A.铅蓄电池中充电时阳极反应: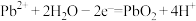 |
B.用白醋和淀粉KI试纸检验加碘盐中的 : :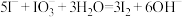 |
C.侯氏制碱法中 晶体的制备: 晶体的制备: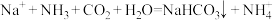 |
D. 和 和 不能大量共存: 不能大量共存: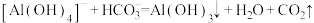 |
您最近一年使用:0次
2023-02-14更新
|
219次组卷
|
3卷引用:山东省泰安第一中学新校区2023-2024学年高二上学期期末模拟考试化学试题
名校
解题方法
6 . 由铝焙砂(主要成分为MoO3、MoS2,含有CuO、SiO2、Fe2O3等杂质)制备七钼酸铵 的工艺流程如图。
的工艺流程如图。
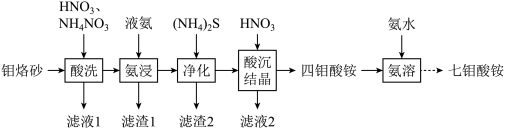
已知:生成多钼酸铵的种类主要由溶液的pH来决定
回答下列问题:
(1) 的Mo的化合价是
的Mo的化合价是_______ 。“滤渣1”主要含有铁铜氢氧化物和_______ (填化学式)。
(2)“酸洗”时, 被稀
被稀 氧化为
氧化为 和H2SO4,反应的离子方程式为
和H2SO4,反应的离子方程式为_______ 。
(3)“净化”时, 若浸出液中还残留 、
、 , 可转化为硫化物沉淀除去。
, 可转化为硫化物沉淀除去。
已知 ,该溶液中
,该溶液中 和pH的关系为:
和pH的关系为: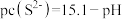 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于 ,应控制溶液的pH不小于
,应控制溶液的pH不小于_______ 。 (已知: ;CuS和FeS的
;CuS和FeS的 分别为35.2和17.2)
分别为35.2和17.2)
(4)“净化”后,溶液中若有低价钼(以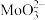 表示),可以加入适量的
表示),可以加入适量的 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(5)“酸沉结晶”使用 的目的是
的目的是_______ ;“ 滤液2”经处理后可返回_______ 工序继续使用。
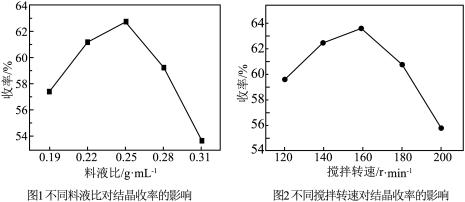
(6)“氨溶”后,通过降温结晶可得到七钼酸铵。由图可知应选用最佳结晶条件为_______ 。
 的工艺流程如图。
的工艺流程如图。
已知:生成多钼酸铵的种类主要由溶液的pH来决定
二钼酸铵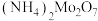 | 四钼酸铵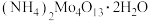 | 七钼酸铵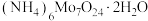 | |
| pH | 8.0~9.0 | 2.0~2.5 | 6.0~7.0 |
(1)
 的Mo的化合价是
的Mo的化合价是(2)“酸洗”时,
 被稀
被稀 氧化为
氧化为 和H2SO4,反应的离子方程式为
和H2SO4,反应的离子方程式为(3)“净化”时, 若浸出液中还残留
 、
、 , 可转化为硫化物沉淀除去。
, 可转化为硫化物沉淀除去。已知
 ,该溶液中
,该溶液中 和pH的关系为:
和pH的关系为: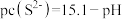 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于 ,应控制溶液的pH不小于
,应控制溶液的pH不小于 ;CuS和FeS的
;CuS和FeS的 分别为35.2和17.2)
分别为35.2和17.2)(4)“净化”后,溶液中若有低价钼(以
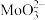 表示),可以加入适量的
表示),可以加入适量的 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为(5)“酸沉结晶”使用
 的目的是
的目的是(6)“氨溶”后,通过降温结晶可得到七钼酸铵。由图可知应选用最佳结晶条件为

您最近一年使用:0次
2023-02-11更新
|
269次组卷
|
2卷引用:山东省泰安市新泰第一中学老校区2023-2024学年高二上学期第三次月考化学试题
名校
7 . 利用如图装置测定ClO2气体的质量:在锥形瓶中加入足量的KI溶液,再加入3 mL硫酸溶液:在玻璃液封管中加入水:将生成的ClO2气体通进入锥形瓶中被吸收;将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至终点时消耗V mL( )。下列说法错误的是
)。下列说法错误的是
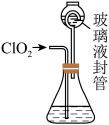
 )。下列说法错误的是
)。下列说法错误的是 
A. 与酸化的KI溶液反应为 与酸化的KI溶液反应为 |
B.玻璃液封管的作用是吸收残余的 气体、使锥形瓶内外压强相等 气体、使锥形瓶内外压强相等 |
C.测得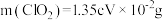 |
| D.滴定终点的现象是溶液由无色恰好变为蓝色,且半分钟内不变色 |
您最近一年使用:0次
2023-02-11更新
|
262次组卷
|
3卷引用:山东省泰安市新泰第一中学老校区2023-2024学年高二上学期第三次月考化学试题
名校
8 . 高锰酸钾生产过程中产生的废锰渣(主要成分为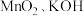 和
和 )可用于制备
)可用于制备 晶体,工艺流程如下:
晶体,工艺流程如下:

已知:①硫铁矿的主要成分为 (杂质不参与反应);
(杂质不参与反应);
② 为肉色。
为肉色。
回答下列问题:
(1)过滤时用到的主要玻璃仪器有___________ 。
(2)为了提高“反应I”的速率,可采取的措施有___________ (写两种即可)。
(3)“反应II”的离子方程式为____ ,“滤渣B”的主要成分为过量的 和
和____ (填化学式)。
(4)“反应III”中氧化剂和还原剂物质的量之比为___________ 。
(5)检验“滤液1”中是否含有 的方法是
的方法是___________ 。
(6)取mg 固体样品,溶于适量水中,加硫酸酸化,用过量
固体样品,溶于适量水中,加硫酸酸化,用过量 (难溶于水)将其完全氧化为
(难溶于水)将其完全氧化为 ,过滤,洗涤液并加入滤液后,加入
,过滤,洗涤液并加入滤液后,加入 固体,充分反应后,用
固体,充分反应后,用 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 溶液,用去
溶液,用去 。
。
①达到滴定终点的现象是___________ 。
②样品中 的质量分数为
的质量分数为___________ (用含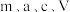 的代数式表示)。
的代数式表示)。
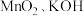 和
和 )可用于制备
)可用于制备 晶体,工艺流程如下:
晶体,工艺流程如下:
已知:①硫铁矿的主要成分为
 (杂质不参与反应);
(杂质不参与反应);②
 为肉色。
为肉色。回答下列问题:
(1)过滤时用到的主要玻璃仪器有
(2)为了提高“反应I”的速率,可采取的措施有
(3)“反应II”的离子方程式为
 和
和(4)“反应III”中氧化剂和还原剂物质的量之比为
(5)检验“滤液1”中是否含有
 的方法是
的方法是(6)取mg
 固体样品,溶于适量水中,加硫酸酸化,用过量
固体样品,溶于适量水中,加硫酸酸化,用过量 (难溶于水)将其完全氧化为
(难溶于水)将其完全氧化为 ,过滤,洗涤液并加入滤液后,加入
,过滤,洗涤液并加入滤液后,加入 固体,充分反应后,用
固体,充分反应后,用 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 溶液,用去
溶液,用去 。
。①达到滴定终点的现象是
②样品中
 的质量分数为
的质量分数为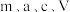 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2022-01-27更新
|
205次组卷
|
3卷引用:山东省泰安市宁阳四中2023-2024学年高二上学期期末化学模拟试卷



