名校
1 .  .在生活中亚硝酸钠(
.在生活中亚硝酸钠( )应用十分广泛,它是一种白色固体,外观与
)应用十分广泛,它是一种白色固体,外观与 极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知:
极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知: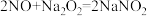 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。 能被高锰酸钾氧化,但不能被浓硫酸氧化。
能被高锰酸钾氧化,但不能被浓硫酸氧化。
②酸性高锰酸钾溶液可将 氧化成
氧化成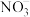 。
。
回答下列问题:
(1)盛放浓硝酸的仪器名称为___________ ;仪器按气流方向连接顺序为b→g→___________ (装置可重复使用)。
(2)反应开始前打开止水夹a,通入过量氮气排除装置中的空气,若不排除装置中的空气,可能导致产物中混有杂质___________ (填化学式);反应结束后打开止水夹a,继续通入过量氮气,其目的是___________ 。
(3)盛水的洗气瓶中发生的反应的化方程式为___________ ;为了提高产率,可在该洗气瓶中加入铜片,请用化学反应方程式解释加入铜片的作用___________ 。
 .利用氨气与次氯酸钠反应制备
.利用氨气与次氯酸钠反应制备 ,其制备装置如图所示。
,其制备装置如图所示。
(4)仪器b的优点为___________ ,仪器a的作用是___________ 。
(5)上述装置的缺点是___________ ,可能导致的结果及原因是___________ 。
 .在生活中亚硝酸钠(
.在生活中亚硝酸钠( )应用十分广泛,它是一种白色固体,外观与
)应用十分广泛,它是一种白色固体,外观与 极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知:
极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知: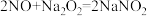 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
 能被高锰酸钾氧化,但不能被浓硫酸氧化。
能被高锰酸钾氧化,但不能被浓硫酸氧化。②酸性高锰酸钾溶液可将
 氧化成
氧化成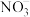 。
。回答下列问题:
(1)盛放浓硝酸的仪器名称为
(2)反应开始前打开止水夹a,通入过量氮气排除装置中的空气,若不排除装置中的空气,可能导致产物中混有杂质
(3)盛水的洗气瓶中发生的反应的化方程式为
 .利用氨气与次氯酸钠反应制备
.利用氨气与次氯酸钠反应制备 ,其制备装置如图所示。
,其制备装置如图所示。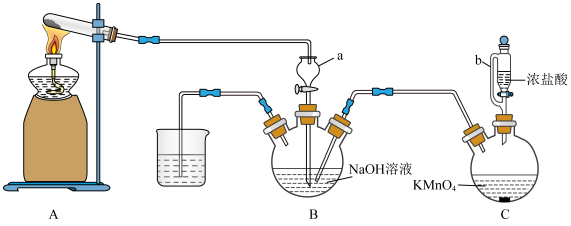
(4)仪器b的优点为
(5)上述装置的缺点是
您最近半年使用:0次
名校
2 .  .某实验小组为探究含硫化合物
.某实验小组为探究含硫化合物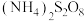 的性质,设计如下实验探究
的性质,设计如下实验探究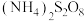 的氧化性。
的氧化性。
实验操作:向小试管中加入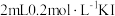 溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量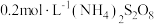 溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在
溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在 。
。
(1)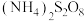 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(2)检验该溶液中存在 的具体操作及现象为
的具体操作及现象为___________ 。
(3)实验结论: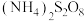 的氧化性
的氧化性___________ (填“强于”或“弱于”) 。
。
已知: 可与
可与 发生反应:
发生反应: 。为了进一步探究
。为了进一步探究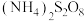 与
与 的反应速率,小组同学设计下表实验:
的反应速率,小组同学设计下表实验:
(4)上述实验 中的
中的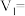
___________ ;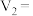
___________ 。
加入 溶液后溶液变蓝的时间明显增长,小组同学对此提出两种清想:
溶液后溶液变蓝的时间明显增长,小组同学对此提出两种清想:
猜想1: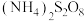 与
与 反应的速率远低于
反应的速率远低于 与
与 反应的速率;
反应的速率;
猜想2: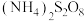 先与
先与 反应,
反应, 消耗完后才与
消耗完后才与 反应。
反应。
为验证上述猜想,小组同学补充下表实验(已知 密度比水大,且
密度比水大,且 溶于
溶于 显紫色)
显紫色)
(5)验证猜想1的实验设计为___________ 。(填“实验 ”或“实验
”或“实验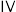 ”)
”)
(6)实验 中下层溶液显浅紫色的原因为
中下层溶液显浅紫色的原因为___________ 。
(7)由上述实验可知___________ (填“猜想1”或“猜想2”)成立。
 .某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。
.某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。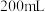 空气时,酸性
空气时,酸性 溶液恰好褪色,停止实验。发生反应的离子方程式为:
溶液恰好褪色,停止实验。发生反应的离子方程式为:___________ 。该空气中二氧化硫的体积分数为___________ 。
 .某实验小组为探究含硫化合物
.某实验小组为探究含硫化合物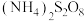 的性质,设计如下实验探究
的性质,设计如下实验探究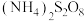 的氧化性。
的氧化性。实验操作:向小试管中加入
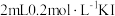 溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量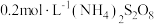 溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在
溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在 。
。(1)
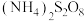 与
与 反应的离子方程式为
反应的离子方程式为(2)检验该溶液中存在
 的具体操作及现象为
的具体操作及现象为(3)实验结论:
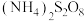 的氧化性
的氧化性 。
。已知:
 可与
可与 发生反应:
发生反应: 。为了进一步探究
。为了进一步探究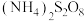 与
与 的反应速率,小组同学设计下表实验:
的反应速率,小组同学设计下表实验:| 试验编号 |  溶液/ 溶液/ | 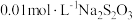 溶液/ 溶液/ | 蒸馏水/ | 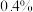 的淀粉溶液/滴 的淀粉溶液/滴 | 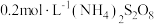 溶液/ 溶液/ | 变色 时间/s |
 | 4.0 | 0 | 4.0 | 2 | 2.0 | 立即 |
 | 4.0 | 1.0 |  | 2 |  | 30 |
(4)上述实验
 中的
中的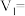
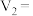
加入
 溶液后溶液变蓝的时间明显增长,小组同学对此提出两种清想:
溶液后溶液变蓝的时间明显增长,小组同学对此提出两种清想:猜想1:
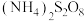 与
与 反应的速率远低于
反应的速率远低于 与
与 反应的速率;
反应的速率;猜想2:
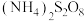 先与
先与 反应,
反应, 消耗完后才与
消耗完后才与 反应。
反应。为验证上述猜想,小组同学补充下表实验(已知
 密度比水大,且
密度比水大,且 溶于
溶于 显紫色)
显紫色)| 试验编号 | 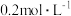  溶液/ 溶液/ | 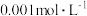 碘水/ 碘水/ | 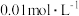  溶液/ 溶液/ |  / / | 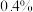 的淀粉溶液/滴 的淀粉溶液/滴 | 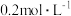 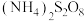 溶液/ 溶液/ | 实验现象 |
 | 2 | 0 | 20 | 10 | 0 | 0.2 | 下层溶液显浅紫色 |
 | 0 | 5 | 20 | 0 | 2 | 20 | 溶液先变蓝,后迅速褪色,一段时间后又变蓝 |
(5)验证猜想1的实验设计为
 ”或“实验
”或“实验 ”)
”)(6)实验
 中下层溶液显浅紫色的原因为
中下层溶液显浅紫色的原因为(7)由上述实验可知
 .某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。
.某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。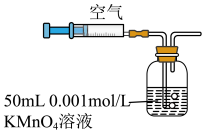
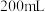 空气时,酸性
空气时,酸性 溶液恰好褪色,停止实验。发生反应的离子方程式为:
溶液恰好褪色,停止实验。发生反应的离子方程式为:
您最近半年使用:0次
名校
解题方法
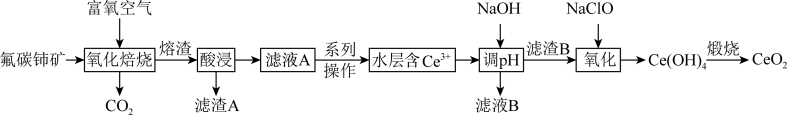
3 . 二氧化铈(CeO2)是一种典型的金属氧化物,具有较强的氧化性广泛应用于多相催化反应,并作为汽车尾气净化的三效催化剂的重要组成成分。以氟碳铈矿(主要含CeFCO3、BaO等)为原料制备CeO2的一种工艺流程如下图所示: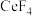 ;②滤液A中含:
;②滤液A中含: 、
、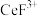 等离子。
等离子。
回答下列问题:
(1)滤渣A的主要成分是___________ (填化学式);“酸浸”不用盐酸的理由是_________ (答一点即可)。
(2)“系列操作”包含以下几个过程:已知: 不能溶于有机物TBP;
不能溶于有机物TBP;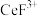 能溶于有机物TBP,且存在反应:
能溶于有机物TBP,且存在反应: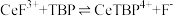 。“滤液A”中加入有机物TBP后的分离方法是
。“滤液A”中加入有机物TBP后的分离方法是___________ ,“有机层B”中发生反应的离子方程式为___________ 。水层中的一种溶质,理论上可以在工艺流程图中的_________ 工序中循环利用,减小“调pH”工序中 的用量,节约生产成本。
的用量,节约生产成本。 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于________ (已知25℃时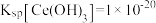 )。
)。
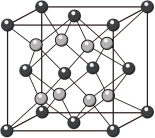
(4)二氧化铈立方晶胞如图所示,则铈原子Ce在晶胞中的位置是________ ;晶体中一个Ce周围与其最近的O的个数为________ 。
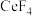 ;②滤液A中含:
;②滤液A中含: 、
、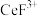 等离子。
等离子。回答下列问题:
(1)滤渣A的主要成分是
(2)“系列操作”包含以下几个过程:已知:
 不能溶于有机物TBP;
不能溶于有机物TBP;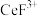 能溶于有机物TBP,且存在反应:
能溶于有机物TBP,且存在反应: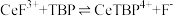 。“滤液A”中加入有机物TBP后的分离方法是
。“滤液A”中加入有机物TBP后的分离方法是 的用量,节约生产成本。
的用量,节约生产成本。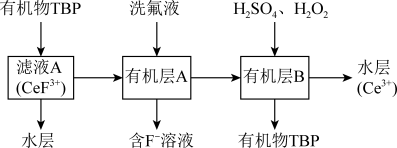
 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于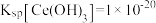 )。
)。(4)二氧化铈立方晶胞如图所示,则铈原子Ce在晶胞中的位置是
您最近半年使用:0次
名校
解题方法
4 . I.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
(1)结合上表的数据,写出工业上合成氨反应的热化学方程式_______ 。分离器中压强约为15MPa,温度约为-20°C,分离氨应用了氨的_____ 性质。
(2)在吸收塔中不断补充空气的目的是_____ 。
(3)吸收塔中出来的尾气会含有NO、NO2等氮氧化物,为了防止污染空气,通常有以下两种方法处理:
①Na2CO3溶液吸收法:反应原理为NO+NO2 + Na2CO3 =___ +CO2 (请完成化学方程式);根据反应,每产生22.4L(标准状况下)CO2,吸收液质量将增加____ g。
②氨催化还原法。以NO2为例,NH3可将NO2还原为无污染N2,该反应的方程式为____ 。

| 共价键 | N≡N | H−H | N−H |
| 断开1 mol共价键所需能量(kJ) | 946 | 436 | 391 |
(1)结合上表的数据,写出工业上合成氨反应的热化学方程式
(2)在吸收塔中不断补充空气的目的是
(3)吸收塔中出来的尾气会含有NO、NO2等氮氧化物,为了防止污染空气,通常有以下两种方法处理:
①Na2CO3溶液吸收法:反应原理为NO+NO2 + Na2CO3 =
②氨催化还原法。以NO2为例,NH3可将NO2还原为无污染N2,该反应的方程式为
您最近半年使用:0次
名校
解题方法
5 . 某铜矿石的主要成分为 ,还含有少量
,还含有少量 、
、 、
、 。工业上用该矿石获取铜和胆矾的操作流程如下:
。工业上用该矿石获取铜和胆矾的操作流程如下: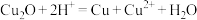
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)实际生产中,将矿石粉碎为矿渣的目的是_______ 。
(2)固体混合物A中含有较多的铜,加入某试剂可以提纯铜。该反应的离子方程式为_______ 。
(3)反应I完成后的滤液中铁元素的存在形式为________ (填离子符号),检验该离子常用的试剂为_______ ,生成该离子的离子方程式为________ 。
(4)加入NaClO调节溶液pH可生成沉淀B,利用题中所给信息,沉淀B为_______ ,该反应中氧化剂与还原剂物质的量之比为________ 。
(5)加入NaOH调节pH,得到沉淀C,利用题中所给信息分析y的范围________ 。
(6)操作1主要包括:______ 、过滤、冷水洗涤得到 。
。
 ,还含有少量
,还含有少量 、
、 、
、 。工业上用该矿石获取铜和胆矾的操作流程如下:
。工业上用该矿石获取铜和胆矾的操作流程如下:
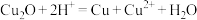
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |  |  |  |  |
| 开始沉淀的pH | 5.4 | 4.0 | 2.7 | 5.8 |
| 沉淀完全的pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)实际生产中,将矿石粉碎为矿渣的目的是
(2)固体混合物A中含有较多的铜,加入某试剂可以提纯铜。该反应的离子方程式为
(3)反应I完成后的滤液中铁元素的存在形式为
(4)加入NaClO调节溶液pH可生成沉淀B,利用题中所给信息,沉淀B为
(5)加入NaOH调节pH,得到沉淀C,利用题中所给信息分析y的范围
(6)操作1主要包括:
 。
。
您最近半年使用:0次
名校
解题方法
6 . 铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。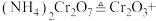
_______ +_______ 。
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___________ (列式表示)。
③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线__________________ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为____________ 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)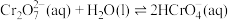
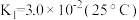
(ⅱ)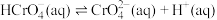

 溶液的说法正确的有
溶液的说法正确的有_______ 。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时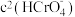 与
与 的比值保持不变
的比值保持不变
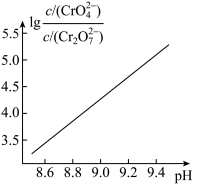
②25℃时,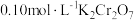 溶液中
溶液中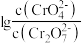 随pH的变化关系如图。当
随pH的变化关系如图。当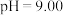 时,设
时,设 、
、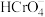 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为____________  ;计算溶液中
;计算溶液中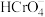 的平衡浓度
的平衡浓度__________ (写出计算过程,结果保留两位有效数字)。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
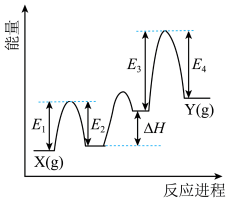
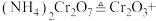
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线
(2)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
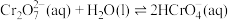
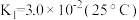
(ⅱ)
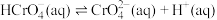

 溶液的说法正确的有
溶液的说法正确的有A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时
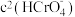 与
与 的比值保持不变
的比值保持不变②25℃时,
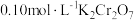 溶液中
溶液中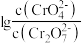 随pH的变化关系如图。当
随pH的变化关系如图。当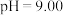 时,设
时,设 、
、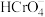 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为 ;计算溶液中
;计算溶液中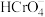 的平衡浓度
的平衡浓度
您最近半年使用:0次
解题方法
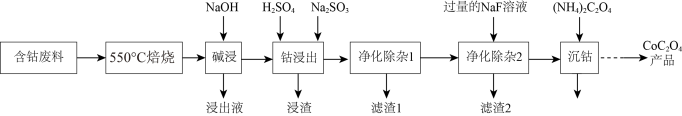
7 . 草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
②ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是_______ 。
(2)“浸出液”的主要成分是_______ 。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_______ 。
(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,控制温度不能太高的原因是_______ ,H2O2的作用是_______ (用离子方程式表示)。
(5)在空气中焙烧CoC2O4生成Co3O4和一种气体,请写出该反应的化学方程式:_______ 。
②ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是
(2)“浸出液”的主要成分是
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为
(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,控制温度不能太高的原因是
(5)在空气中焙烧CoC2O4生成Co3O4和一种气体,请写出该反应的化学方程式:
您最近半年使用:0次
解题方法
8 . 钉(Ru)为重要的稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为Ru、Pb、 、
、 ,回收钌的工艺流程如图:
,回收钌的工艺流程如图: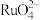 、
、 。
。
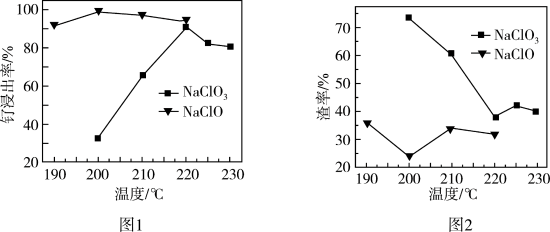
(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为________ ;最佳反应温度为________ 。 。则“还原”过程中每生成
。则“还原”过程中每生成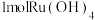 时,氧化剂和还原剂的物质的量之比为
时,氧化剂和还原剂的物质的量之比为________ 。
(3)“蒸馏”过程的化学反应方程式为________ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为________ 、________ 。
(5)可用氢还原重量法测定产品的纯度,其原理为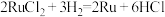 。实验所得数据记录如表,则产品的纯度为
。实验所得数据记录如表,则产品的纯度为________ 。
 、
、 ,回收钌的工艺流程如图:
,回收钌的工艺流程如图: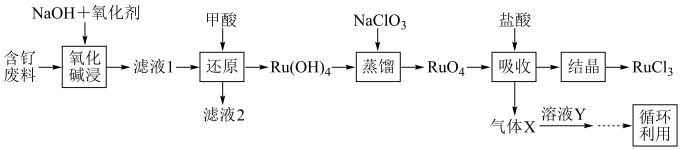
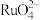 、
、 。
。(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为
 。则“还原”过程中每生成
。则“还原”过程中每生成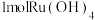 时,氧化剂和还原剂的物质的量之比为
时,氧化剂和还原剂的物质的量之比为(3)“蒸馏”过程的化学反应方程式为
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)可用氢还原重量法测定产品的纯度,其原理为
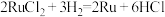 。实验所得数据记录如表,则产品的纯度为
。实验所得数据记录如表,则产品的纯度为实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.000 | 2.0210 |
② | 5.000 | 2.0190 |
③ | 5.000 | 2.0200 |
您最近半年使用:0次
解题方法
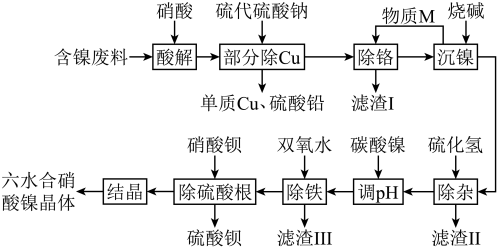
9 . NiCoCr-LDHs是一种新型吸附材料,可用作吸附剂去除水中的有机阴离子污染物,下面是利用含镍工业废料合成其重要原料Ni(NO3)2·6H2O的工艺流程。
a.Ksp[Ni(OH)₂]=2×10-15,Ksp[Cr(OH)₃]=6.3×10-31,镍的+2价较为稳定;
b.含镍废料中含有Ni、Cr、Fe、Cu、Zn、Pb的化合物,其中Cr元素的存在形式为+3价。
请回答下列问题:
(1)基态Ni的价电子排布式为___________ 。
(2)请写出“部分除Cu”工序中除铜的离子方程式:___________ 。
(3)M物质的加入主要是为了调节溶液的pH,则物质M是___________ 。
(4)滤渣Ⅱ的主要成分为ZnS和___________ 。
(5)“除铁”时双氧水的作用是___________ 。
(6)硝酸镍的阴离子的空间构型是___________ 。
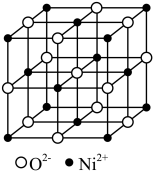
(7)Ni(NO3)2·6H2O经过灼烧可以生成一种Ni的氧化物,其晶胞结构如图。其中Ni的配位数为___________ 。已知该晶胞的晶胞参数均相同,晶胞内两个O原子的最短距离为apm,设NA为阿伏加德罗常数的值,则该晶体的密度为___________ g•cm-3(写出计算式即可)。
a.Ksp[Ni(OH)₂]=2×10-15,Ksp[Cr(OH)₃]=6.3×10-31,镍的+2价较为稳定;
b.含镍废料中含有Ni、Cr、Fe、Cu、Zn、Pb的化合物,其中Cr元素的存在形式为+3价。
请回答下列问题:
(1)基态Ni的价电子排布式为
(2)请写出“部分除Cu”工序中除铜的离子方程式:
(3)M物质的加入主要是为了调节溶液的pH,则物质M是
(4)滤渣Ⅱ的主要成分为ZnS和
(5)“除铁”时双氧水的作用是
(6)硝酸镍的阴离子的空间构型是
(7)Ni(NO3)2·6H2O经过灼烧可以生成一种Ni的氧化物,其晶胞结构如图。其中Ni的配位数为
您最近半年使用:0次
名校
解题方法
10 . 下列离子反应方程式正确的是
A.氯气通入冷的石灰乳: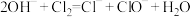 |
B.向NaHCO3溶液中滴入少量澄清石灰水: |
C.向明矾溶液中滴加Ba(OH)2溶液到 恰好完全沉淀时: 恰好完全沉淀时: |
| D.向FeI2溶液中通入少量氯气:Cl2 + 2I- = 2Cl- + I2 |
您最近半年使用:0次



