名校
解题方法
1 . 次氯酸盐是常用的水处理剂。有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 mol/L;物质氧化性越强,氧化还原电位(ORP)越高;相同条件下,次氯酸的氧化性大于次氯酸盐。温度及pH对Ca(ClO)2溶液有效氯含量(COAC)及氧化还原电位的影响。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。___________ (填“增大”或“减小”)。
②Ca(ClO)2溶液用于消毒时适宜的条件:温度为___________ (填字母,下同)、pH为___________ 。
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
①设计实验1和2的目的是___________ 。
②实验5中的a___________ 0.935(填“大于”“小于”或“等于”)。
③根据实验3~5,可得出的结论是___________ 。
④下列物质中最适宜作为NaClO溶液稳定剂的是___________ (填字母)。
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ⅱ.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①离子方程式表示可能导致溶液碱性减弱的原因:_______________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被___________ (填化学式)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:___________ 。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。
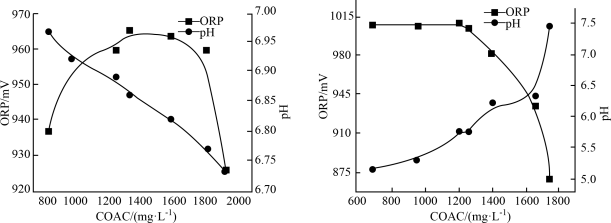
图1 图2
①由图1可知,随着少量乙酸的滴入,Ca(ClO)2溶液的pH在②Ca(ClO)2溶液用于消毒时适宜的条件:温度为
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH | 12 h后COAC | 12 h后COAC/初始COAC |
| 1 | 0 | 0 | 1 794 | 8.53 | 1 218 | 0.679 |
| 2 | 0 | 0 | 1 794 | 8.63 | 1 288 | 0.718 |
| 3 | 0.9% | 0.6% | 1 794 | 13.44 | 1 676 | 0.935 |
| 4 | 1.5% | 0 | 1 834 | 13.76 | 1 597 | 0.871 |
| 5 | 0 | 1.5% | 1 834 | 13.66 | - | a |
②实验5中的a
③根据实验3~5,可得出的结论是
④下列物质中最适宜作为NaClO溶液稳定剂的是
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ⅱ.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
| 序号 | Cl2的吸收液 | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 10mL水+5滴0.1mol/L MnSO4溶液 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 10mL5% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 10mL40% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
解题方法
2 . 砷的化合物可用于半导体领域。一种从酸性高浓度含砷废水[砷主要以亚砷酸(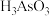 )形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
)形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
Ⅰ. ;
;
Ⅱ.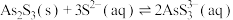 ;
;
Ⅲ.砷酸( )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 等还原;
等还原;
Ⅳ.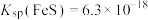 ,
, 。
。
回答下列问题;
(1)“沉砷”时,亚砷酸转化为 的化学方程式为
的化学方程式为_____________________________ 。
(2)“沉砷”时产生的废气可用______________ 溶液吸收处理(填化学式)。
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是_________ (填化学式);此时溶液中存在平衡: ,该反应的平衡常数K=
,该反应的平衡常数K=_____________ (保留2位小数)。
(4)向滤液Ⅱ中通入氧气进行“氧化脱硫”,反应的离子方程式为_____________________ 。
(5)“沉砷”过程中FeS不可用过量的 替换,原因是
替换,原因是 ______________________________ (从平衡移动的角度解释)。
(6)该流程最后一步用 “还原”砷酸,发生反应的化学方程式为
“还原”砷酸,发生反应的化学方程式为____________________ 。
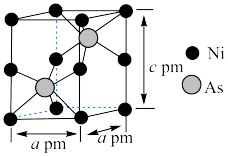
(7)某含砷化合物晶体的晶胞如图所示,As原子位于紧邻Ni原子构成的正三棱柱的体心。晶胞参数为a pm、a pm、c pm,则该晶体的密度为_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
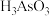 )形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
)形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下: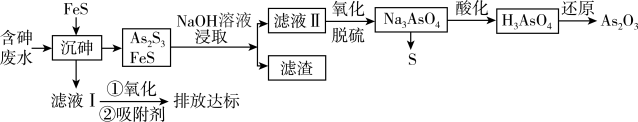
Ⅰ.
 ;
;Ⅱ.
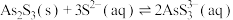 ;
;Ⅲ.砷酸(
 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 等还原;
等还原;Ⅳ.
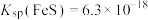 ,
, 。
。回答下列问题;
(1)“沉砷”时,亚砷酸转化为
 的化学方程式为
的化学方程式为(2)“沉砷”时产生的废气可用
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是
 ,该反应的平衡常数K=
,该反应的平衡常数K=(4)向滤液Ⅱ中通入氧气进行“氧化脱硫”,反应的离子方程式为
(5)“沉砷”过程中FeS不可用过量的
 替换,原因是
替换,原因是 (6)该流程最后一步用
 “还原”砷酸,发生反应的化学方程式为
“还原”砷酸,发生反应的化学方程式为(7)某含砷化合物晶体的晶胞如图所示,As原子位于紧邻Ni原子构成的正三棱柱的体心。晶胞参数为a pm、a pm、c pm,则该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
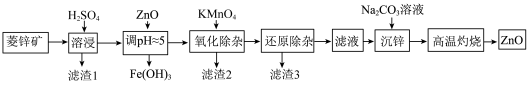
3 . 工业上可由菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Mn等元素)制备ZnO。工艺如图所示:
②弱酸性溶液中KMnO4氧化Mn2+时,产物中含Mn元素物质只有MnO2。
③氧化性强弱顺序:Ni2+>Cd2+>Zn2+。
④相关金属离子[c(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)基态Zn原子的价电子排布式为___________ ,ZnO溶于氨水生成[Zn(NH3)4]2+,1 mol [Zn(NH3)4]2+共有___________ mol的σ键。
(2)①“溶浸”过程中,为了提高浸出率,可采取的措施是___________ 。(写一条即可)
②“调pH”时,可替代ZnO的一种含锌化合物是___________ 。(用化学式表示)
③“调pH”时,若pH=5.5,此时溶液中Zn2+的最大浓度c=___________ mol/L。
(3)写出“氧化除杂”时KMnO4溶液与Mn2+反应的离子方程式___________ 。
(4)“还原除杂”除去的离子是___________ ,加入的还原剂是___________ 。
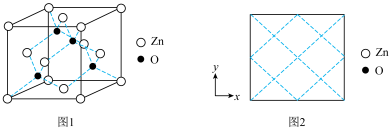
(5)“沉锌”时生成ZnCO3·2Zn(OH)2·2H2O (碱式碳酸锌)沉淀,该沉淀“高温灼烧”后获得ZnO。氧化锌的一种晶体的晶胞是立方晶胞(如图1所示),其中与锌原子距离最近的O原子数有___________ 个,请在图2中画出该晶胞沿z轴方向的平面投影图___________ 。
②弱酸性溶液中KMnO4氧化Mn2+时,产物中含Mn元素物质只有MnO2。
③氧化性强弱顺序:Ni2+>Cd2+>Zn2+。
④相关金属离子[c(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.0 | 7.4 | 8.1 | 6.9 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.0 | 9.4 | 10.1 | 8.9 |
(1)基态Zn原子的价电子排布式为
(2)①“溶浸”过程中,为了提高浸出率,可采取的措施是
②“调pH”时,可替代ZnO的一种含锌化合物是
③“调pH”时,若pH=5.5,此时溶液中Zn2+的最大浓度c=
(3)写出“氧化除杂”时KMnO4溶液与Mn2+反应的离子方程式
(4)“还原除杂”除去的离子是
(5)“沉锌”时生成ZnCO3·2Zn(OH)2·2H2O (碱式碳酸锌)沉淀,该沉淀“高温灼烧”后获得ZnO。氧化锌的一种晶体的晶胞是立方晶胞(如图1所示),其中与锌原子距离最近的O原子数有
您最近一年使用:0次
名校
解题方法
4 . 水合肼( )及其衍生物产品在许多工业中得到广泛的使用,可用作还原剂、抗氧剂、发泡剂等。一种利用NaClO溶液与氨气反应制备水合肼的装置如图所示。下列说法不正确的是
)及其衍生物产品在许多工业中得到广泛的使用,可用作还原剂、抗氧剂、发泡剂等。一种利用NaClO溶液与氨气反应制备水合肼的装置如图所示。下列说法不正确的是
 )及其衍生物产品在许多工业中得到广泛的使用,可用作还原剂、抗氧剂、发泡剂等。一种利用NaClO溶液与氨气反应制备水合肼的装置如图所示。下列说法不正确的是
)及其衍生物产品在许多工业中得到广泛的使用,可用作还原剂、抗氧剂、发泡剂等。一种利用NaClO溶液与氨气反应制备水合肼的装置如图所示。下列说法不正确的是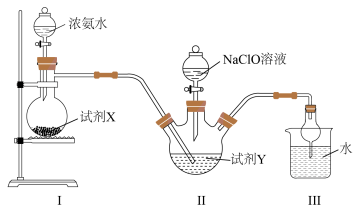
| A.Ⅰ中盛放浓氨水的仪器为分液漏斗 |
| B.试剂X可选择CaO固体 |
| C.为防倒吸,试剂Y可选择苯 |
D.Ⅱ中发生反应的化学方程式为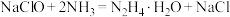 |
您最近一年使用:0次
7日内更新
|
227次组卷
|
2卷引用:广东省茂名市高州市2024届高三下学期高考适应性考试(三模)化学试题
名校
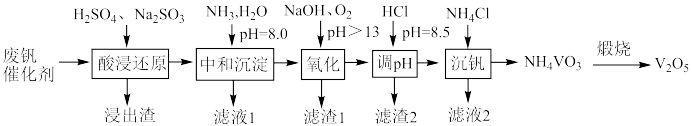
5 . 五氧化二饥广泛用于冶金、化工等行业。某废钒催化剂主要含有 、
、 、CaO、
、CaO、 、
、 、
、 等,采取如下工艺流程回收其中的钒制备
等,采取如下工艺流程回收其中的钒制备 ;
;
回答下列问题:
(1)基态V原子的价电子轨道表示式为________ 。
(2)浸出渣的主要成分是________ ,“酸浸还原”中 ;和
;和 均转化为
均转化为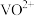 ,写出
,写出 转化为
转化为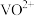 反应的离子方程式为
反应的离子方程式为________ 。
(3)“氧化”中被氧化的元素主要有________ (填元素符号)。
(4)“调pH”中有沉淀生成,写出生成沉淀反应的离子方程式________ 。
(5)“沉钒”中需要加入过量 ,其原因是
,其原因是________ 。 ,晶体未经洗涤直接进行“煅烧”,将导致
,晶体未经洗涤直接进行“煅烧”,将导致 产品中混有
产品中混有________ 杂质。
(6)工艺中可循环利用的物质有________ 。
(7)一定温度下, 溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。________ 。
②碳化钒晶胞中与碳原子距离最近且相等的碳原子个数为________ 。
③若碳化钒合金的密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则晶胞参数
,则晶胞参数________ nm。
 、
、 、CaO、
、CaO、 、
、 、
、 等,采取如下工艺流程回收其中的钒制备
等,采取如下工艺流程回收其中的钒制备 ;
;
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH | 12.4 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 13.8 | 4.7 | 3.2 | 9.0 |
(1)基态V原子的价电子轨道表示式为
(2)浸出渣的主要成分是
 ;和
;和 均转化为
均转化为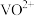 ,写出
,写出 转化为
转化为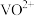 反应的离子方程式为
反应的离子方程式为(3)“氧化”中被氧化的元素主要有
(4)“调pH”中有沉淀生成,写出生成沉淀反应的离子方程式
(5)“沉钒”中需要加入过量
 ,其原因是
,其原因是 ,晶体未经洗涤直接进行“煅烧”,将导致
,晶体未经洗涤直接进行“煅烧”,将导致 产品中混有
产品中混有(6)工艺中可循环利用的物质有
(7)一定温度下,
 溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
②碳化钒晶胞中与碳原子距离最近且相等的碳原子个数为
③若碳化钒合金的密度为
 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则晶胞参数
,则晶胞参数
您最近一年使用:0次
名校
解题方法
6 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。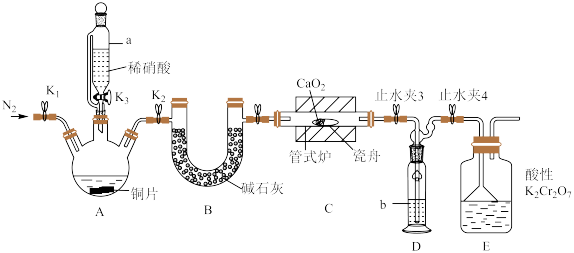
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: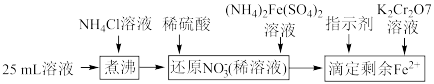
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
7日内更新
|
214次组卷
|
5卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
名校
解题方法
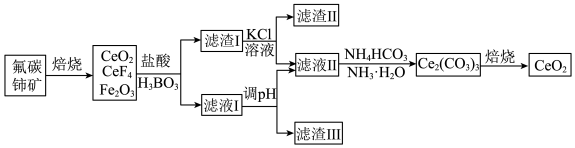
7 . 二氧化饰(CeO2)是一种重要的稀土氧化物,可以用于光催化降解有机污染物,利用氟碳饰矿(主要成分为CeCO3F,含Fe2O3、FeO等杂质)制CeOz的工艺流程如下:
②Ce3+在空气中易被氧化为Ce4+。
回答下列问题:
(1)CeCO3F中Ce元素的化合价为_______ 。
(2)焙烧氟碳铈矿时,提高焙烧效率的措施有_______ (写出两种),实验室进行焙烧操作时一般在_______ 中进行。
(3)CeCO3F在焙烧时发生反应的化学方程式为_______ 。
(4)上述流程中所加的盐酸要适当过量,其目的是_______ ,操作中可用硫酸和H2O2替换盐酸,其优点是_______ 。
(5)写出从滤液Ⅱ中沉淀铈的离子方程式:_______ 。
②Ce3+在空气中易被氧化为Ce4+。
回答下列问题:
(1)CeCO3F中Ce元素的化合价为
(2)焙烧氟碳铈矿时,提高焙烧效率的措施有
(3)CeCO3F在焙烧时发生反应的化学方程式为
(4)上述流程中所加的盐酸要适当过量,其目的是
(5)写出从滤液Ⅱ中沉淀铈的离子方程式:
您最近一年使用:0次
名校
解题方法
8 . 下列过程中的化学反应,相应的离子方程式书写正确的是
A.KClO与Fe(OH)3在碱性条件下反应制备K2FeO4:3ClO-+2Fe(OH)3=2 +3Cl-+4H++H2O +3Cl-+4H++H2O |
| B.向含lmolFeI2溶液中通入lmolCl2:2I-+Cl2=2Cl-+I2 |
C.电解MgCl2水溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑ |
D.NaHSO4溶液与Ba(OH)2溶液反应至溶液呈中性: +H++OH-+Ba2+=BaSO4↓+H2O +H++OH-+Ba2+=BaSO4↓+H2O |
您最近一年使用:0次
9 . 元素及其化合物性质丰富。下列离子方程式书写正确的是
A.铜和稀硝酸反应: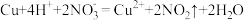 |
B.硫代硫酸钠中加入稀硫酸: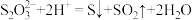 |
C.少量二氧化硫通入溴水中: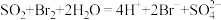 |
D.碘化亚铁溶液与等物质的量的氯气: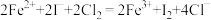 |
您最近一年使用:0次
10 . 工业上用红土镍矿(主要成分为NiO,含CoO、FeO、 、
、 、MgO、CaO和
、MgO、CaO和 )制备
)制备 。工艺流程如图所示,回答下列问题:
。工艺流程如图所示,回答下列问题: 在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为
在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为______ (填化学式)。
(2)由 溶液获取
溶液获取 的操作是
的操作是______ 、______ 、过滤、洗涤。
(3)沉镁沉钙加入NaF溶液,生成 和
和 若沉淀前溶液中
若沉淀前溶液中 ,当沉淀完全后滤液中
,当沉淀完全后滤液中 时,除钙率为
时,除钙率为______ (忽略沉淀前后溶液体积变化)。(已知: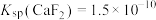 、
、 )
)
(4)“萃取”可将金属离子进行富集与分离,原理如下:
 。工业上用
。工业上用 磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:
磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:______ 左右。
②反萃取的试剂为______ 。
(5)氧化、沉铁沉铝时,需加入NaClO溶液起氧化作用。写出 与NaClO在碱性条件下发生反应的离子方程式:
与NaClO在碱性条件下发生反应的离子方程式:______ 。
(6) 中阴离子的空间构型为
中阴离子的空间构型为______ 。
 、
、 、MgO、CaO和
、MgO、CaO和 )制备
)制备 。工艺流程如图所示,回答下列问题:
。工艺流程如图所示,回答下列问题:
 在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为
在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为(2)由
 溶液获取
溶液获取 的操作是
的操作是(3)沉镁沉钙加入NaF溶液,生成
 和
和 若沉淀前溶液中
若沉淀前溶液中 ,当沉淀完全后滤液中
,当沉淀完全后滤液中 时,除钙率为
时,除钙率为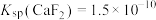 、
、 )
)(4)“萃取”可将金属离子进行富集与分离,原理如下:

 。工业上用
。工业上用 磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:
磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示: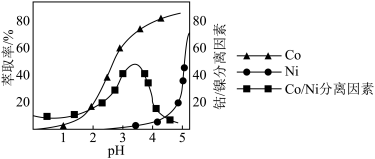
②反萃取的试剂为
(5)氧化、沉铁沉铝时,需加入NaClO溶液起氧化作用。写出
 与NaClO在碱性条件下发生反应的离子方程式:
与NaClO在碱性条件下发生反应的离子方程式:(6)
 中阴离子的空间构型为
中阴离子的空间构型为
您最近一年使用:0次



