名校
1 . 利用锌灰(主要成分为ZnO,含有CuO、PbO、SiO2、FeO、Fe2O3等杂质)制备高纯ZnO的工艺流程如图:(已知PbSO4为难溶物)
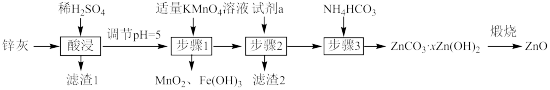
| A.滤渣1的成分只有H2SiO3和PbSO4 |
| B.加入的试剂a可为Zn,目的是除去Cu2+ |
C.步骤1中发生反应的离子方程式为MnO +3Fe3++7H2O=3Fe(OH)3↓+MnO2↓+5H+ +3Fe3++7H2O=3Fe(OH)3↓+MnO2↓+5H+ |
| D.若取步骤3后的干燥滤饼11.2g煅烧,得到产品8.1g,则x=2 |
您最近半年使用:0次
名校
2 . 甲乙两个兴趣小组分别设计了以下两组实验:
(一)甲组同学设计实验探究Cl和S元素的非金属性。__________________ 。
(2)B中饱和食盐水的作用是__________________ 。
(3)C中证明元素非金属性Cl大于S的化学方程式为____________ 。
(二)实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各小题。
(4)实验装置:______
(5)实验步骤:
连接仪器、______ 、加药品后,打开a,然后滴入浓硫酸,加热(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是__________________ ;
装置E中足量酸性 溶液的作用是
溶液的作用是__________________ ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是____________ ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性______ (填“能”或“否”),理由是__________________ 。
(一)甲组同学设计实验探究Cl和S元素的非金属性。
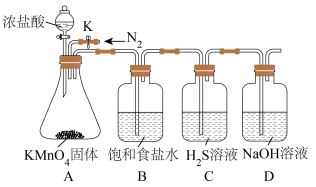
(2)B中饱和食盐水的作用是
(3)C中证明元素非金属性Cl大于S的化学方程式为
(二)实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各小题。
(4)实验装置:
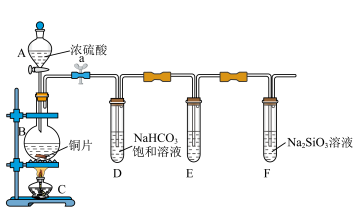
(5)实验步骤:
连接仪器、
①铜与浓硫酸反应的化学方程式是
装置E中足量酸性
 溶液的作用是
溶液的作用是②能说明碳元素的非金属性比硅元素非金属性强的实验现象是
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性
您最近半年使用:0次
名校
解题方法
3 . 焦亚硫酸钠( )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1) 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为__________ 。
(2)“ 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图:__________ 。
②饱和碳酸氢钠溶液的作用是__________ 。
③三颈烧瓶中生成 反应的化学方程式为
反应的化学方程式为__________ ( 为沉淀物)。
为沉淀物)。
(3)“ 制备”反应过程分四步:
制备”反应过程分四步:
步骤Ⅰ.在碳酸钠溶液中通入 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;
步骤Ⅱ.停止通 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;
步骤Ⅲ.继续通入 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;
步骤Ⅳ.当溶液中 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。
①步骤Ⅰ测量溶液的pH=4.1所用仪器是__________ 。
②写出步骤Ⅱ中反应的离子方程式:__________ 。
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:__________ 。
 )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1)
 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为(2)“
 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图: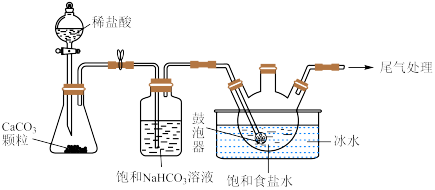
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成
 反应的化学方程式为
反应的化学方程式为 为沉淀物)。
为沉淀物)。(3)“
 制备”反应过程分四步:
制备”反应过程分四步:步骤Ⅰ.在碳酸钠溶液中通入
 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;步骤Ⅱ.停止通
 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;步骤Ⅲ.继续通入
 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;步骤Ⅳ.当溶液中
 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。①步骤Ⅰ测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:
您最近半年使用:0次
2024-03-30更新
|
260次组卷
|
5卷引用:山东省泰安市泰山国际学校2023-2024学年高二下学期3月月考化学试题
名校
解题方法
4 . 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取 晶体。(图中夹持及尾气处理装置均已略去)请回答下列问题:
晶体。(图中夹持及尾气处理装置均已略去)请回答下列问题:
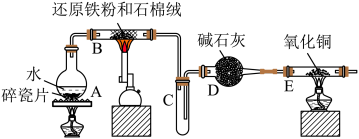
(1)装置 中发生反应的化学方程式是
中发生反应的化学方程式是___________ 。
(2) 中出现的现象是
中出现的现象是___________ 。
(3)该小组把 中反应后的产物加入足量的盐酸,用该溶液制取
中反应后的产物加入足量的盐酸,用该溶液制取 晶体。
晶体。
①欲检验溶液中含有 ,选用的试剂为
,选用的试剂为___________ ,现象是___________ 。
②该实验小组同学用上述试剂没有检测到 ,用离子方程式解释滤液中不存在
,用离子方程式解释滤液中不存在 可能的原因:
可能的原因:___________ 。
③将此滤液中 完全氧化为
完全氧化为 最好选择下列物质中的
最好选择下列物质中的___________ 。
A.酸性 溶液 B.
溶液 B. C.
C. D.
D.
④在③所得溶液浓缩结晶前需要用实验证明 已完全氧化,实验方法是
已完全氧化,实验方法是___________ 。
(4)取少量 于试管中,滴加
于试管中,滴加 溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:
溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:___________
______ ______
______ ______
______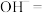 ______
______ ,该反应中
,该反应中 表现了
表现了___________ 性(填“氧化”或“还原”)。
 晶体。(图中夹持及尾气处理装置均已略去)请回答下列问题:
晶体。(图中夹持及尾气处理装置均已略去)请回答下列问题:
(1)装置
 中发生反应的化学方程式是
中发生反应的化学方程式是(2)
 中出现的现象是
中出现的现象是(3)该小组把
 中反应后的产物加入足量的盐酸,用该溶液制取
中反应后的产物加入足量的盐酸,用该溶液制取 晶体。
晶体。①欲检验溶液中含有
 ,选用的试剂为
,选用的试剂为②该实验小组同学用上述试剂没有检测到
 ,用离子方程式解释滤液中不存在
,用离子方程式解释滤液中不存在 可能的原因:
可能的原因:③将此滤液中
 完全氧化为
完全氧化为 最好选择下列物质中的
最好选择下列物质中的A.酸性
 溶液 B.
溶液 B. C.
C. D.
D.
④在③所得溶液浓缩结晶前需要用实验证明
 已完全氧化,实验方法是
已完全氧化,实验方法是(4)取少量
 于试管中,滴加
于试管中,滴加 溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:
溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:______
 ______
______ ______
______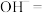 ______
______ ,该反应中
,该反应中 表现了
表现了
您最近半年使用:0次
名校
5 .  分子曾因污染空气而臭名昭著,但随着“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:
分子曾因污染空气而臭名昭著,但随着“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:
(1)汽车燃料中一般不含氮元素,尾气中所含的 是如何产生的?请用化学方程式解释相关原因
是如何产生的?请用化学方程式解释相关原因___________ 。
(2)在含有 的酶的活化中心,亚硝酸根离子(
的酶的活化中心,亚硝酸根离子( )可转化为
)可转化为 ,写出
,写出 和
和 在酸性溶液中转化为
在酸性溶液中转化为 的离子方程式
的离子方程式___________ 。
(3)一定条件下 可转化为
可转化为 和另一种红棕色气体,方程式为
和另一种红棕色气体,方程式为___________ 。
(4)镁铁混合物 ,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下
,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下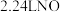 气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是
气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是___________ 。
 分子曾因污染空气而臭名昭著,但随着“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:
分子曾因污染空气而臭名昭著,但随着“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:(1)汽车燃料中一般不含氮元素,尾气中所含的
 是如何产生的?请用化学方程式解释相关原因
是如何产生的?请用化学方程式解释相关原因(2)在含有
 的酶的活化中心,亚硝酸根离子(
的酶的活化中心,亚硝酸根离子( )可转化为
)可转化为 ,写出
,写出 和
和 在酸性溶液中转化为
在酸性溶液中转化为 的离子方程式
的离子方程式(3)一定条件下
 可转化为
可转化为 和另一种红棕色气体,方程式为
和另一种红棕色气体,方程式为(4)镁铁混合物
 ,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下
,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下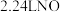 气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是
气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是
您最近半年使用:0次
6 . NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:___________NaNO2+___________HI=___________NO↑+___________I2+___________NaI+___________H2O。
(1)配平上述化学方程式_________ 。
(2)若有1mol的还原剂被氧化,则反应中转移电子的数目是___________ 。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋。进行试验,下列选项合适的是:___________(填字母)。
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用NH4Cl能使NaNO2转化为不引起二次污染的N2,反应的离子方程式为:___________ 。
(5)①配平以下化学方程式:___________ 。
___________Al+___________NaNO3+___________NaOH=___________NaAlO2+___________N2↑+___________。
②若反应过程中转移5mole-,则生成标准状况下N2的体积为___________ L。
(1)配平上述化学方程式
(2)若有1mol的还原剂被氧化,则反应中转移电子的数目是
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋。进行试验,下列选项合适的是:___________(填字母)。
| A.③⑤ | B.①②④ | C.①②⑤ | D.①③⑤ |
(5)①配平以下化学方程式:
___________Al+___________NaNO3+___________NaOH=___________NaAlO2+___________N2↑+___________。
②若反应过程中转移5mole-,则生成标准状况下N2的体积为
您最近半年使用:0次
名校
7 . 铁粉具有平肝镇心解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组设计利用 制备还原铁粉的流程如下。
制备还原铁粉的流程如下。

实验室中可用 (用废铁屑和稀硫酸反应制得)和
(用废铁屑和稀硫酸反应制得)和 在如图装置模拟上述流程中的“转化”环节。
在如图装置模拟上述流程中的“转化”环节。

(1)植物油的作用是___________ 。
(2)实验过程中,欲将得到的 溶液和
溶液和 溶液混合,操作方法是
溶液混合,操作方法是___________ 。混合后反应生成 的离子方程式为
的离子方程式为___________ 。
(3) 溶液要现用现配的原因是
溶液要现用现配的原因是___________ 。
(4)“干燥”的主要目的是脱去游离水,该过程中会有少量 在空气中被氧化为
在空气中被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;取干燥后的 样品11.33g,与木炭混合后焙烧,所有铁都被还原为还原铁粉,最终得到还原铁粉5.6g,样品中杂质
样品11.33g,与木炭混合后焙烧,所有铁都被还原为还原铁粉,最终得到还原铁粉5.6g,样品中杂质 的质量为
的质量为___________ g。在高温条件下,过量的木炭与 反应,写出此反应的化学方程式:
反应,写出此反应的化学方程式:___________ 。
 制备还原铁粉的流程如下。
制备还原铁粉的流程如下。
实验室中可用
 (用废铁屑和稀硫酸反应制得)和
(用废铁屑和稀硫酸反应制得)和 在如图装置模拟上述流程中的“转化”环节。
在如图装置模拟上述流程中的“转化”环节。
(1)植物油的作用是
(2)实验过程中,欲将得到的
 溶液和
溶液和 溶液混合,操作方法是
溶液混合,操作方法是 的离子方程式为
的离子方程式为(3)
 溶液要现用现配的原因是
溶液要现用现配的原因是(4)“干燥”的主要目的是脱去游离水,该过程中会有少量
 在空气中被氧化为
在空气中被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为 样品11.33g,与木炭混合后焙烧,所有铁都被还原为还原铁粉,最终得到还原铁粉5.6g,样品中杂质
样品11.33g,与木炭混合后焙烧,所有铁都被还原为还原铁粉,最终得到还原铁粉5.6g,样品中杂质 的质量为
的质量为 反应,写出此反应的化学方程式:
反应,写出此反应的化学方程式:
您最近半年使用:0次
2024-01-23更新
|
317次组卷
|
3卷引用:山东省肥城市第一高级中学等学校2023-2024学年高一上学期12月大联考化学试题
名校
8 . 按要求完成下列填空:
(1)写出 在水中的电离方程式
在水中的电离方程式___________ 。
(2)向新制氯水中滴加石蕊试液,溶液变红,起作用的微粒是___________ ;然后又褪色,起作用的微粒是___________ 。
(3)实验证明铜、不能在低温下与 反应,也不能与稀
反应,也不能与稀 共热发生反应,但工业上却是将废铜屑倒入热的稀
共热发生反应,但工业上却是将废铜屑倒入热的稀 中并通入空气来制备
中并通入空气来制备 溶液的。铜屑在此状态下被溶解的化学方程式为
溶液的。铜屑在此状态下被溶解的化学方程式为___________ 。
(4)过量铁粉与稀硝酸反应方程式为: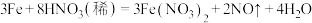 此反应中,被还原和未被还原的硝酸的物质的量之比为
此反应中,被还原和未被还原的硝酸的物质的量之比为___________ 。当产生 气体在标况下体积为
气体在标况下体积为 时,转移电子
时,转移电子___________  ,被还原的硝酸的物质的量为
,被还原的硝酸的物质的量为___________  。
。
(5)漂白粉是常用的消毒剂。漂白粉的有效成分是(填化学式)___________ 。
(1)写出
 在水中的电离方程式
在水中的电离方程式(2)向新制氯水中滴加石蕊试液,溶液变红,起作用的微粒是
(3)实验证明铜、不能在低温下与
 反应,也不能与稀
反应,也不能与稀 共热发生反应,但工业上却是将废铜屑倒入热的稀
共热发生反应,但工业上却是将废铜屑倒入热的稀 中并通入空气来制备
中并通入空气来制备 溶液的。铜屑在此状态下被溶解的化学方程式为
溶液的。铜屑在此状态下被溶解的化学方程式为(4)过量铁粉与稀硝酸反应方程式为:
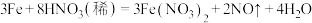 此反应中,被还原和未被还原的硝酸的物质的量之比为
此反应中,被还原和未被还原的硝酸的物质的量之比为 气体在标况下体积为
气体在标况下体积为 时,转移电子
时,转移电子 ,被还原的硝酸的物质的量为
,被还原的硝酸的物质的量为 。
。(5)漂白粉是常用的消毒剂。漂白粉的有效成分是(填化学式)
您最近半年使用:0次
名校
解题方法
9 . Ⅰ.过二硫酸铵[(NH4)2S2O8]广泛用于蓄电池工业,其电解法制备的装置如图所示:
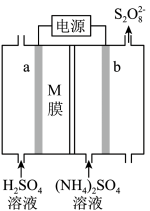
(1)已知:电解效率η的定义为η(B)=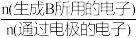 ×100%
×100%
①M膜为___________ (填“阳”或“阴”)离子交换膜,生成 的电极反应式是
的电极反应式是___________ 。
②向阳极室和阴极室各加入100mL溶液。经测定制备的(NH4)2S2O8的物质的量浓度为0.02mol/L,在电极a、b表面共收集到2.75×10-3mol气体。则电极b表面收集到的气体是___________ ,η( )为
)为___________ 。
(2)取电解后的b极室溶液少许于甲、乙两支试管中,进行下列实验:向甲试管中滴入酸化的KI和淀粉溶液并微热,溶液变蓝,说明过二硫酸铵具有___________ (填“氧化”或“还原”)性;向乙试管中滴入酸化的MnSO4溶液及1滴AgNO3溶液(催化)并微热,溶液变紫色,能说明该现象的离子方程式为___________ 。
Ⅱ.纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。
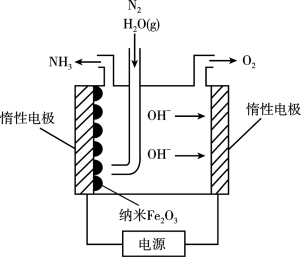
(3)已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:___________ ;
第二步:___________ 。

(1)已知:电解效率η的定义为η(B)=
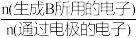 ×100%
×100%①M膜为
 的电极反应式是
的电极反应式是②向阳极室和阴极室各加入100mL溶液。经测定制备的(NH4)2S2O8的物质的量浓度为0.02mol/L,在电极a、b表面共收集到2.75×10-3mol气体。则电极b表面收集到的气体是
 )为
)为(2)取电解后的b极室溶液少许于甲、乙两支试管中,进行下列实验:向甲试管中滴入酸化的KI和淀粉溶液并微热,溶液变蓝,说明过二硫酸铵具有
Ⅱ.纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。

(3)已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:
第二步:
您最近半年使用:0次
10 . 二氧化氯( )具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:
)具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:
(1) 与热水反应得到
与热水反应得到 、
、 。该反应的氧化产物是一种不含氯元素的气体,其分子式为
。该反应的氧化产物是一种不含氯元素的气体,其分子式为___________ 。
(2)将1
 通入
通入 和
和 的混合溶液中,充分反应后有
的混合溶液中,充分反应后有 生成,反应中共转移5
生成,反应中共转移5 电子,则发生反应的离子方程式为
电子,则发生反应的离子方程式为___________ 。
(3) 可通过下列反应制备:
可通过下列反应制备:
①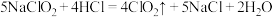
②
用上述两种方法制备等质量的 转移电子数之比为
转移电子数之比为___________ 。现在科学家研究出用草酸( )在酸性条件下还原
)在酸性条件下还原 的制备方法。已知
的制备方法。已知 被氧化生成
被氧化生成 。写出该制备方法的离子方程式:
。写出该制备方法的离子方程式:___________ 。该方法最突出的优点是___________ 。
(4)通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的大小。 和
和 在消毒时自身均被还原为
在消毒时自身均被还原为 ,则
,则 的消毒效率是
的消毒效率是 的
的___________ 倍(保留两位小数)。
 )具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:
)具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:(1)
 与热水反应得到
与热水反应得到 、
、 。该反应的氧化产物是一种不含氯元素的气体,其分子式为
。该反应的氧化产物是一种不含氯元素的气体,其分子式为(2)将1

 通入
通入 和
和 的混合溶液中,充分反应后有
的混合溶液中,充分反应后有 生成,反应中共转移5
生成,反应中共转移5 电子,则发生反应的离子方程式为
电子,则发生反应的离子方程式为(3)
 可通过下列反应制备:
可通过下列反应制备:①
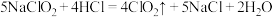
②

用上述两种方法制备等质量的
 转移电子数之比为
转移电子数之比为 )在酸性条件下还原
)在酸性条件下还原 的制备方法。已知
的制备方法。已知 被氧化生成
被氧化生成 。写出该制备方法的离子方程式:
。写出该制备方法的离子方程式:(4)通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的大小。
 和
和 在消毒时自身均被还原为
在消毒时自身均被还原为 ,则
,则 的消毒效率是
的消毒效率是 的
的
您最近半年使用:0次



