名校
1 . 在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。
(1)完成并配平下列化学方程式:_____________
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是_____________ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________ mol。
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为
您最近一年使用:0次
2018-12-11更新
|
125次组卷
|
4卷引用:【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题
【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题(已下线)2010年福建省厦门市杏南中学高三上学期10月月考化学卷福建省惠安惠南中学2019届高三上学期期中考试化学试题宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题
解题方法
2 . 某学习小组为认识铁及其化合物的性质和分散系的性质做了如下一系列综合实验。运用所学知识,回答下列问题:
(1)可利用_______ 来区分Fe(OH)3胶体和FeCl3溶液。
(2)铁粉与水蒸气在高温条件下反应的化学方程式是_______ 。
(3)电子工业中,人们常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并从废液中回收 和FeCl3溶液。实验室模拟流程如图所示:
和FeCl3溶液。实验室模拟流程如图所示:

①请写出FeCl3溶液与铜反应的离子方程式_______ 。
②试剂X在反应中体现_______ (填“氧化性”或“还原性”)。
③Z可选用的试剂有_______ (填序号)。
A.硝酸 B.酸性高锰酸钾溶液 C.过氧化氢 D.氯气
(1)可利用
(2)铁粉与水蒸气在高温条件下反应的化学方程式是
(3)电子工业中,人们常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并从废液中回收
 和FeCl3溶液。实验室模拟流程如图所示:
和FeCl3溶液。实验室模拟流程如图所示:
①请写出FeCl3溶液与铜反应的离子方程式
②试剂X在反应中体现
③Z可选用的试剂有
A.硝酸 B.酸性高锰酸钾溶液 C.过氧化氢 D.氯气
您最近一年使用:0次
名校
3 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
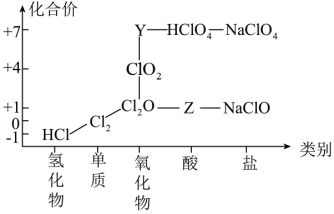
(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。
(2)已知高氯酸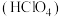 是强酸,写出高氯酸与铁反应的离子方程式
是强酸,写出高氯酸与铁反应的离子方程式_______ 。
(3)氯气既有氧化性又有还原性,结合上图说明理由_______ 。请举例证明氯气体现氧化性的化学方程式,并在方程式上用单线桥标出转移的电子数_______
(4)标况下,将
 气体溶于水形成
气体溶于水形成 溶液,取出
溶液,取出 ,其中所含溶质的质量为
,其中所含溶质的质量为_______ g。

(1)根据图中信息写出Y、Z的化学式
(2)已知高氯酸
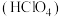 是强酸,写出高氯酸与铁反应的离子方程式
是强酸,写出高氯酸与铁反应的离子方程式(3)氯气既有氧化性又有还原性,结合上图说明理由
(4)标况下,将

 气体溶于水形成
气体溶于水形成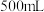 溶液,取出
溶液,取出 ,其中所含溶质的质量为
,其中所含溶质的质量为
您最近一年使用:0次
名校
解题方法
4 . 在“价—类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。如图中的字母分别代表硫及其常见化合物,相关推断不合理的是
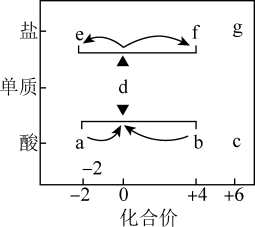
| A.b既具有氧化性又具有还原性 |
| B.硫酸型酸雨的形成过程涉及b到c的转化 |
| C.a溶液与b溶液反应过程中有淡黄色沉淀生成 |
| D.d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:2 |
您最近一年使用:0次
2022-04-23更新
|
1470次组卷
|
8卷引用:山东省泰安市2022届高三下学期三轮验收考试化学试题
5 . 铬是是钢铁(主要成分是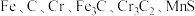 等)中可缺少的元素,提高钢的机械性和耐磨性,测定钢铁中铬含量的流程如图所示,请回答以下问题。
等)中可缺少的元素,提高钢的机械性和耐磨性,测定钢铁中铬含量的流程如图所示,请回答以下问题。

已知:①磷酸与三价铁可以生成无色稳定的络合物。
②加入浓硝酸的目的是将样品钢中的碳化物充分溶解。
③过硫酸铵具有强氧化性,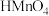 显紫红色,还原性
显紫红色,还原性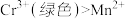 。
。
(1)不直接用浓硝酸溶解样品钢的原因是___________ ,酸浸后产生的气体1为___________ 。
(2)在酸浸时发生下列反应,请填上产物并配平:___________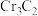 +___________
+___________ →___________
→___________ +___________C+___________,
+___________C+___________,___________
(3)加入过硫酸铵溶液时,一定要加到溶液1变成紫红色,原因是___________ 。
(4)在紫红色溶液中加入NaCl,除去 后,控制溶液的pH为3~4,使氯化钠只与高锰酸反应,请写出该反应的离子方程式
后,控制溶液的pH为3~4,使氯化钠只与高锰酸反应,请写出该反应的离子方程式___________ 。
(5)在用 滴定浅黄色溶液2时,需要加入铬钒指示剂,铬钒指示剂在氧化性试液中显紫红色,在还原性试液中显无色,则滴定终点时溶液3的颜色是
滴定浅黄色溶液2时,需要加入铬钒指示剂,铬钒指示剂在氧化性试液中显紫红色,在还原性试液中显无色,则滴定终点时溶液3的颜色是___________ 。
(6)取0.5000g样品钢于250mL锥形瓶中,加入硫酸与磷酸的混合酸30mL,滴加浓硝酸,加入0.05 过硫酸铵溶液和硝酸银,充分反应后煮沸,将多余的过硫酸铵完全分解,加入NaCl,调节pH为3~4,充分搅拌后,冷却至室温,加入3滴铬钒指示剂,用
过硫酸铵溶液和硝酸银,充分反应后煮沸,将多余的过硫酸铵完全分解,加入NaCl,调节pH为3~4,充分搅拌后,冷却至室温,加入3滴铬钒指示剂,用 滴定,滴定终点时消耗
滴定,滴定终点时消耗 的体积如下:
的体积如下:
则样品钢中Cr的质量分数为___________ %(结果保留四位有效数字)。
(7)如果滴定前,不加入NaCl,测得结果会___________ (填“偏低”“偏高”或“不影响”)。
 等)中可缺少的元素,提高钢的机械性和耐磨性,测定钢铁中铬含量的流程如图所示,请回答以下问题。
等)中可缺少的元素,提高钢的机械性和耐磨性,测定钢铁中铬含量的流程如图所示,请回答以下问题。
已知:①磷酸与三价铁可以生成无色稳定的络合物。
②加入浓硝酸的目的是将样品钢中的碳化物充分溶解。
③过硫酸铵具有强氧化性,
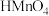 显紫红色,还原性
显紫红色,还原性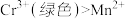 。
。(1)不直接用浓硝酸溶解样品钢的原因是
(2)在酸浸时发生下列反应,请填上产物并配平:___________
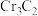 +___________
+___________ →___________
→___________ +___________C+___________,
+___________C+___________,(3)加入过硫酸铵溶液时,一定要加到溶液1变成紫红色,原因是
(4)在紫红色溶液中加入NaCl,除去
 后,控制溶液的pH为3~4,使氯化钠只与高锰酸反应,请写出该反应的离子方程式
后,控制溶液的pH为3~4,使氯化钠只与高锰酸反应,请写出该反应的离子方程式(5)在用
 滴定浅黄色溶液2时,需要加入铬钒指示剂,铬钒指示剂在氧化性试液中显紫红色,在还原性试液中显无色,则滴定终点时溶液3的颜色是
滴定浅黄色溶液2时,需要加入铬钒指示剂,铬钒指示剂在氧化性试液中显紫红色,在还原性试液中显无色,则滴定终点时溶液3的颜色是(6)取0.5000g样品钢于250mL锥形瓶中,加入硫酸与磷酸的混合酸30mL,滴加浓硝酸,加入0.05
 过硫酸铵溶液和硝酸银,充分反应后煮沸,将多余的过硫酸铵完全分解,加入NaCl,调节pH为3~4,充分搅拌后,冷却至室温,加入3滴铬钒指示剂,用
过硫酸铵溶液和硝酸银,充分反应后煮沸,将多余的过硫酸铵完全分解,加入NaCl,调节pH为3~4,充分搅拌后,冷却至室温,加入3滴铬钒指示剂,用 滴定,滴定终点时消耗
滴定,滴定终点时消耗 的体积如下:
的体积如下:| 开始读数(mL) | 结束读数(mL) | |
| 第一次 | 2.00 | 7.62 |
| 第二次 | 0.00 | 5.42 |
| 第三次 | 2.00 | 7.60 |
则样品钢中Cr的质量分数为
(7)如果滴定前,不加入NaCl,测得结果会
您最近一年使用:0次
名校
解题方法
6 . 海水中溴含量约为65mg·L-1,从海水中提取溴的工艺流程如图:
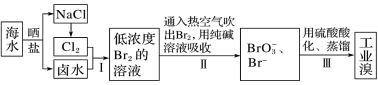
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是_____ 。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的______ (填字母)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
________ Br2+________  =
=________  +
+_ Br-+_ CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:______ 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是______ (填字母)。
A.稀硫酸 B.四氯化碳 C.烧碱溶液 D.水

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
 =
= +
+(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是
A.稀硫酸 B.四氯化碳 C.烧碱溶液 D.水
您最近一年使用:0次
2020-07-06更新
|
534次组卷
|
4卷引用:山东省新泰市第一中学2019-2020高一下学期化学期末模拟二
名校
解题方法
7 . NaClO2是一种重要的杀菌消毒剂,消毒时本身被还原成氯离子,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为__________ 。
(2)写出“反应”步骤中生成ClO2的离子方程式________ ,该过程体现了SO2的______________ ( 选填:a 氧化性、b还原性、c漂白性、d酸性氧化物的通性)
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去SO 和Mg2+要加入的试剂分别为
和Mg2+要加入的试剂分别为__________ 、__________ 。“电解”过程的氧化产物是Cl2,则还原产物是_______ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应的化学方程式为__________ ,实验室进行结晶操作使用的仪器有铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳和__________ 。
(5)消毒能力可用单位质量消毒剂得电子多少来衡量。NaClO2与Cl2消毒能力比为___________ 。(不必化简)。

回答下列问题:
(1)NaClO2中Cl的化合价为
(2)写出“反应”步骤中生成ClO2的离子方程式
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去SO
 和Mg2+要加入的试剂分别为
和Mg2+要加入的试剂分别为(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应的化学方程式为
(5)消毒能力可用单位质量消毒剂得电子多少来衡量。NaClO2与Cl2消毒能力比为
您最近一年使用:0次
2020-06-15更新
|
326次组卷
|
2卷引用: 山东省泰安市2022-2023学年高一上学期期末考试化学试题
8 . 二氧化氯( )具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:
)具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:
(1) 与热水反应得到
与热水反应得到 、
、 。该反应的氧化产物是一种不含氯元素的气体,其分子式为
。该反应的氧化产物是一种不含氯元素的气体,其分子式为___________ 。
(2)将1
 通入
通入 和
和 的混合溶液中,充分反应后有
的混合溶液中,充分反应后有 生成,反应中共转移5
生成,反应中共转移5 电子,则发生反应的离子方程式为
电子,则发生反应的离子方程式为___________ 。
(3) 可通过下列反应制备:
可通过下列反应制备:
①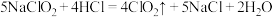
②
用上述两种方法制备等质量的 转移电子数之比为
转移电子数之比为___________ 。现在科学家研究出用草酸( )在酸性条件下还原
)在酸性条件下还原 的制备方法。已知
的制备方法。已知 被氧化生成
被氧化生成 。写出该制备方法的离子方程式:
。写出该制备方法的离子方程式:___________ 。该方法最突出的优点是___________ 。
(4)通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的大小。 和
和 在消毒时自身均被还原为
在消毒时自身均被还原为 ,则
,则 的消毒效率是
的消毒效率是 的
的___________ 倍(保留两位小数)。
 )具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:
)具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:(1)
 与热水反应得到
与热水反应得到 、
、 。该反应的氧化产物是一种不含氯元素的气体,其分子式为
。该反应的氧化产物是一种不含氯元素的气体,其分子式为(2)将1

 通入
通入 和
和 的混合溶液中,充分反应后有
的混合溶液中,充分反应后有 生成,反应中共转移5
生成,反应中共转移5 电子,则发生反应的离子方程式为
电子,则发生反应的离子方程式为(3)
 可通过下列反应制备:
可通过下列反应制备:①
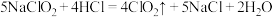
②

用上述两种方法制备等质量的
 转移电子数之比为
转移电子数之比为 )在酸性条件下还原
)在酸性条件下还原 的制备方法。已知
的制备方法。已知 被氧化生成
被氧化生成 。写出该制备方法的离子方程式:
。写出该制备方法的离子方程式:(4)通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的大小。
 和
和 在消毒时自身均被还原为
在消毒时自身均被还原为 ,则
,则 的消毒效率是
的消毒效率是 的
的
您最近一年使用:0次
12-13高三上·山东泰安·期末
9 . 关于As的反应中,反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是_______ 。
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为_______ 。
③根据上述反应可推知_______ 。(填序号)
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
④在该反应中,氧化剂与还原剂的物质的量之比为_______ 。
①已知KBrO3在反应中得到电子,则该反应的还原剂是
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为
③根据上述反应可推知
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
④在该反应中,氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解题方法
10 . 含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知:Cr3+ Cr(OH)3
Cr(OH)3 CrO
CrO
(1)含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O 与FeSO4溶液在酸性条件下反应的离子方程式
与FeSO4溶液在酸性条件下反应的离子方程式_______
②用离子方程式表示溶液pH不能超过10的原因_______
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和CrO 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去。
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去。
①写出阴极的电极反应式_______ 。
②电解法中加入氯化钠的作用是_______ 。
(3)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
①CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:_______ 。
②CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。则B点时剩余固体的成分是_______ (填化学式)。

已知:Cr3+
 Cr(OH)3
Cr(OH)3 CrO
CrO
(1)含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O
 与FeSO4溶液在酸性条件下反应的离子方程式
与FeSO4溶液在酸性条件下反应的离子方程式②用离子方程式表示溶液pH不能超过10的原因
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和CrO
 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去。
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去。①写出阴极的电极反应式
②电解法中加入氯化钠的作用是
(3)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
①CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
②CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。则B点时剩余固体的成分是

您最近一年使用:0次



