名校
解题方法
1 . 某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一)碘含量的测定
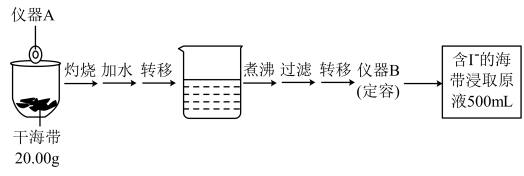
取100.00mL海带浸取原液于锥形瓶中,用 的
的 标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。
标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。
(1)仪器A的名称为_____ ;仪器B的名称为:_____ 。
(2)计算海带中碘的百分含量为_____ %。
实验(二)碘的制取
另取海带浸取原液,甲、乙两种实验方案如下:

已知: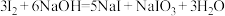 ;酸性条件下,
;酸性条件下, 在水溶液中的溶解度很小。
在水溶液中的溶解度很小。
(3)“适量 ”中能代替
”中能代替 的最佳物质的电子式为
的最佳物质的电子式为_____ 。
(4)下列有关步骤Y的说法,正确的是_____。
(5)方案乙中,上层液体加入 溶液,反应的离子方程式为:
溶液,反应的离子方程式为:_____ ,其中操作Z的名称是_____ 。
实验(一)碘含量的测定

取100.00mL海带浸取原液于锥形瓶中,用
 的
的 标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。
标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。(1)仪器A的名称为
(2)计算海带中碘的百分含量为
实验(二)碘的制取
另取海带浸取原液,甲、乙两种实验方案如下:

已知:
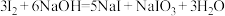 ;酸性条件下,
;酸性条件下, 在水溶液中的溶解度很小。
在水溶液中的溶解度很小。(3)“适量
 ”中能代替
”中能代替 的最佳物质的电子式为
的最佳物质的电子式为(4)下列有关步骤Y的说法,正确的是_____。
A.应控制 溶液的浓度和体积 溶液的浓度和体积 |
| B.将碘转化成离子进入水层 |
| C.主要是除浸取原液中的有机杂质 |
D. 溶液可由乙醇代替 溶液可由乙醇代替 |
(5)方案乙中,上层液体加入
 溶液,反应的离子方程式为:
溶液,反应的离子方程式为:
您最近半年使用:0次
名校
2 . 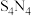 是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用
是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用 和
和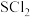 制备
制备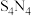 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知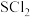 易水解,熔点为-78℃,沸点为60℃。
易水解,熔点为-78℃,沸点为60℃。
Ⅰ.制备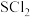
(1)操作步骤的先后顺序为___________ 。
①组装仪器并检验装置气密性,加入药品
②加热装置C使其中的硫磺熔化
③通入 ,通冷凝水,一段时间后,关闭
,通冷凝水,一段时间后,关闭
④打开 、
、 ,关闭
,关闭
⑤充分反应后停止滴加浓盐酸
⑥向装置A中滴加浓盐酸,加热装置C至135℃左右
(2)仪器b的名称为___________ ,装置B中盛放的试剂为___________ (填试剂名称)。
(3)为使装置C受热均匀,可采取的加热方式为___________ ,装置D的作用为___________ 。
Ⅱ.制备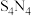
打开止水夹 ,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
(4)生成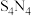 的同时还生成一种常见固体单质和一种盐,反应的化学方程式为
的同时还生成一种常见固体单质和一种盐,反应的化学方程式为___________ 。
Ⅲ.测定的纯度
称取5.00g 样品,加入NaOH溶液加热,使氮元素完全转化为 ,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00
,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00 盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为
盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为 。
。
(5)制得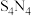 的纯度为
的纯度为___________ 。下列实验操作导致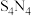 测定结果偏低的是
测定结果偏低的是___________ 。
A.盛放待测液的锥形瓶洗涤后未干燥直接使用
B.移液管用蒸馏水洗涤后未用吸收液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定前仰视滴定管读数,滴定后俯视读数
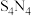 是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用
是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用 和
和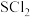 制备
制备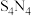 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知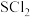 易水解,熔点为-78℃,沸点为60℃。
易水解,熔点为-78℃,沸点为60℃。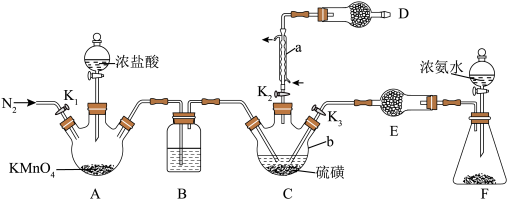
Ⅰ.制备
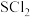
(1)操作步骤的先后顺序为
①组装仪器并检验装置气密性,加入药品
②加热装置C使其中的硫磺熔化
③通入
 ,通冷凝水,一段时间后,关闭
,通冷凝水,一段时间后,关闭
④打开
 、
、 ,关闭
,关闭
⑤充分反应后停止滴加浓盐酸
⑥向装置A中滴加浓盐酸,加热装置C至135℃左右
(2)仪器b的名称为
(3)为使装置C受热均匀,可采取的加热方式为
Ⅱ.制备
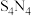
打开止水夹
 ,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。(4)生成
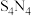 的同时还生成一种常见固体单质和一种盐,反应的化学方程式为
的同时还生成一种常见固体单质和一种盐,反应的化学方程式为Ⅲ.测定的纯度
称取5.00g 样品,加入NaOH溶液加热,使氮元素完全转化为
 ,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00
,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00 盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为
盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为 。
。(5)制得
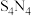 的纯度为
的纯度为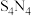 测定结果偏低的是
测定结果偏低的是A.盛放待测液的锥形瓶洗涤后未干燥直接使用
B.移液管用蒸馏水洗涤后未用吸收液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定前仰视滴定管读数,滴定后俯视读数
您最近半年使用:0次
2024-03-14更新
|
876次组卷
|
3卷引用:山东省烟台市2024届高三一模化学试题
名校
3 . 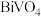 是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、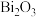 、NiO及少量
、NiO及少量 、
、 )制备
)制备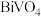 的工艺流程如下:
的工艺流程如下: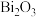 、NiO都是不溶于水的碱性氧化物
、NiO都是不溶于水的碱性氧化物
Ⅱ.0.1
 溶液的pH=1.0
溶液的pH=1.0
Ⅲ.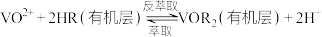
回答下列问题:
(1)滤渣的主要成分是___________ ;酸化时, 完全转化为
完全转化为 的最大pH为
的最大pH为___________ 。(已知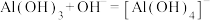
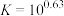 ;离子浓度≤10-5mol/L时沉淀完全)
;离子浓度≤10-5mol/L时沉淀完全)
(2)“酸化”后的溶液中存在 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为___________ 。
(3)反萃取剂应选用___________ (填“酸性”、“中性”或“碱性”)溶液;若“萃取”、“反萃取”的过程中钒的总回收率为90%,则“还原”时加入的 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为___________ 。
(4)生成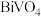 的化学方程式为
的化学方程式为___________ ,实验测得溶液pH、温度和 溶液浓度对生成
溶液浓度对生成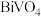 的粒径影响图像如下:
的粒径影响图像如下: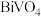 晶体的最佳条件是
晶体的最佳条件是___________ ;制备过程中需加入NaOH维持最佳pH,若 过量,需要增加NaOH的用量,原因是
过量,需要增加NaOH的用量,原因是___________ 。
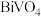 是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、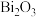 、NiO及少量
、NiO及少量 、
、 )制备
)制备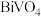 的工艺流程如下:
的工艺流程如下: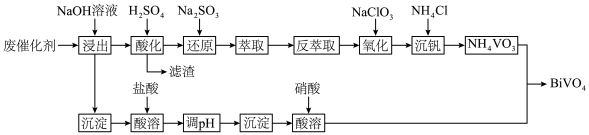
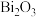 、NiO都是不溶于水的碱性氧化物
、NiO都是不溶于水的碱性氧化物Ⅱ.0.1

 溶液的pH=1.0
溶液的pH=1.0Ⅲ.
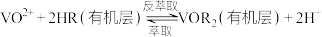
回答下列问题:
(1)滤渣的主要成分是
 完全转化为
完全转化为 的最大pH为
的最大pH为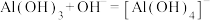
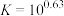 ;离子浓度≤10-5mol/L时沉淀完全)
;离子浓度≤10-5mol/L时沉淀完全)(2)“酸化”后的溶液中存在
 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为(3)反萃取剂应选用
 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为(4)生成
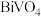 的化学方程式为
的化学方程式为 溶液浓度对生成
溶液浓度对生成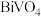 的粒径影响图像如下:
的粒径影响图像如下: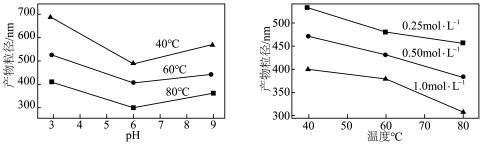
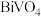 晶体的最佳条件是
晶体的最佳条件是 过量,需要增加NaOH的用量,原因是
过量,需要增加NaOH的用量,原因是
您最近半年使用:0次
2024-03-14更新
|
972次组卷
|
5卷引用:山东省烟台市2024届高三一模化学试题
4 . 工业上以富钒炉渣(主要含FeO·V2O3、V2O5和少量的SiO2、Al2O3等)为原料制备V2O5的工艺流程如下:
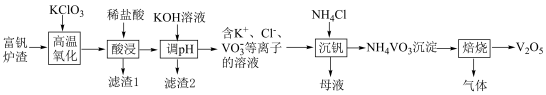
已知:①+ 5价钒元素在溶液中的存在形式与溶液pH的关系:
②Ksp[Fe(OH)3]=2.6×10–39;Ksp[Al(OH)3]=1.0×10–33;Ksp(NH4VO3)=1.6×10–3
回答下列问题:
(1)“高温氧化”前将富钒炉渣研磨粉碎的目的是___________ ;“高温氧化”过程中发生主要反应的化学方程式为___________ 。
(2)滤渣1的主要成分为___________ ;“调pH”时需将Fe3+、Al3+除尽(浓度≤1×10–5 mol∙L–1时,可认为已除尽),需调节pH的范围为___________ 。
(3)若“沉钒”前溶液中c(VO )=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH
)=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH )为
)为___________ mol·L–1。过滤、洗涤、干燥得到NH4VO3沉淀,检验NH4VO3沉淀是否洗净的操作是___________ 。
(4)“焙烧”时生成两种参与大气循环的无毒物质,则该反应的化学方程式为___________ 。

已知:①+ 5价钒元素在溶液中的存在形式与溶液pH的关系:
| 溶液pH | <1.0 | 1.0~4.0 | 4.0~6.0 | 6.0~8.5 | 8.5~13.0 | >13.0 |
| 钒元素存在形式 | VO | V2O5 | 多矾酸根 | VO | 多矾酸根 | VO |
| 备注 | 多矾酸盐在水中溶解度较小 | |||||
回答下列问题:
(1)“高温氧化”前将富钒炉渣研磨粉碎的目的是
(2)滤渣1的主要成分为
(3)若“沉钒”前溶液中c(VO
 )=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH
)=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH )为
)为(4)“焙烧”时生成两种参与大气循环的无毒物质,则该反应的化学方程式为
您最近半年使用:0次
名校
解题方法
5 . 亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:① ;
;
②气体液化的温度: 为21℃,NO为-152℃,
为21℃,NO为-152℃,
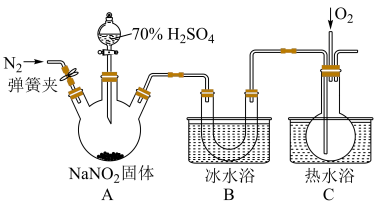
(1)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是___________ 。
(2)该实验装置的明显缺陷是___________ 。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是___________ ;
②装置B的作用是___________ 。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式:___________ 。
(5)①水合肼(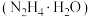 )是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素
)是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素 (尿素中的C为+4,N为-3)反应制得粗肼(
(尿素中的C为+4,N为-3)反应制得粗肼( ),则NaClO与尿素的物质的量之比为
),则NaClO与尿素的物质的量之比为___________ 。
②火箭发射时可用肼( )为燃料,二氧化氮作氧化剂,生成无毒害的物质,写出反应的化学方程式
)为燃料,二氧化氮作氧化剂,生成无毒害的物质,写出反应的化学方程式___________ 。
已知:①
 ;
;②气体液化的温度:
 为21℃,NO为-152℃,
为21℃,NO为-152℃,
(1)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是
(2)该实验装置的明显缺陷是
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是
②装置B的作用是
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式:
(5)①水合肼(
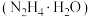 )是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素
)是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素 (尿素中的C为+4,N为-3)反应制得粗肼(
(尿素中的C为+4,N为-3)反应制得粗肼( ),则NaClO与尿素的物质的量之比为
),则NaClO与尿素的物质的量之比为②火箭发射时可用肼(
 )为燃料,二氧化氮作氧化剂,生成无毒害的物质,写出反应的化学方程式
)为燃料,二氧化氮作氧化剂,生成无毒害的物质,写出反应的化学方程式
您最近半年使用:0次
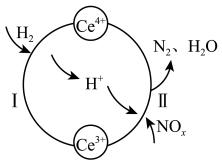
6 . 用还原法可将烟气中的氮氧化物 转化为无害物质。常温下,将
转化为无害物质。常温下,将 与
与 的混合气体通入
的混合气体通入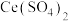 与
与 的混合溶液中,其转化过程如图所示。下列说法错误的是
的混合溶液中,其转化过程如图所示。下列说法错误的是
 转化为无害物质。常温下,将
转化为无害物质。常温下,将 与
与 的混合气体通入
的混合气体通入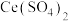 与
与 的混合溶液中,其转化过程如图所示。下列说法错误的是
的混合溶液中,其转化过程如图所示。下列说法错误的是
A.反应I的离子方程式为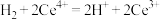 |
B.反应Ⅱ中氧化剂与还原剂的物质的量之比为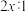 |
C.该转化过程的实质是 被 被 还原 还原 |
D.反应前、后溶液中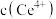 保持不变 保持不变 |
您最近半年使用:0次
名校
解题方法
7 . 从干海带中提取碘的实验流程如下:
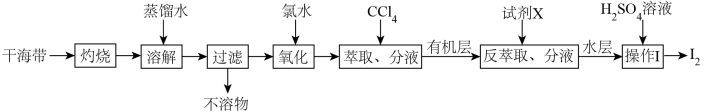
| A.氧化步骤中氯水可用过氧化氢代替 |
B.试剂X可以为 ,反萃取的离子方程式为: ,反萃取的离子方程式为: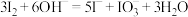 |
C. 可循环利用以有效提高干海带提碘的产率 可循环利用以有效提高干海带提碘的产率 |
| D.操作Ⅰ要用到普通漏斗、烧杯和玻璃棒 |
您最近半年使用:0次
2024-01-28更新
|
555次组卷
|
4卷引用:山东省烟台市莱州市第一中学2023-2024学年高一下学期开学化学试题
名校
解题方法
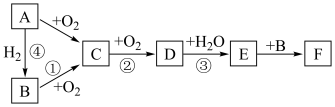
8 . 如图是无机物A~F在一定条件下的转化关系(部分产物及反应条件未标出)。
已知:A为气体,A~F都含有相同的元素。
(1)写出下列物质的化学式:C___________ 、F___________
(2)在①②③④中属于氮的固定的是___________ (填序号)
(3)D易溶于水。常温常压下(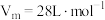 ),将体积为VmL的试管充满D后倒扣在水中。
),将体积为VmL的试管充满D后倒扣在水中。
①最终试管中所得E的物质的量浓度为(不考虑E的扩散)___________  。
。
②为了消除D的污染,可将它与B在催化剂作用下反应,生成水和一种无污染物质,该反应的化学方程式是___________ 。
③若C、D按物质的量之比1:1被 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是___________ 。为提高吸收速率与效率,最好选用___________ 装置(填序号)。 的物质的量为
的物质的量为___________ 。
已知:A为气体,A~F都含有相同的元素。
(1)写出下列物质的化学式:C
(2)在①②③④中属于氮的固定的是
(3)D易溶于水。常温常压下(
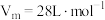 ),将体积为VmL的试管充满D后倒扣在水中。
),将体积为VmL的试管充满D后倒扣在水中。①最终试管中所得E的物质的量浓度为(不考虑E的扩散)
 。
。②为了消除D的污染,可将它与B在催化剂作用下反应,生成水和一种无污染物质,该反应的化学方程式是
③若C、D按物质的量之比1:1被
 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是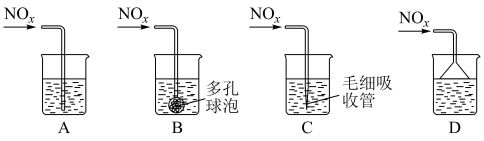
 的物质的量为
的物质的量为
您最近半年使用:0次
2024-01-28更新
|
272次组卷
|
3卷引用:山东省烟台市莱州市第一中学2023-2024学年高一上学期1月月考化学试题
解题方法
9 . 油画创作通常需要用到多种无机颜料。研究发现,在不同空气湿度和光照条件下,颜料雌黄( ,S为-2价)褪色的主要原因是发生了以下两种化学反应。下列说法错误的是
,S为-2价)褪色的主要原因是发生了以下两种化学反应。下列说法错误的是
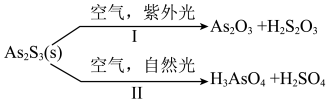
 ,S为-2价)褪色的主要原因是发生了以下两种化学反应。下列说法错误的是
,S为-2价)褪色的主要原因是发生了以下两种化学反应。下列说法错误的是
A.反应Ⅰ中 为氧化产物 为氧化产物 |
B.反应Ⅱ的化学方程式为 |
| C.与反应Ⅱ相比,反应Ⅰ所需的空气湿度更大 |
D.反应等量的 ,反应Ⅰ和Ⅱ转移电子数之比为3∶7 ,反应Ⅰ和Ⅱ转移电子数之比为3∶7 |
您最近半年使用:0次
名校
10 . Na2O2用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备Na2O2并检验其纯度的实验流程如图所示。

回答下列问题:
(1)生成Na2O2的化学方程式为___________ 。
(2)样液中加入MnO2后产生一种无色无味的气体单质,该气体的名称为___________ 。
(3)已知白色沉淀为BaCO3,生成该沉淀的化学方程式是___________ ,为防止Na2O2样品中含有的杂质生成需对空气进行预处理,预处理的措施是___________ 。
(4)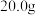 Na2O2样品可消耗
Na2O2样品可消耗 的BaCl2溶液
的BaCl2溶液 ,该样品的纯度为
,该样品的纯度为________ 。

回答下列问题:
(1)生成Na2O2的化学方程式为
(2)样液中加入MnO2后产生一种无色无味的气体单质,该气体的名称为
(3)已知白色沉淀为BaCO3,生成该沉淀的化学方程式是
(4)
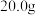 Na2O2样品可消耗
Na2O2样品可消耗 的BaCl2溶液
的BaCl2溶液 ,该样品的纯度为
,该样品的纯度为
您最近半年使用:0次
2023-08-10更新
|
236次组卷
|
6卷引用:山东省莱阳市第一中学2023-2024学年高一上学期10月月考化学试题



