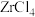1 . 锆是一种稀有金属,广泛用在航空航天、军工、核反应、原子能领域。一种以锆英砂(主要含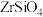 ,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下:
,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下: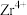 、
、 、
、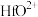 、
、 ;
;
②25℃时, ,
,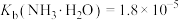 ;
;
③部分氯化物的沸点数据如表所示:
回答下列问题:
(1)“碱熔”时有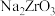 生成,则
生成,则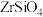 发生反应的化学方程式为
发生反应的化学方程式为______ ,温度和时间对锆英砂碱熔分解率的影响如图所示,应采取的条件为______ 。______ ,流程中可循环利用的物质除TOPO外,还有______ (填化学式)。
(3)“氨沉”时产物为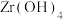 、
、 和
和 ,反应结束后溶液中
,反应结束后溶液中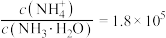 ,则
,则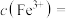
______  ,“滤液2”中主要成分是
,“滤液2”中主要成分是______ (填化学式)。
(4)“煅烧”时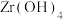 分解生成
分解生成 ,“沸腾氯化”时
,“沸腾氯化”时 发生反应的化学方程式为
发生反应的化学方程式为______ ,氯化反应结束通入 ,目的是
,目的是______ 。
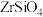 ,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下:
,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下: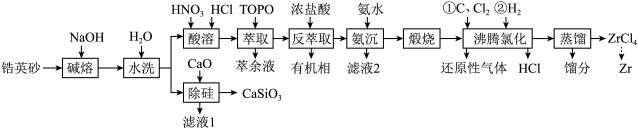
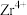 、
、 、
、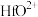 、
、 ;
;②25℃时,
 ,
,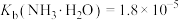 ;
;③部分氯化物的沸点数据如表所示:
物质 |
|
|
|
|
沸点/℃ | 331 | 1300 | 316 | 700 |
(1)“碱熔”时有
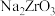 生成,则
生成,则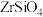 发生反应的化学方程式为
发生反应的化学方程式为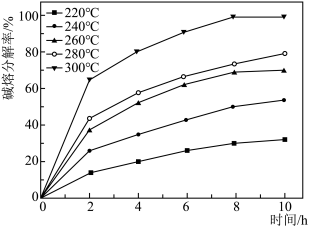
(3)“氨沉”时产物为
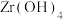 、
、 和
和 ,反应结束后溶液中
,反应结束后溶液中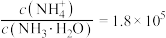 ,则
,则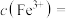
 ,“滤液2”中主要成分是
,“滤液2”中主要成分是(4)“煅烧”时
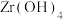 分解生成
分解生成 ,“沸腾氯化”时
,“沸腾氯化”时 发生反应的化学方程式为
发生反应的化学方程式为 ,目的是
,目的是
您最近半年使用:0次
名校
解题方法
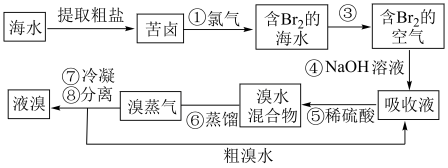
2 . 溴主要用于制造汽油抗爆剂、照相感光材料、药物、试剂和农药等。空气吹出法工艺利用制盐后的卤水提取溴。这种卤水含溴离子的浓度很低,在生产中用下列方法制取液溴。 、
、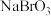
(1)第⑤步后的“溴水混合物”中溴的质量分数比“含 的海水”中溴的质量分数
的海水”中溴的质量分数___________ (填“高”、“低”)。
(2)步骤③的操作是:___________________ ;经过该操作获得含 的空气,利用了
的空气,利用了
_________________ 的性质。
步骤⑥的蒸馏过程中,溴出口温度要控制在 ,温度过高或过低都不利于生产,请解释原因:
,温度过高或过低都不利于生产,请解释原因:_______________________ 。
(3)步骤④和⑤的目的是:__________________ ;步骤④用浓的 溶液,发生反应的离子方程式为:
溶液,发生反应的离子方程式为:___________________ 。
(4)第⑧步分离的目的是除去溴中混有的少量氯气和水蒸气,要除去少量的氯气,加入的试剂是:___________ ,然后操作名称是:___________ 。
 、
、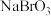
(1)第⑤步后的“溴水混合物”中溴的质量分数比“含
 的海水”中溴的质量分数
的海水”中溴的质量分数(2)步骤③的操作是:
 的空气,利用了
的空气,利用了
步骤⑥的蒸馏过程中,溴出口温度要控制在
 ,温度过高或过低都不利于生产,请解释原因:
,温度过高或过低都不利于生产,请解释原因:(3)步骤④和⑤的目的是:
 溶液,发生反应的离子方程式为:
溶液,发生反应的离子方程式为:(4)第⑧步分离的目的是除去溴中混有的少量氯气和水蒸气,要除去少量的氯气,加入的试剂是:
您最近半年使用:0次
解题方法
3 . 钛酸钡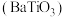 是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。用高钛渣(主要成分为
是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。用高钛渣(主要成分为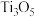 ,含
,含 、
、 等杂质)为原料制备
等杂质)为原料制备 的工业流程如下:
的工业流程如下:
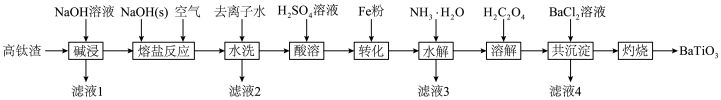
已知:① 在溶液中呈绿色;
在溶液中呈绿色; 是强电解质;
是强电解质;
②部分金属离子开始沉淀的 如下表:
如下表:
回答下列问题:
(1)“碱浸”操作过程中除去的杂质为_______ 。
(2)“水洗”过程中 与水发生离子交换反应:
与水发生离子交换反应: ,滤液2呈绿色,经除杂处理后可在
,滤液2呈绿色,经除杂处理后可在_______ (操作单元名称)循环利用,“熔盐反应”过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
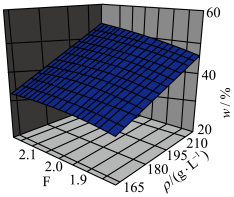
(3)“酸溶”过程中 (
( 溶液质量浓度)及F(
溶液质量浓度)及F( 溶液酸度)与w(
溶液酸度)与w( 质量分数)之间的关系如图所示。当
质量分数)之间的关系如图所示。当 值恒定时,随
值恒定时,随 溶液质量浓度增大,所需硫酸的质量分数
溶液质量浓度增大,所需硫酸的质量分数_______ (填“增大”“减小”或“不变”)。
(4)“水解”操作加入 目的是调节溶液
目的是调节溶液 ,可适当提高水解速率。已知:
,可适当提高水解速率。已知: ,水解反应
,水解反应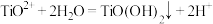 的平衡常数
的平衡常数
_______ ;“转化”过程加入铁粉的目的是_______ ,滤液3中含有的金属阳离子有_______ 。
(5)“共沉淀”过程发生反应: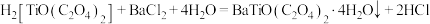 ,“灼烧”时隔绝空气,发生反应的化学方程式为
,“灼烧”时隔绝空气,发生反应的化学方程式为_______ 。
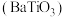 是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。用高钛渣(主要成分为
是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。用高钛渣(主要成分为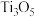 ,含
,含 、
、 等杂质)为原料制备
等杂质)为原料制备 的工业流程如下:
的工业流程如下:
已知:①
 在溶液中呈绿色;
在溶液中呈绿色; 是强电解质;
是强电解质;②部分金属离子开始沉淀的
 如下表:
如下表:| 金属离子 |  |  |  |
开始沉淀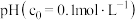 | 1.9 | 7.0 | 9.1 |
(1)“碱浸”操作过程中除去的杂质为
(2)“水洗”过程中
 与水发生离子交换反应:
与水发生离子交换反应: ,滤液2呈绿色,经除杂处理后可在
,滤液2呈绿色,经除杂处理后可在 发生反应的离子方程式为
发生反应的离子方程式为(3)“酸溶”过程中
 (
( 溶液质量浓度)及F(
溶液质量浓度)及F( 溶液酸度)与w(
溶液酸度)与w( 质量分数)之间的关系如图所示。当
质量分数)之间的关系如图所示。当 值恒定时,随
值恒定时,随 溶液质量浓度增大,所需硫酸的质量分数
溶液质量浓度增大,所需硫酸的质量分数
(4)“水解”操作加入
 目的是调节溶液
目的是调节溶液 ,可适当提高水解速率。已知:
,可适当提高水解速率。已知: ,水解反应
,水解反应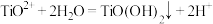 的平衡常数
的平衡常数
(5)“共沉淀”过程发生反应:
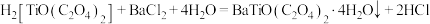 ,“灼烧”时隔绝空气,发生反应的化学方程式为
,“灼烧”时隔绝空气,发生反应的化学方程式为
您最近半年使用:0次
4 . 锇酸钾晶体(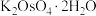 )微溶于冷水,常用作催化剂。由含锇约
)微溶于冷水,常用作催化剂。由含锇约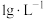 的锇吸收液(主要成分为
的锇吸收液(主要成分为 ,含少量
,含少量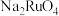 及
及 、
、 杂质)精制提纯锇酸钾的工业流程如下:
杂质)精制提纯锇酸钾的工业流程如下: )的熔点为41℃,沸点为130℃,易挥发。回答下列问题:
)的熔点为41℃,沸点为130℃,易挥发。回答下列问题:
(1)“沉锇”得到难溶物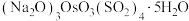 ,该化合物中锇元素的化合价为
,该化合物中锇元素的化合价为_______ 。
(2)检验滤液1和滤液2中金属阳离子的实验方法是_______ 。
(3)“溶解、蒸馏”步骤中,先加入50%硫酸得到 溶液,再加入
溶液,再加入 反应后蒸馏出
反应后蒸馏出 ,生成
,生成 的离子反应方程式为
的离子反应方程式为_______ 。
(4) 用
用 溶液吸收后又得到
溶液吸收后又得到 溶液,吸收液中仍然存在少量
溶液,吸收液中仍然存在少量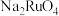 杂质,“吸收、分离”操作加入甲醇的目的是
杂质,“吸收、分离”操作加入甲醇的目的是___________________________________ 。
(5)“转化”时须加入过量 溶液,用平衡原理解释其原因
溶液,用平衡原理解释其原因____________________________ 。
(6)已知: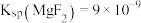 、
、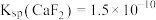 。
。
锇吸收液中 、
、 浓度分别为
浓度分别为 和
和 ,若取1.0L废液,则至少需加入
,若取1.0L废液,则至少需加入_______ g 才能使废液中
才能使废液中 、
、 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
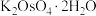 )微溶于冷水,常用作催化剂。由含锇约
)微溶于冷水,常用作催化剂。由含锇约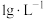 的锇吸收液(主要成分为
的锇吸收液(主要成分为 ,含少量
,含少量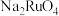 及
及 、
、 杂质)精制提纯锇酸钾的工业流程如下:
杂质)精制提纯锇酸钾的工业流程如下: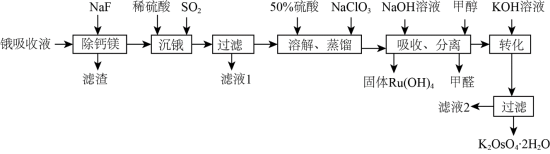
 )的熔点为41℃,沸点为130℃,易挥发。回答下列问题:
)的熔点为41℃,沸点为130℃,易挥发。回答下列问题:(1)“沉锇”得到难溶物
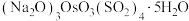 ,该化合物中锇元素的化合价为
,该化合物中锇元素的化合价为(2)检验滤液1和滤液2中金属阳离子的实验方法是
(3)“溶解、蒸馏”步骤中,先加入50%硫酸得到
 溶液,再加入
溶液,再加入 反应后蒸馏出
反应后蒸馏出 ,生成
,生成 的离子反应方程式为
的离子反应方程式为(4)
 用
用 溶液吸收后又得到
溶液吸收后又得到 溶液,吸收液中仍然存在少量
溶液,吸收液中仍然存在少量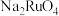 杂质,“吸收、分离”操作加入甲醇的目的是
杂质,“吸收、分离”操作加入甲醇的目的是(5)“转化”时须加入过量
 溶液,用平衡原理解释其原因
溶液,用平衡原理解释其原因(6)已知:
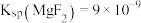 、
、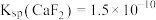 。
。锇吸收液中
 、
、 浓度分别为
浓度分别为 和
和 ,若取1.0L废液,则至少需加入
,若取1.0L废液,则至少需加入 才能使废液中
才能使废液中 、
、 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
您最近半年使用:0次
5 . 亚氯酸钠 是一种高效的漂白剂和氧化剂。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
是一种高效的漂白剂和氧化剂。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
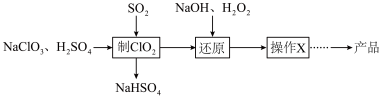
已知:“操作X”为蒸发浓缩、冷却结晶。下列说法正确的是
 是一种高效的漂白剂和氧化剂。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
是一种高效的漂白剂和氧化剂。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
已知:“操作X”为蒸发浓缩、冷却结晶。下列说法正确的是
A.“制 ”中氧化剂与还原剂物质的量之比为 ”中氧化剂与还原剂物质的量之比为 |
B.“还原”发生反应的离子方程式为 |
| C.“操作X”需要用到的仪器为坩埚、酒精灯、玻璃棒 |
D. 作氧化剂时,转移电子的物质的量约为同质量 作氧化剂时,转移电子的物质的量约为同质量 的1.57倍 的1.57倍 |
您最近半年使用:0次
解题方法
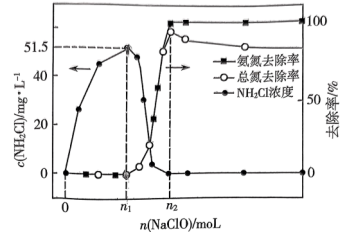
6 . 工业上可用次氯酸盐将氨氮废水转化为 实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的
实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的 混合(混合溶液体积为
混合(混合溶液体积为 ),测得溶液中氨氮(氨、
),测得溶液中氨氮(氨、 )和总氮(氨氮和
)和总氮(氨氮和 的总和)的去除率及
的总和)的去除率及 的浓度与
的浓度与 的加入量关系如图所示。
的加入量关系如图所示。
在此过程中发生的反应为:
①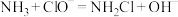
②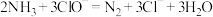
③
已知: 中氮元素为
中氮元素为 价。下列说法正确的是
价。下列说法正确的是
 实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的
实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的 混合(混合溶液体积为
混合(混合溶液体积为 ),测得溶液中氨氮(氨、
),测得溶液中氨氮(氨、 )和总氮(氨氮和
)和总氮(氨氮和 的总和)的去除率及
的总和)的去除率及 的浓度与
的浓度与 的加入量关系如图所示。
的加入量关系如图所示。
在此过程中发生的反应为:
①
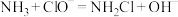
②
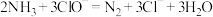
③

已知:
 中氮元素为
中氮元素为 价。下列说法正确的是
价。下列说法正确的是A.当 时,反应①中转移电子的物质的量为 时,反应①中转移电子的物质的量为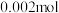 |
B.当 时, 时, |
C. |
D.当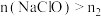 时, 时,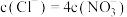 |
您最近半年使用:0次
解题方法
7 . 一种利用 和
和 进行新型脱氮的过程如下图所示。下列说法正确的是
进行新型脱氮的过程如下图所示。下列说法正确的是
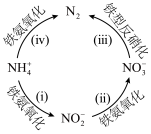
 和
和 进行新型脱氮的过程如下图所示。下列说法正确的是
进行新型脱氮的过程如下图所示。下列说法正确的是
A.铁氨氧化中, 转化为 转化为 |
B.将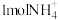 转化为 转化为 ,两个途径最终失去的电子数相同 ,两个途径最终失去的电子数相同 |
C.反应iii的离子方程式为 |
| D.四步反应中,氮元素均被氧化 |
您最近半年使用:0次
名校
8 . 工业上用赤铁矿(主要成分为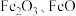 ,含
,含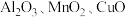 等杂质)制备绿矾
等杂质)制备绿矾 的流程如下:
的流程如下: 能与
能与 溶液反应生成可溶性盐
溶液反应生成可溶性盐 。
。
回答下列问题:
(1)试剂a为___________ 。
(2)试剂b需过量,其目的是___________ ;“滤渣”的成分是___________ 。
(3)“结晶”需隔绝空气,原因是___________ 。
(4)绿矾隔绝空气加强热可用于制备红色颜料铁红。取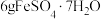 样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体
样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体 不含结晶水)。
不含结晶水)。 主要成分的化学式为
主要成分的化学式为___________ 。
②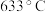 时,除生成铁红外,同时生成能使
时,除生成铁红外,同时生成能使 溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为
溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为___________ ;该样品中 的质量分数为
的质量分数为___________  (保留一位小数)。
(保留一位小数)。
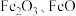 ,含
,含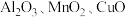 等杂质)制备绿矾
等杂质)制备绿矾 的流程如下:
的流程如下: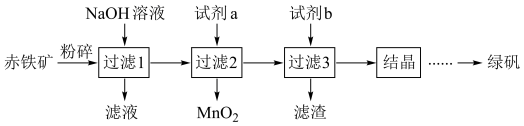
 能与
能与 溶液反应生成可溶性盐
溶液反应生成可溶性盐 。
。回答下列问题:
(1)试剂a为
(2)试剂b需过量,其目的是
(3)“结晶”需隔绝空气,原因是
(4)绿矾隔绝空气加强热可用于制备红色颜料铁红。取
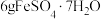 样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体
样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体 不含结晶水)。
不含结晶水)。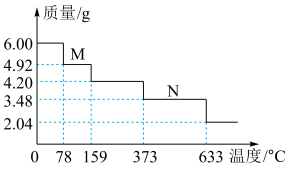
 主要成分的化学式为
主要成分的化学式为②
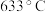 时,除生成铁红外,同时生成能使
时,除生成铁红外,同时生成能使 溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为
溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为 的质量分数为
的质量分数为 (保留一位小数)。
(保留一位小数)。
您最近半年使用:0次
2024-02-02更新
|
237次组卷
|
3卷引用:山东省潍坊市2023-2024学年高一上学期期末考试化学试题
名校
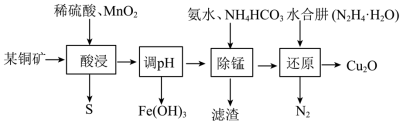
9 . 氧化亚铜主要用于制造船底防污漆(用来杀死低级海生动物)、杀虫剂,以及各种铜盐、分析试剂、红色玻璃,还用于镀铜及镀铜合金溶液的配制。用某铜矿(主要含CuS、FeO)制备Cu2O的一种工艺流程如下图:
已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表:
请回答下列问题:
(1)基态Cu原子价层电子的排布图为_______ 。
(2)滤渣的主要成分是_______ (填化学式)。
(3)“酸浸”中加入MnO2的作用是_______ ;写出其中生成单质S的化学方程式_______ 。
(4)“调pH”的范围是_______ 。
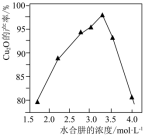
(5)“还原”前Cu元素以[Cu(NH3)4](OH)2的形式存在,水合肼被氧化的化学方程式为_______ ;一定体积下,保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。当水合肼浓度大于3.25mol·L-1时,[Cu(NH3)4]2+的转化率仍增大,但Cu2O的产率下降,其可能的原因是_______ 。

已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 4.8 | 1.9 | 7.5 | 8.8 |
| 沉淀完全的pH | 6.4 | 3.2 | 9.7 | 10.4 |
(1)基态Cu原子价层电子的排布图为
(2)滤渣的主要成分是
(3)“酸浸”中加入MnO2的作用是
(4)“调pH”的范围是
(5)“还原”前Cu元素以[Cu(NH3)4](OH)2的形式存在,水合肼被氧化的化学方程式为

您最近半年使用:0次
10 . 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质与NH4Cl类似。工业上主要采用电化学法制备,装置如图1所示,含Fe的催化电极反应机理如图2所示,不考虑溶液体积的变化。下列说法正确的是
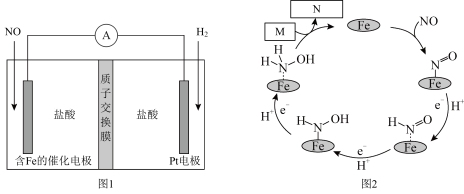

| A.电池工作时,Pt电极为正极 |
| B.图2中,M为H+,N为NH3OH+ |
| C.电池工作时,每消耗2.24LNO(标准状况)左室溶液质量增加3.3g |
| D.电池工作一段时间后,正极区溶液的pH减小 |
您最近半年使用:0次