1 . 亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,制备亚氯酸钠的流程如下:
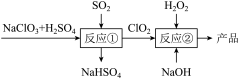
下列说法错误的是

下列说法错误的是
| A.流程中含氯产物均为还原产物 |
B.反应②离子反应为:2ClO2+H2O2+2OH-=2ClO +O2+2H2O +O2+2H2O |
| C.理论上,流程中SO2与H2O2的物质的量之比为1∶1 |
| D.反应①、反应②都应控制较高温度,加快反应速率 |
您最近半年使用:0次
名校
解题方法
2 . 对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
Ⅰ.现有以下物质:①H2O、②Al、③Fe3O4、④Fe(OH)3胶体、⑤FeBr2溶液、⑥干冰、⑦稀硫酸、⑧酒精、⑨Cl2。
(1)以上物质中属于混合物的是___________ (填序号,下同),既不属于电解质也不属于非电解质的是___________ 。
(2)向④中逐滴滴加⑦,可观察到的现象是___________ 。
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是___________ (填字母)。
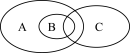
(4)写出物质③和⑦发生反应的离子方程式:___________ 。
(5)写出上述物质用于焊接钢轨的化学方程式:___________ 。
(6)向⑤中通入⑨,至Cl2与FeBr2物质的量相等时的离子方程式:___________ 。
Ⅰ.现有以下物质:①H2O、②Al、③Fe3O4、④Fe(OH)3胶体、⑤FeBr2溶液、⑥干冰、⑦稀硫酸、⑧酒精、⑨Cl2。
(1)以上物质中属于混合物的是
(2)向④中逐滴滴加⑦,可观察到的现象是
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(4)写出物质③和⑦发生反应的离子方程式:
(5)写出上述物质用于焊接钢轨的化学方程式:
(6)向⑤中通入⑨,至Cl2与FeBr2物质的量相等时的离子方程式:
您最近半年使用:0次
2023-08-10更新
|
138次组卷
|
2卷引用:山东省东营市河口区第一高级中学2023-2024学年高一上学期10月月考(贯通班)化学试题
解题方法
3 . 一定温度下,将Cl2缓缓通入一定浓度的KOH溶液中,至两者恰好完全反应,生成物中有三种含氯元素的微粒,其中ClO-和 两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
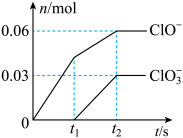
 两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
A.t1~t2,反应的离子方程式为Cl2+6OH−=5Cl−+ +3H2O +3H2O |
| B.生成的另外一种含氯元素的微粒是Cl−,t2时,溶液中Cl−的物质的量为0.09mol |
C.反应过程中一定存在c(ClO−)+ c( ) +c(Cl−)= c(K+) ) +c(Cl−)= c(K+) |
| D.两者恰好完全反应时,参与反应的Cl2的物质的量为0.15mol |
您最近半年使用:0次
解题方法
4 . 有色金属冶炼废水中的砷元素主要以亚砷酸(H3AsO3)和砷酸(H3AsO4)形式存在,酸性废水中砷元素回收再利用的工业流程如图所示。回答下列问题:
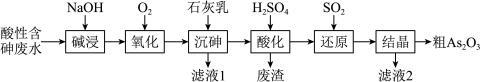
(1)写出As在元素周期表中的位置___________ ,砷虽然是非金属元素,但已表现出一些金属的性质,结合其在元素周期表的位置,说明原因___________ 。
(2)H3AsO4的酸性___________ H3PO4的酸性(填“强于”或“弱于”),依据是___________ 。
(3)“氧化”过程发生的离子方程式是___________ 。
(4)“沉砷”的反应为5Ca2++3AsO +OH-=Ca5(AsO4)3OH(s),最佳温度是85℃。温度高于85℃后,沉淀率下降的原因可能为
+OH-=Ca5(AsO4)3OH(s),最佳温度是85℃。温度高于85℃后,沉淀率下降的原因可能为___________ 。
A.升高温度,反应速率降低
B.85℃,该反应此时反应速率最快
C.升高温度,Ca2+和OH-浓度降低
(5)As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如右图所示,

结合图像分析,“结晶”的具体操作是加热亚砷酸,__________ 过滤得粗As2O3。

(1)写出As在元素周期表中的位置
(2)H3AsO4的酸性
(3)“氧化”过程发生的离子方程式是
(4)“沉砷”的反应为5Ca2++3AsO
 +OH-=Ca5(AsO4)3OH(s),最佳温度是85℃。温度高于85℃后,沉淀率下降的原因可能为
+OH-=Ca5(AsO4)3OH(s),最佳温度是85℃。温度高于85℃后,沉淀率下降的原因可能为A.升高温度,反应速率降低
B.85℃,该反应此时反应速率最快
C.升高温度,Ca2+和OH-浓度降低
(5)As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如右图所示,

结合图像分析,“结晶”的具体操作是加热亚砷酸,
您最近半年使用:0次
名校
解题方法
5 . 工业上从炼铜烟灰(主要成分为 、
、 、
、 、
、 及其硫酸盐)中回收金属元素,流程如下:
及其硫酸盐)中回收金属元素,流程如下:
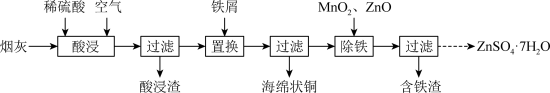
(1)酸浸过程中,金属元素均由氧化物转化为硫酸盐,其中生成 的化学方程式为:
的化学方程式为: 、
、_______ 。
(2)“置换”工序需保持铁屑过量,否则生产过程中铜的产率会随时间延长而下降,可能原因为_______ 。
(3)利用 溶液从“酸浸渣”中浸取铅元素。已知,25℃时,
溶液从“酸浸渣”中浸取铅元素。已知,25℃时,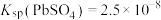 ;
;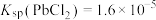 ;
; 、
、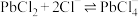 ,一定条件下,在不同浓度的
,一定条件下,在不同浓度的 溶液中,温度对铅浸出率的影响、
溶液中,温度对铅浸出率的影响、 的溶解度曲线分别如图1、图2所示。
的溶解度曲线分别如图1、图2所示。
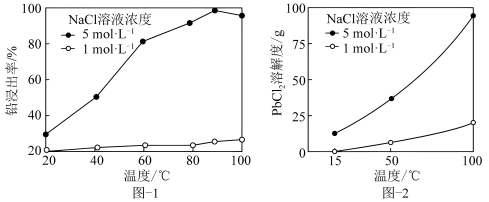
①提取铅元素,采取的最佳条件为_______ 。
②从“酸浸渣”中获取 的操作为:控制最佳条件,浸泡酸浸渣,一段时间后,热滤,
的操作为:控制最佳条件,浸泡酸浸渣,一段时间后,热滤,_______ ,过滤、冷水洗涤、干燥,得 晶体。
晶体。
③为提高原料 溶液利用率,可向上述滤液中继续加入适量
溶液利用率,可向上述滤液中继续加入适量 固体,循环浸取酸浸渣。向循环一定次数后的溶液中加入适量
固体,循环浸取酸浸渣。向循环一定次数后的溶液中加入适量 溶液,目的是
溶液,目的是_______ 。循环液经 溶液处理后,后续加水,使其中
溶液处理后,后续加水,使其中 浓度稀释至
浓度稀释至 的目的是
的目的是_______ 。
(4)“除铁”中, 的主要作用为
的主要作用为_______ ;使用 的目的为
的目的为_______ 。
(5) 的纯度可用配位滴定法测定。准确称取一定量的
的纯度可用配位滴定法测定。准确称取一定量的 晶体,加入
晶体,加入 的锥形瓶中,依次加入
的锥形瓶中,依次加入 水、2~3滴二甲酚橙、约
水、2~3滴二甲酚橙、约 六亚甲基四胺。用已标定的
六亚甲基四胺。用已标定的 EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(
EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点( 与EDTA按物质的量之比
与EDTA按物质的量之比 反应)。实验数据如表:
反应)。实验数据如表:
 产品的纯度为
产品的纯度为_______ (保留2位有效数字)。
 、
、 、
、 、
、 及其硫酸盐)中回收金属元素,流程如下:
及其硫酸盐)中回收金属元素,流程如下:
(1)酸浸过程中,金属元素均由氧化物转化为硫酸盐,其中生成
 的化学方程式为:
的化学方程式为: 、
、(2)“置换”工序需保持铁屑过量,否则生产过程中铜的产率会随时间延长而下降,可能原因为
(3)利用
 溶液从“酸浸渣”中浸取铅元素。已知,25℃时,
溶液从“酸浸渣”中浸取铅元素。已知,25℃时,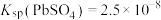 ;
;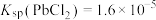 ;
; 、
、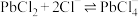 ,一定条件下,在不同浓度的
,一定条件下,在不同浓度的 溶液中,温度对铅浸出率的影响、
溶液中,温度对铅浸出率的影响、 的溶解度曲线分别如图1、图2所示。
的溶解度曲线分别如图1、图2所示。
①提取铅元素,采取的最佳条件为
②从“酸浸渣”中获取
 的操作为:控制最佳条件,浸泡酸浸渣,一段时间后,热滤,
的操作为:控制最佳条件,浸泡酸浸渣,一段时间后,热滤, 晶体。
晶体。③为提高原料
 溶液利用率,可向上述滤液中继续加入适量
溶液利用率,可向上述滤液中继续加入适量 固体,循环浸取酸浸渣。向循环一定次数后的溶液中加入适量
固体,循环浸取酸浸渣。向循环一定次数后的溶液中加入适量 溶液,目的是
溶液,目的是 溶液处理后,后续加水,使其中
溶液处理后,后续加水,使其中 浓度稀释至
浓度稀释至 的目的是
的目的是(4)“除铁”中,
 的主要作用为
的主要作用为 的目的为
的目的为(5)
 的纯度可用配位滴定法测定。准确称取一定量的
的纯度可用配位滴定法测定。准确称取一定量的 晶体,加入
晶体,加入 的锥形瓶中,依次加入
的锥形瓶中,依次加入 水、2~3滴二甲酚橙、约
水、2~3滴二甲酚橙、约 六亚甲基四胺。用已标定的
六亚甲基四胺。用已标定的 EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(
EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点( 与EDTA按物质的量之比
与EDTA按物质的量之比 反应)。实验数据如表:
反应)。实验数据如表: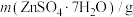 | 起始滴定管读数 | 终点滴定管读数 |
| 0.1692 | 0.20 | 26.50 |
 产品的纯度为
产品的纯度为
您最近半年使用:0次
6 . 工业上用黄铜矿(主要成分是 ,还含有少量
,还含有少量 )制备
)制备 的工艺流程如图1:
的工艺流程如图1:
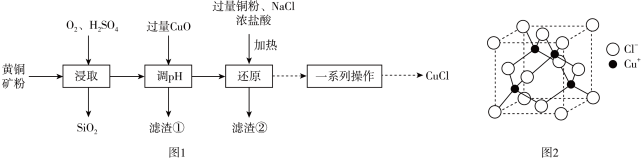
下列说法正确的是
 ,还含有少量
,还含有少量 )制备
)制备 的工艺流程如图1:
的工艺流程如图1:
下列说法正确的是
A.“浸取”时离子方程式为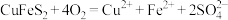 |
B.“滤渣①”成分是 、 、 |
C.“还原”时加入 和浓盐酸主要是为了提供 和浓盐酸主要是为了提供 ,跟铜元素形成可溶于水的物质 ,跟铜元素形成可溶于水的物质 |
D. 的晶胞如图2,每个氯离子周围与之距离最近的氯离子数目是4 的晶胞如图2,每个氯离子周围与之距离最近的氯离子数目是4 |
您最近半年使用:0次
名校
解题方法
7 . 某化学兴趣小组利用下图装置(部分夹持装置省略)制备氯气并探究其性质:
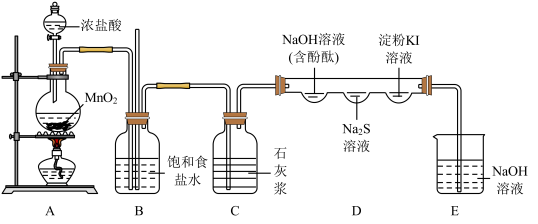
回答以下问题:
(1)装置A中发生反应的离子方程式为_______ ,0.4 mol HCl发生反应时,转移电子的物质的量为_______ 。
(2)利用装置C模拟工业制备漂白粉,写出该反应的化学方程式_______ 。若C中导管口堵塞,则B中观察到的现象是_______ 。
(3)实验进行一段时间后,装置D中含酚酞的NaOH溶液红色逐渐褪去,产生该现象的原因可能为:①氯气溶于水呈酸性,与氢氧化钠发生中和反应使溶液褪色;②_______ 。
(4)随着反应进行,装置D中 溶液处观察到的现象为
溶液处观察到的现象为_______ ;淀粉KI溶液处先变蓝后褪色,原因是氯气氧化碘单质生成 ,写出褪色过程的化学方程式
,写出褪色过程的化学方程式_______ 。
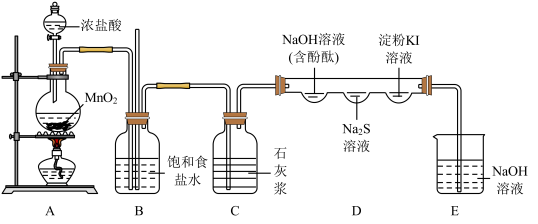
回答以下问题:
(1)装置A中发生反应的离子方程式为
(2)利用装置C模拟工业制备漂白粉,写出该反应的化学方程式
(3)实验进行一段时间后,装置D中含酚酞的NaOH溶液红色逐渐褪去,产生该现象的原因可能为:①氯气溶于水呈酸性,与氢氧化钠发生中和反应使溶液褪色;②
(4)随着反应进行,装置D中
 溶液处观察到的现象为
溶液处观察到的现象为 ,写出褪色过程的化学方程式
,写出褪色过程的化学方程式
您最近半年使用:0次
2023-02-10更新
|
355次组卷
|
2卷引用:山东省东营市河口区第一高级中学2023-2024学年高一上学期10月月考(贯通班)化学试题
名校
解题方法
8 . 下列反应的离子方程式书写正确的是
A. 溶液中加入过量醋酸溶液: 溶液中加入过量醋酸溶液: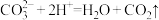 |
B. 溶液中通入过量 溶液中通入过量 : :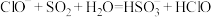 |
C. 溶液中加入 溶液中加入 溶液: 溶液: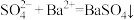 |
D.酸性高锰酸钾溶液中滴加KI溶液: |
您最近半年使用:0次
2023-02-10更新
|
972次组卷
|
2卷引用:山东省东营市河口区第一高级中学2023-2024学年高一上学期10月月考(贯通班)化学试题
解题方法
9 . 叠氨化钠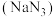 是制备医药、炸药的一种重要原料,
是制备医药、炸药的一种重要原料, 不溶于乙醚,微溶于乙醇,溶于水并能水解。工业上采用“亚硝酸甲酯
不溶于乙醚,微溶于乙醇,溶于水并能水解。工业上采用“亚硝酸甲酯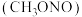 ——水合肼
——水合肼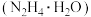 法”制备叠氮化钠的生产流程如下:
法”制备叠氮化钠的生产流程如下:
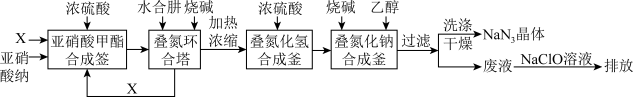
回答下列问题:
(1)叠氮环合塔中生成叠氮化钠的化学方程式为_______ 。
(2)叠氮环合塔中加入的烧碱溶液要适当过量,目的是_______ 。
(3)向“叠氮化钠合成釜”中加入乙醇的目的是_______ ,洗涤操作时选用的洗涤试剂最好的是_______ 。
(4)该生产过程中可循环使用的物质X的结构简式为_______ 。
(5)调节废液的 约为5,加入适量
约为5,加入适量 溶液。
溶液。
① 将废液中的叠氮化钠转化为
将废液中的叠氮化钠转化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
②研究发现,废液中叠氮化钠去除率随温度升高呈先升后降趋势。当温度大于 时,废水中叠氮化钠去除率随着温度升高而降低,其原因是
时,废水中叠氮化钠去除率随着温度升高而降低,其原因是_______ 。
(6)测定产品 晶体纯度的实验操作如下:取
晶体纯度的实验操作如下:取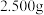 晶体配成
晶体配成 溶液,取
溶液,取 溶液置于锥形瓶中,加入
溶液置于锥形瓶中,加入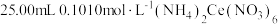 溶液,充分反应后,将溶液稀释,向溶液中加入4mL浓硫酸,滴入3滴指示剂,用
溶液,充分反应后,将溶液稀释,向溶液中加入4mL浓硫酸,滴入3滴指示剂,用 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗溶液体积为
,消耗溶液体积为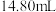 。有关反应为:
。有关反应为: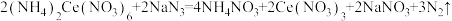 ;
;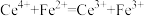 。试样中
。试样中 的质量分数为
的质量分数为_______ (计算结果保留1位小数)。
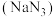 是制备医药、炸药的一种重要原料,
是制备医药、炸药的一种重要原料, 不溶于乙醚,微溶于乙醇,溶于水并能水解。工业上采用“亚硝酸甲酯
不溶于乙醚,微溶于乙醇,溶于水并能水解。工业上采用“亚硝酸甲酯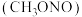 ——水合肼
——水合肼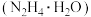 法”制备叠氮化钠的生产流程如下:
法”制备叠氮化钠的生产流程如下:
回答下列问题:
(1)叠氮环合塔中生成叠氮化钠的化学方程式为
(2)叠氮环合塔中加入的烧碱溶液要适当过量,目的是
(3)向“叠氮化钠合成釜”中加入乙醇的目的是
(4)该生产过程中可循环使用的物质X的结构简式为
(5)调节废液的
 约为5,加入适量
约为5,加入适量 溶液。
溶液。①
 将废液中的叠氮化钠转化为
将废液中的叠氮化钠转化为 ,该反应的离子方程式为
,该反应的离子方程式为②研究发现,废液中叠氮化钠去除率随温度升高呈先升后降趋势。当温度大于
 时,废水中叠氮化钠去除率随着温度升高而降低,其原因是
时,废水中叠氮化钠去除率随着温度升高而降低,其原因是(6)测定产品
 晶体纯度的实验操作如下:取
晶体纯度的实验操作如下:取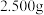 晶体配成
晶体配成 溶液,取
溶液,取 溶液置于锥形瓶中,加入
溶液置于锥形瓶中,加入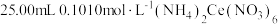 溶液,充分反应后,将溶液稀释,向溶液中加入4mL浓硫酸,滴入3滴指示剂,用
溶液,充分反应后,将溶液稀释,向溶液中加入4mL浓硫酸,滴入3滴指示剂,用 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗溶液体积为
,消耗溶液体积为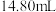 。有关反应为:
。有关反应为: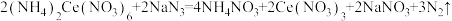 ;
;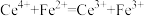 。试样中
。试样中 的质量分数为
的质量分数为
您最近半年使用:0次
2022-07-08更新
|
276次组卷
|
2卷引用:山东省东营市2021-2022学年高二下学期期末考试化学试题
10 . 钒元素在酸性溶液中有多种存在形式,其中 为蓝色,
为蓝色, 为淡黄色,
为淡黄色, 具有较强的氧化性,
具有较强的氧化性, 、
、 等能把
等能把 还原为
还原为 。向
。向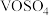 溶液中滴加酸性
溶液中滴加酸性 溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是
溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是
 为蓝色,
为蓝色, 为淡黄色,
为淡黄色, 具有较强的氧化性,
具有较强的氧化性, 、
、 等能把
等能把 还原为
还原为 。向
。向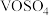 溶液中滴加酸性
溶液中滴加酸性 溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是
溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是A.在酸性溶液中氧化性: |
B.向酸性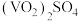 溶液中加入 溶液中加入 溶液,溶液由淡黄色变为蓝色 溶液,溶液由淡黄色变为蓝色 |
C.向含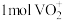 的酸性溶液中滴加含 的酸性溶液中滴加含 的溶液充分反应,转移电子为 的溶液充分反应,转移电子为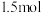 |
D.向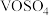 溶液中滴加酸性 溶液中滴加酸性 溶液反应的化学方程式为: 溶液反应的化学方程式为: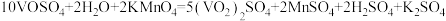 |
您最近半年使用:0次
2022-07-08更新
|
252次组卷
|
2卷引用:山东省东营市2021-2022学年高二下学期期末考试化学试题



