1 . 亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,制备亚氯酸钠的流程如下:
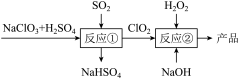
下列说法错误的是

下列说法错误的是
| A.流程中含氯产物均为还原产物 |
B.反应②离子反应为:2ClO2+H2O2+2OH-=2ClO +O2+2H2O +O2+2H2O |
| C.理论上,流程中SO2与H2O2的物质的量之比为1∶1 |
| D.反应①、反应②都应控制较高温度,加快反应速率 |
您最近一年使用:0次
解题方法
2 . 一定温度下,将Cl2缓缓通入一定浓度的KOH溶液中,至两者恰好完全反应,生成物中有三种含氯元素的微粒,其中ClO-和 两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
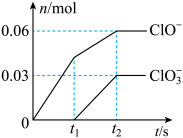
 两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
A.t1~t2,反应的离子方程式为Cl2+6OH−=5Cl−+ +3H2O +3H2O |
| B.生成的另外一种含氯元素的微粒是Cl−,t2时,溶液中Cl−的物质的量为0.09mol |
C.反应过程中一定存在c(ClO−)+ c( ) +c(Cl−)= c(K+) ) +c(Cl−)= c(K+) |
| D.两者恰好完全反应时,参与反应的Cl2的物质的量为0.15mol |
您最近一年使用:0次
名校
解题方法
3 . 工业上从炼铜烟灰(主要成分为 、
、 、
、 、
、 及其硫酸盐)中回收金属元素,流程如下:
及其硫酸盐)中回收金属元素,流程如下:
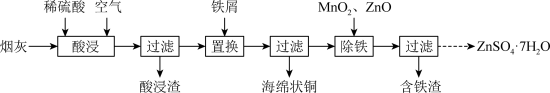
(1)酸浸过程中,金属元素均由氧化物转化为硫酸盐,其中生成 的化学方程式为:
的化学方程式为: 、
、_______ 。
(2)“置换”工序需保持铁屑过量,否则生产过程中铜的产率会随时间延长而下降,可能原因为_______ 。
(3)利用 溶液从“酸浸渣”中浸取铅元素。已知,25℃时,
溶液从“酸浸渣”中浸取铅元素。已知,25℃时,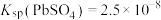 ;
;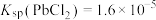 ;
; 、
、 ,一定条件下,在不同浓度的
,一定条件下,在不同浓度的 溶液中,温度对铅浸出率的影响、
溶液中,温度对铅浸出率的影响、 的溶解度曲线分别如图1、图2所示。
的溶解度曲线分别如图1、图2所示。
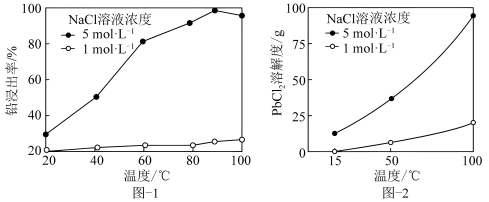
①提取铅元素,采取的最佳条件为_______ 。
②从“酸浸渣”中获取 的操作为:控制最佳条件,浸泡酸浸渣,一段时间后,热滤,
的操作为:控制最佳条件,浸泡酸浸渣,一段时间后,热滤,_______ ,过滤、冷水洗涤、干燥,得 晶体。
晶体。
③为提高原料 溶液利用率,可向上述滤液中继续加入适量
溶液利用率,可向上述滤液中继续加入适量 固体,循环浸取酸浸渣。向循环一定次数后的溶液中加入适量
固体,循环浸取酸浸渣。向循环一定次数后的溶液中加入适量 溶液,目的是
溶液,目的是_______ 。循环液经 溶液处理后,后续加水,使其中
溶液处理后,后续加水,使其中 浓度稀释至
浓度稀释至 的目的是
的目的是_______ 。
(4)“除铁”中, 的主要作用为
的主要作用为_______ ;使用 的目的为
的目的为_______ 。
(5) 的纯度可用配位滴定法测定。准确称取一定量的
的纯度可用配位滴定法测定。准确称取一定量的 晶体,加入
晶体,加入 的锥形瓶中,依次加入
的锥形瓶中,依次加入 水、2~3滴二甲酚橙、约
水、2~3滴二甲酚橙、约 六亚甲基四胺。用已标定的
六亚甲基四胺。用已标定的 EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(
EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点( 与EDTA按物质的量之比
与EDTA按物质的量之比 反应)。实验数据如表:
反应)。实验数据如表:
 产品的纯度为
产品的纯度为_______ (保留2位有效数字)。
 、
、 、
、 、
、 及其硫酸盐)中回收金属元素,流程如下:
及其硫酸盐)中回收金属元素,流程如下:
(1)酸浸过程中,金属元素均由氧化物转化为硫酸盐,其中生成
 的化学方程式为:
的化学方程式为: 、
、(2)“置换”工序需保持铁屑过量,否则生产过程中铜的产率会随时间延长而下降,可能原因为
(3)利用
 溶液从“酸浸渣”中浸取铅元素。已知,25℃时,
溶液从“酸浸渣”中浸取铅元素。已知,25℃时,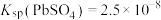 ;
;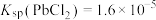 ;
; 、
、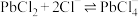 ,一定条件下,在不同浓度的
,一定条件下,在不同浓度的 溶液中,温度对铅浸出率的影响、
溶液中,温度对铅浸出率的影响、 的溶解度曲线分别如图1、图2所示。
的溶解度曲线分别如图1、图2所示。
①提取铅元素,采取的最佳条件为
②从“酸浸渣”中获取
 的操作为:控制最佳条件,浸泡酸浸渣,一段时间后,热滤,
的操作为:控制最佳条件,浸泡酸浸渣,一段时间后,热滤, 晶体。
晶体。③为提高原料
 溶液利用率,可向上述滤液中继续加入适量
溶液利用率,可向上述滤液中继续加入适量 固体,循环浸取酸浸渣。向循环一定次数后的溶液中加入适量
固体,循环浸取酸浸渣。向循环一定次数后的溶液中加入适量 溶液,目的是
溶液,目的是 溶液处理后,后续加水,使其中
溶液处理后,后续加水,使其中 浓度稀释至
浓度稀释至 的目的是
的目的是(4)“除铁”中,
 的主要作用为
的主要作用为 的目的为
的目的为(5)
 的纯度可用配位滴定法测定。准确称取一定量的
的纯度可用配位滴定法测定。准确称取一定量的 晶体,加入
晶体,加入 的锥形瓶中,依次加入
的锥形瓶中,依次加入 水、2~3滴二甲酚橙、约
水、2~3滴二甲酚橙、约 六亚甲基四胺。用已标定的
六亚甲基四胺。用已标定的 EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(
EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点( 与EDTA按物质的量之比
与EDTA按物质的量之比 反应)。实验数据如表:
反应)。实验数据如表: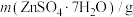 | 起始滴定管读数 | 终点滴定管读数 |
| 0.1692 | 0.20 | 26.50 |
 产品的纯度为
产品的纯度为
您最近一年使用:0次
4 . 工业上用黄铜矿(主要成分是 ,还含有少量
,还含有少量 )制备
)制备 的工艺流程如图1:
的工艺流程如图1:
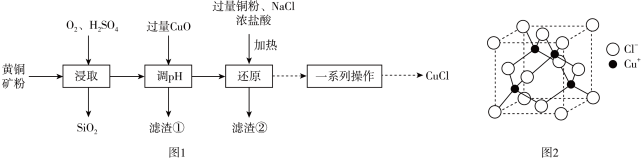
下列说法正确的是
 ,还含有少量
,还含有少量 )制备
)制备 的工艺流程如图1:
的工艺流程如图1:
下列说法正确的是
A.“浸取”时离子方程式为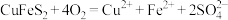 |
B.“滤渣①”成分是 、 、 |
C.“还原”时加入 和浓盐酸主要是为了提供 和浓盐酸主要是为了提供 ,跟铜元素形成可溶于水的物质 ,跟铜元素形成可溶于水的物质 |
D. 的晶胞如图2,每个氯离子周围与之距离最近的氯离子数目是4 的晶胞如图2,每个氯离子周围与之距离最近的氯离子数目是4 |
您最近一年使用:0次
名校
解题方法
5 . 某化学兴趣小组利用下图装置(部分夹持装置省略)制备氯气并探究其性质:
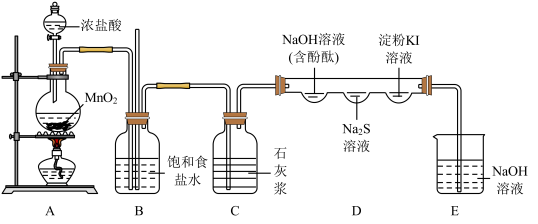
回答以下问题:
(1)装置A中发生反应的离子方程式为_______ ,0.4 mol HCl发生反应时,转移电子的物质的量为_______ 。
(2)利用装置C模拟工业制备漂白粉,写出该反应的化学方程式_______ 。若C中导管口堵塞,则B中观察到的现象是_______ 。
(3)实验进行一段时间后,装置D中含酚酞的NaOH溶液红色逐渐褪去,产生该现象的原因可能为:①氯气溶于水呈酸性,与氢氧化钠发生中和反应使溶液褪色;②_______ 。
(4)随着反应进行,装置D中 溶液处观察到的现象为
溶液处观察到的现象为_______ ;淀粉KI溶液处先变蓝后褪色,原因是氯气氧化碘单质生成 ,写出褪色过程的化学方程式
,写出褪色过程的化学方程式_______ 。
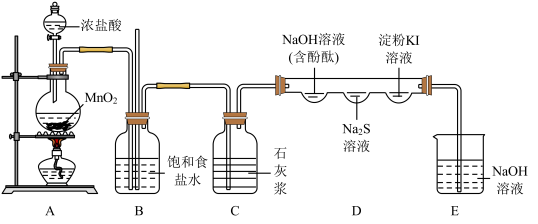
回答以下问题:
(1)装置A中发生反应的离子方程式为
(2)利用装置C模拟工业制备漂白粉,写出该反应的化学方程式
(3)实验进行一段时间后,装置D中含酚酞的NaOH溶液红色逐渐褪去,产生该现象的原因可能为:①氯气溶于水呈酸性,与氢氧化钠发生中和反应使溶液褪色;②
(4)随着反应进行,装置D中
 溶液处观察到的现象为
溶液处观察到的现象为 ,写出褪色过程的化学方程式
,写出褪色过程的化学方程式
您最近一年使用:0次
2023-02-10更新
|
358次组卷
|
2卷引用:山东省东营市河口区第一高级中学2023-2024学年高一上学期10月月考(贯通班)化学试题
6 . 钒元素在酸性溶液中有多种存在形式,其中 为蓝色,
为蓝色, 为淡黄色,
为淡黄色, 具有较强的氧化性,
具有较强的氧化性, 、
、 等能把
等能把 还原为
还原为 。向
。向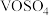 溶液中滴加酸性
溶液中滴加酸性 溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是
溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是
 为蓝色,
为蓝色, 为淡黄色,
为淡黄色, 具有较强的氧化性,
具有较强的氧化性, 、
、 等能把
等能把 还原为
还原为 。向
。向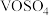 溶液中滴加酸性
溶液中滴加酸性 溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是
溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是A.在酸性溶液中氧化性: |
B.向酸性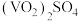 溶液中加入 溶液中加入 溶液,溶液由淡黄色变为蓝色 溶液,溶液由淡黄色变为蓝色 |
C.向含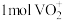 的酸性溶液中滴加含 的酸性溶液中滴加含 的溶液充分反应,转移电子为 的溶液充分反应,转移电子为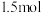 |
D.向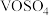 溶液中滴加酸性 溶液中滴加酸性 溶液反应的化学方程式为: 溶液反应的化学方程式为: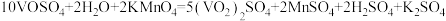 |
您最近一年使用:0次
2022-07-08更新
|
260次组卷
|
2卷引用:山东省东营市2021-2022学年高二下学期期末考试化学试题
名校
7 . 测定溶液中甘油浓度通常采用采用高碘酸氧化还原法,实验步骤如下:
i.配制准确浓度的硫代硫酸钠( )溶液
)溶液
①称取16克 ,溶于1000毫升水中,冷却,备用。
,溶于1000毫升水中,冷却,备用。
②称取0.147克基准重铬酸钾( ),置于碘量瓶中,溶于25毫升水,加2克碘化钾及20毫升
),置于碘量瓶中,溶于25毫升水,加2克碘化钾及20毫升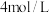 的硫酸,摇匀。于暗处放置10分钟。加75毫升水,用硫代硫酸钠溶液滴定(
的硫酸,摇匀。于暗处放置10分钟。加75毫升水,用硫代硫酸钠溶液滴定(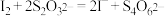 ),近终点时加1毫升0.5%指示剂,继续滴定至溶液由蓝色变为亮绿色。再重复滴定2次,平均用硫代硫酸钠溶液
),近终点时加1毫升0.5%指示剂,继续滴定至溶液由蓝色变为亮绿色。再重复滴定2次,平均用硫代硫酸钠溶液 。
。
ii.甘油含量测定
①准确量取 甘油溶液,放入
甘油溶液,放入 碘量瓶中,再加入
碘量瓶中,再加入 溶液、
溶液、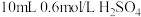 溶液、
溶液、 正己烷,盖好塞盖,摇匀,在室温下于暗处放置
正己烷,盖好塞盖,摇匀,在室温下于暗处放置 。
。
②加入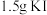 反应
反应 后,再加水
后,再加水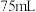 ,剩余的
,剩余的 和反应生成的
和反应生成的 被还原析出碘,析出的碘用配制好的
被还原析出碘,析出的碘用配制好的 标液滴定,滴定至颜色变亮时加入
标液滴定,滴定至颜色变亮时加入 指示剂,此时溶液呈现不透明深蓝色,继续滴至蓝色恰好消失为止。
指示剂,此时溶液呈现不透明深蓝色,继续滴至蓝色恰好消失为止。
③再重复滴定2次,平均用 溶液
溶液 。
。
回答下列问题:
(1)步骤i①的实验操作是否正确_______ (填“正确”或“错误”)。
(2)步骤i②的目的是_______ ,所用的指示剂是_______ , 溶液浓度是
溶液浓度是_______  。
。
(3)甘油( )溶液与
)溶液与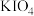 溶液反应生成甲醛、甲酸、
溶液反应生成甲醛、甲酸、 ,写出步骤ii①反应的离子方程式
,写出步骤ii①反应的离子方程式_______ 。步骤ii②中高碘酸与 反应的离子方程式为
反应的离子方程式为_______ 。
(4)步骤ii中下列因素引起测定结果偏高的是_______ 。
a.将碘量瓶换成普通锥形瓶
b.加入的 过量
过量
c.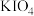 溶液浓度偏小
溶液浓度偏小
d.指示剂一褪色就停止滴定、读数
e.滴定前正视读数,滴定后仰视读数
i.配制准确浓度的硫代硫酸钠(
 )溶液
)溶液①称取16克
 ,溶于1000毫升水中,冷却,备用。
,溶于1000毫升水中,冷却,备用。②称取0.147克基准重铬酸钾(
 ),置于碘量瓶中,溶于25毫升水,加2克碘化钾及20毫升
),置于碘量瓶中,溶于25毫升水,加2克碘化钾及20毫升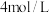 的硫酸,摇匀。于暗处放置10分钟。加75毫升水,用硫代硫酸钠溶液滴定(
的硫酸,摇匀。于暗处放置10分钟。加75毫升水,用硫代硫酸钠溶液滴定(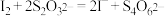 ),近终点时加1毫升0.5%指示剂,继续滴定至溶液由蓝色变为亮绿色。再重复滴定2次,平均用硫代硫酸钠溶液
),近终点时加1毫升0.5%指示剂,继续滴定至溶液由蓝色变为亮绿色。再重复滴定2次,平均用硫代硫酸钠溶液 。
。ii.甘油含量测定
①准确量取
 甘油溶液,放入
甘油溶液,放入 碘量瓶中,再加入
碘量瓶中,再加入 溶液、
溶液、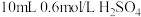 溶液、
溶液、 正己烷,盖好塞盖,摇匀,在室温下于暗处放置
正己烷,盖好塞盖,摇匀,在室温下于暗处放置 。
。②加入
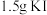 反应
反应 后,再加水
后,再加水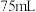 ,剩余的
,剩余的 和反应生成的
和反应生成的 被还原析出碘,析出的碘用配制好的
被还原析出碘,析出的碘用配制好的 标液滴定,滴定至颜色变亮时加入
标液滴定,滴定至颜色变亮时加入 指示剂,此时溶液呈现不透明深蓝色,继续滴至蓝色恰好消失为止。
指示剂,此时溶液呈现不透明深蓝色,继续滴至蓝色恰好消失为止。③再重复滴定2次,平均用
 溶液
溶液 。
。回答下列问题:
(1)步骤i①的实验操作是否正确
(2)步骤i②的目的是
 溶液浓度是
溶液浓度是 。
。(3)甘油(
 )溶液与
)溶液与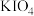 溶液反应生成甲醛、甲酸、
溶液反应生成甲醛、甲酸、 ,写出步骤ii①反应的离子方程式
,写出步骤ii①反应的离子方程式 反应的离子方程式为
反应的离子方程式为(4)步骤ii中下列因素引起测定结果偏高的是
a.将碘量瓶换成普通锥形瓶
b.加入的
 过量
过量c.
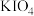 溶液浓度偏小
溶液浓度偏小d.指示剂一褪色就停止滴定、读数
e.滴定前正视读数,滴定后仰视读数
您最近一年使用:0次
名校
解题方法
8 . 从钨渣中提取钪过程中产出大量含有硫酸锰、硫酸亚铁和硫酸的废液。用菱锰矿(主要含MnO2及Fe2O3、CaO、Al2O3、SiO2,CuO等杂质)处理废液制备高纯MnSO4·H2O的实验如下:
①在2000 mL烧杯中加入提钪废液,加热升温,搅拌下按一定比例加入锰矿,反应80 min。
②搅拌下加入新制备的碳酸锰浆液调节pH在5.0~5.5,过滤。
③将滤液加热升温至90℃,搅拌下加入适量硫化锰浆液,继续煮沸60 min,静置过滤除去不溶物。在滤液中于室温下加入适量新制备的水合二氧化锰,吸附除硅继续搅拌 ,静置过滤除去不溶物。
,静置过滤除去不溶物。
④将除硅后的滤液加热煮沸,搅拌下滴加适量氟化锰饱和溶液,继续搅拌30 min,静置、过滤除去不溶物。
⑤将滤液在烧杯中加热,过程中用玻璃棒不断搅拌,至液体刚好完全蒸干时停止加热,冷却得高纯MnSO4·H2O。
回答下列问题:
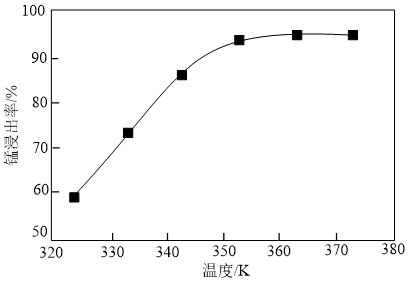
(1)步骤①中反应温度对锰浸出率的影响如图,反应温度应维持在_______ ℃,其中发生的氧化还原反应的离子方程式为_______ 。
(2)当溶液中可溶组分浓度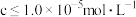 时,可认为已除尽。已知下列物质的
时,可认为已除尽。已知下列物质的
步骤②中滤渣主要成分是_______ ,步骤③不溶物主要成分是_______ 。
(3)步骤④反应的离子方程式为_______ 。
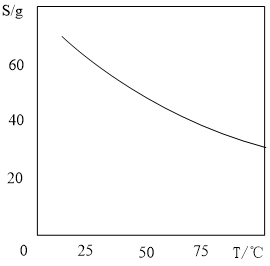
(4)已知MnSO4·H2O的溶解度随温度变化如图,实验中步骤①②③④是正确的,步骤⑤有错误,步骤⑤的正确操作为:_______ 。
①在2000 mL烧杯中加入提钪废液,加热升温,搅拌下按一定比例加入锰矿,反应80 min。
②搅拌下加入新制备的碳酸锰浆液调节pH在5.0~5.5,过滤。
③将滤液加热升温至90℃,搅拌下加入适量硫化锰浆液,继续煮沸60 min,静置过滤除去不溶物。在滤液中于室温下加入适量新制备的水合二氧化锰,吸附除硅继续搅拌
 ,静置过滤除去不溶物。
,静置过滤除去不溶物。④将除硅后的滤液加热煮沸,搅拌下滴加适量氟化锰饱和溶液,继续搅拌30 min,静置、过滤除去不溶物。
⑤将滤液在烧杯中加热,过程中用玻璃棒不断搅拌,至液体刚好完全蒸干时停止加热,冷却得高纯MnSO4·H2O。
回答下列问题:
(1)步骤①中反应温度对锰浸出率的影响如图,反应温度应维持在

(2)当溶液中可溶组分浓度
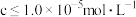 时,可认为已除尽。已知下列物质的
时,可认为已除尽。已知下列物质的
| 物质 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CaF2 |
| Ksp |  |  |  |  | 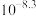 |
(3)步骤④反应的离子方程式为
(4)已知MnSO4·H2O的溶解度随温度变化如图,实验中步骤①②③④是正确的,步骤⑤有错误,步骤⑤的正确操作为:

您最近一年使用:0次
名校
解题方法
9 . 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于纸浆漂白、水处理等;工业上生产NaClO2有多种方法,某工业生产的流程如图所示:

请回答下列问题:
(1)电解槽中阳极上的电极反应式为___________ 。
(2)反应器Ⅰ中发生反应的化学方程式为___________ 。反应器Ⅱ中发生的反应中氧化剂与还原剂物质的量之比为___________ 。

请回答下列问题:
(1)电解槽中阳极上的电极反应式为
(2)反应器Ⅰ中发生反应的化学方程式为
您最近一年使用:0次
10 . 某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑥……
请根据上面叙述,回答:
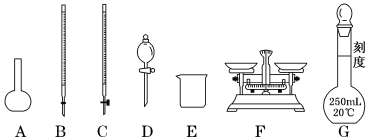
(1)上图所示仪器中,步骤①②③中必须用到的仪器有E和___________ (填字母)。
(2)步骤②中:配制50 mL 1.0 mol/L稀H2SO4,需要用量筒量取98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
____ Fe2++ ClO2+ === Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________ (填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________ 。
(4)若步骤⑤不在干燥器中冷却,则测定的铁元素的质量分数会________ (填“偏大”“偏小”或“不影响”)。
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑥……
请根据上面叙述,回答:

(1)上图所示仪器中,步骤①②③中必须用到的仪器有E和
(2)步骤②中:配制50 mL 1.0 mol/L稀H2SO4,需要用量筒量取98%(密度1.84 g/cm3)的浓H2SO4体积为
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是
(4)若步骤⑤不在干燥器中冷却,则测定的铁元素的质量分数会
您最近一年使用:0次



