1 . 向NaOH和Na2CO3混合溶液中滴加1mol/L的稀盐酸,CO2的生成量与加入盐酸的量的关系如图所示。下列判断正确的是


| A.在0~a范围内,只发生中和反应 |
B.ab段发生反应的离子方程式为CO +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| C.a=3 |
| D.原混合溶液中NaOH与Na2CO3的物质的量之比为2∶1 |
您最近一年使用:0次
2022-03-04更新
|
100次组卷
|
2卷引用:山东省肥城市第一高级中学等学校2023-2024学年高一上学期12月大联考化学试题
名校
2 . 高锰酸钾生产过程中产生的废锰渣(主要成分为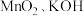 和
和 )可用于制备
)可用于制备 晶体,工艺流程如下:
晶体,工艺流程如下:

已知:①硫铁矿的主要成分为 (杂质不参与反应);
(杂质不参与反应);
② 为肉色。
为肉色。
回答下列问题:
(1)过滤时用到的主要玻璃仪器有___________ 。
(2)为了提高“反应I”的速率,可采取的措施有___________ (写两种即可)。
(3)“反应II”的离子方程式为____ ,“滤渣B”的主要成分为过量的 和
和____ (填化学式)。
(4)“反应III”中氧化剂和还原剂物质的量之比为___________ 。
(5)检验“滤液1”中是否含有 的方法是
的方法是___________ 。
(6)取mg 固体样品,溶于适量水中,加硫酸酸化,用过量
固体样品,溶于适量水中,加硫酸酸化,用过量 (难溶于水)将其完全氧化为
(难溶于水)将其完全氧化为 ,过滤,洗涤液并加入滤液后,加入
,过滤,洗涤液并加入滤液后,加入 固体,充分反应后,用
固体,充分反应后,用 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 溶液,用去
溶液,用去 。
。
①达到滴定终点的现象是___________ 。
②样品中 的质量分数为
的质量分数为___________ (用含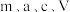 的代数式表示)。
的代数式表示)。
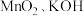 和
和 )可用于制备
)可用于制备 晶体,工艺流程如下:
晶体,工艺流程如下:
已知:①硫铁矿的主要成分为
 (杂质不参与反应);
(杂质不参与反应);②
 为肉色。
为肉色。回答下列问题:
(1)过滤时用到的主要玻璃仪器有
(2)为了提高“反应I”的速率,可采取的措施有
(3)“反应II”的离子方程式为
 和
和(4)“反应III”中氧化剂和还原剂物质的量之比为
(5)检验“滤液1”中是否含有
 的方法是
的方法是(6)取mg
 固体样品,溶于适量水中,加硫酸酸化,用过量
固体样品,溶于适量水中,加硫酸酸化,用过量 (难溶于水)将其完全氧化为
(难溶于水)将其完全氧化为 ,过滤,洗涤液并加入滤液后,加入
,过滤,洗涤液并加入滤液后,加入 固体,充分反应后,用
固体,充分反应后,用 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 溶液,用去
溶液,用去 。
。①达到滴定终点的现象是
②样品中
 的质量分数为
的质量分数为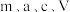 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2022-01-27更新
|
205次组卷
|
3卷引用:山东省泰安市宁阳四中2023-2024学年高二上学期期末化学模拟试卷
名校
3 . 新型冠状病毒肺炎爆发以来,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液;② (在水中一部分可以电离出阴、阳离子);③
(在水中一部分可以电离出阴、阳离子);③ ;④
;④ ;⑤碘酒;⑥75%酒精;⑦过氧乙酸(
;⑤碘酒;⑥75%酒精;⑦过氧乙酸( );⑧高铁酸钠
);⑧高铁酸钠 。回答下列问题:
。回答下列问题:
(1)上述杀菌消毒剂属于非电解质的是_______ (填序号),“84”消毒液中有效成分的电离方程式为_______ 。
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。
①巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO_______  的(填“>”或“<”)。当有0.1mol
的(填“>”或“<”)。当有0.1mol 生成时,反应中转移电子为
生成时,反应中转移电子为_______ mol。
②若混合使用“洁厕灵”(盐酸是成分之一)与“84”消毒液会产生氯气。原因是_______ (用离子方程式表示)。
(3)工业上可在NaOH溶液中,用NaClO氧化 的方法制备
的方法制备 。制备反应的离子方程式为
。制备反应的离子方程式为_______ 。
 (在水中一部分可以电离出阴、阳离子);③
(在水中一部分可以电离出阴、阳离子);③ ;④
;④ ;⑤碘酒;⑥75%酒精;⑦过氧乙酸(
;⑤碘酒;⑥75%酒精;⑦过氧乙酸( );⑧高铁酸钠
);⑧高铁酸钠 。回答下列问题:
。回答下列问题:(1)上述杀菌消毒剂属于非电解质的是
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。
①巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与
 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO 的(填“>”或“<”)。当有0.1mol
的(填“>”或“<”)。当有0.1mol 生成时,反应中转移电子为
生成时,反应中转移电子为②若混合使用“洁厕灵”(盐酸是成分之一)与“84”消毒液会产生氯气。原因是
(3)工业上可在NaOH溶液中,用NaClO氧化
 的方法制备
的方法制备 。制备反应的离子方程式为
。制备反应的离子方程式为
您最近一年使用:0次
2022-01-18更新
|
602次组卷
|
3卷引用:山东省泰安市2022-2023学年高一上学期11月期中考试化学试题
4 . 高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下:KMnO4+FeSO4+H2SO4→K2SO4+MnSO4+Fe2(SO4)3+H2O(未配平)。下列说法正确的是
| A.FeSO4没有氧化性 |
| B.生成1mol水时,转移1.25mol电子 |
| C.氧化剂和还原剂物质的量之比为5∶1 |
| D.KMnO4是氧化剂,Fe2(SO4)3是还原产物 |
您最近一年使用:0次
2022-01-05更新
|
349次组卷
|
7卷引用:山东省新泰市新泰中学2022届高三第一次阶段性考试化学试题
名校
5 . 对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可替代的。
I.属于同一类的物质具有相似性,在生活和学习中,使用分类的方法处理问题可以做到举一反三,还可以做到由此及彼的效果。
(1) 、
、 、
、 、
、 都属于酸性氧化物,由
都属于酸性氧化物,由 ,可得出
,可得出 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(2) 、
、 、
、 都属于非强酸形成的酸式盐,由
都属于非强酸形成的酸式盐,由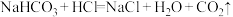 、
、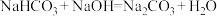 ,完成
,完成 分别与
分别与 、
、 反应的化学方程式
反应的化学方程式___________ 、___________ 。
II.现有物质:①铜②干冰③盐酸④液态醋酸⑤蔗糖⑥ 固体⑦
固体⑦ 溶液⑧熔融的
溶液⑧熔融的
(3)能导电的是:___________ ,属于电解质的是:___________ 。
(4)将 固体溶于水,写出
固体溶于水,写出 的电离方程式:
的电离方程式:___________ 。
(5)按要求写出下列物质间反应的离子反应方程式:
①向 溶液中加入
溶液中加入 溶液
溶液___________ 。
②向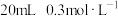 的
的 溶液中加入
溶液中加入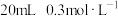 的
的 溶液,反应的离子方程式:
溶液,反应的离子方程式:___________ ﹔继续加入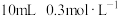 的
的 溶液,反应的离子方程式:
溶液,反应的离子方程式:___________ 。
III.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(6)下图为离子反应、氧化还原反应和置换反应三者间的关系,其中表示离子反应的是___________ (填字母)。

(7)有同学认为所有酸碱中和反应均可表示为 。请举个例子反驳上述观点(用离子方程式表示)
。请举个例子反驳上述观点(用离子方程式表示)___________ 。
(8)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理: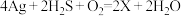 。则
。则 的化学式是
的化学式是______ 。其中 是该反应的
是该反应的______ (填字母)。
A.氧化剂B.还原剂
C.既是氧化剂又是还原剂D.既不是氧化剂也不是还原剂
I.属于同一类的物质具有相似性,在生活和学习中,使用分类的方法处理问题可以做到举一反三,还可以做到由此及彼的效果。
(1)
 、
、 、
、 、
、 都属于酸性氧化物,由
都属于酸性氧化物,由 ,可得出
,可得出 与
与 反应的化学方程式为
反应的化学方程式为(2)
 、
、 、
、 都属于非强酸形成的酸式盐,由
都属于非强酸形成的酸式盐,由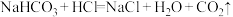 、
、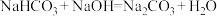 ,完成
,完成 分别与
分别与 、
、 反应的化学方程式
反应的化学方程式II.现有物质:①铜②干冰③盐酸④液态醋酸⑤蔗糖⑥
 固体⑦
固体⑦ 溶液⑧熔融的
溶液⑧熔融的
(3)能导电的是:
(4)将
 固体溶于水,写出
固体溶于水,写出 的电离方程式:
的电离方程式:(5)按要求写出下列物质间反应的离子反应方程式:
①向
 溶液中加入
溶液中加入 溶液
溶液②向
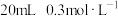 的
的 溶液中加入
溶液中加入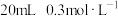 的
的 溶液,反应的离子方程式:
溶液,反应的离子方程式: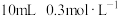 的
的 溶液,反应的离子方程式:
溶液,反应的离子方程式:III.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(6)下图为离子反应、氧化还原反应和置换反应三者间的关系,其中表示离子反应的是

(7)有同学认为所有酸碱中和反应均可表示为
 。请举个例子反驳上述观点(用离子方程式表示)
。请举个例子反驳上述观点(用离子方程式表示)(8)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:
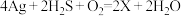 。则
。则 的化学式是
的化学式是 是该反应的
是该反应的A.氧化剂B.还原剂
C.既是氧化剂又是还原剂D.既不是氧化剂也不是还原剂
您最近一年使用:0次
解题方法
6 . 已知:常温常压下一氧化二氯(Cl2O)为棕黄色气体,沸点约3.8°C,42°C以上或浓度较高时分解,易溶于水并与水反应生成HClO,与有机物或还原剂接触会发生燃烧并爆炸。实验室用Cl2O与H2O反应制备HClO的装置如图。

(1)写出装置A中发生的反应的离子方程式___________ 。
(2)C 、F装置中分别盛装___________ 。
(3)实验时,D中应不断通入一定比例的Cl2和干燥空气,其目的是___________ 。
(4)D与E装置之间不用橡胶导管连接的原因是___________ 。
(5)D中盛装含水碳酸钠(即Na2CO3与水按照质量106:9调制而成) ,用来吸收氯气制备Cl2O。如果用Na2CO3·xH2O表示含水碳酸钠,则x为___________ ,发 生反应的化学方程式为___________ 。
(6)次氯酸含量分析:取E装置中试管内黄绿色溶液两等份,一份是通过与足量KI溶液反应生成n(I2) ,来测定n(HClO)与n(Cl2)两者之和;另一份是把氯元素全部转化为AgCl,通过n(AgC1)计算氯元素含量。实验结果是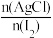 为17:16,则黄绿色溶液
为17:16,则黄绿色溶液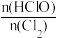 为
为___________ 。

(1)写出装置A中发生的反应的离子方程式
(2)C 、F装置中分别盛装
(3)实验时,D中应不断通入一定比例的Cl2和干燥空气,其目的是
(4)D与E装置之间不用橡胶导管连接的原因是
(5)D中盛装含水碳酸钠(即Na2CO3与水按照质量106:9调制而成) ,用来吸收氯气制备Cl2O。如果用Na2CO3·xH2O表示含水碳酸钠,则x为
(6)次氯酸含量分析:取E装置中试管内黄绿色溶液两等份,一份是通过与足量KI溶液反应生成n(I2) ,来测定n(HClO)与n(Cl2)两者之和;另一份是把氯元素全部转化为AgCl,通过n(AgC1)计算氯元素含量。实验结果是
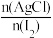 为17:16,则黄绿色溶液
为17:16,则黄绿色溶液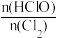 为
为
您最近一年使用:0次
2021-11-21更新
|
601次组卷
|
3卷引用:山东省泰安市2021-2022年高三上学期期中统考化学试题
山东省泰安市2021-2022年高三上学期期中统考化学试题山东省泰安市2022届高三上学期期中考试化学试题(已下线)专题09 定量测定类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
名校
7 . KBr是一种重要的无机化合物,可用于光谱分析和化学分析等。某溴素厂以卤水为原料生产液溴和KBr的工艺流程如下图所示:

回答下列问题:
(1)“氧化Ⅰ”加入稀硫酸的目的是___________ (从化学平衡移动角度解释)。
(2)“还原、富集”时发生反应的离子方程式为___________ 。
(3)“冷凝、分离”后剩余的粗溴水应循环使用,应将其导入到___________ 操作中(填操作单元的名称),该生产流程中可以循环利用的物质有___________ (填名称)。
(4)“尿素还原”时发生反应的化学方程式为___________ 。
(5)KBr可用于测定苯酚样品的纯度:取0.50g苯酚试样,用NaOH溶液溶解后配制成250mL溶液;取该溶液25.00mL,加入25.00mL 0.03mol/L的KBrO3(含过量KBr)标准溶液,然后加入足量盐酸,充分反应后再加足量KI溶液;用0.10mol/L Na2S2O3溶液滴定至淡黄色,加入指示剂,继续滴定至终点,用去Na2S2O3溶液16.20mL。测定过程中物质的转化关系如下:

①加入的指示剂为___________ 。
②苯酚样品的纯度为___________ (计算结果保留到小数点后1位)。

回答下列问题:
(1)“氧化Ⅰ”加入稀硫酸的目的是
(2)“还原、富集”时发生反应的离子方程式为
(3)“冷凝、分离”后剩余的粗溴水应循环使用,应将其导入到
(4)“尿素还原”时发生反应的化学方程式为
(5)KBr可用于测定苯酚样品的纯度:取0.50g苯酚试样,用NaOH溶液溶解后配制成250mL溶液;取该溶液25.00mL,加入25.00mL 0.03mol/L的KBrO3(含过量KBr)标准溶液,然后加入足量盐酸,充分反应后再加足量KI溶液;用0.10mol/L Na2S2O3溶液滴定至淡黄色,加入指示剂,继续滴定至终点,用去Na2S2O3溶液16.20mL。测定过程中物质的转化关系如下:

①加入的指示剂为
②苯酚样品的纯度为
您最近一年使用:0次
2021-11-17更新
|
289次组卷
|
6卷引用:山东省新泰市第一中学2022-2023学年高三上学期期中考试化学试题
解题方法
8 . 某学习小组为认识铁及其化合物的性质和分散系的性质做了如下一系列综合实验。运用所学知识,回答下列问题:
(1)可利用_______ 来区分Fe(OH)3胶体和FeCl3溶液。
(2)铁粉与水蒸气在高温条件下反应的化学方程式是_______ 。
(3)电子工业中,人们常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并从废液中回收 和FeCl3溶液。实验室模拟流程如图所示:
和FeCl3溶液。实验室模拟流程如图所示:

①请写出FeCl3溶液与铜反应的离子方程式_______ 。
②试剂X在反应中体现_______ (填“氧化性”或“还原性”)。
③Z可选用的试剂有_______ (填序号)。
A.硝酸 B.酸性高锰酸钾溶液 C.过氧化氢 D.氯气
(1)可利用
(2)铁粉与水蒸气在高温条件下反应的化学方程式是
(3)电子工业中,人们常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并从废液中回收
 和FeCl3溶液。实验室模拟流程如图所示:
和FeCl3溶液。实验室模拟流程如图所示:
①请写出FeCl3溶液与铜反应的离子方程式
②试剂X在反应中体现
③Z可选用的试剂有
A.硝酸 B.酸性高锰酸钾溶液 C.过氧化氢 D.氯气
您最近一年使用:0次
名校
解题方法
9 . 为探索某工厂的废金属屑(主要成分为Fe、Cu、Al、Al2O3、Fe2O3等)的再利用,某化学兴趣小组设计了如图实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体(CuSO4·5H2O)和水处理剂高铁酸钾(K2FeO4)。

请回答:
(1)试剂X是_______ ;试剂Y是_______ 。
(2)从CuSO4溶液中获取胆矾晶体的操作是_______ 、过滤、洗涤。
(3)写出溶液A转化为固体C的离子方程式_______ 。
(4)由溶液E制取K2FeO4时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由图可知,工业生产中最佳条件(温度和Fe3+的质量浓度g·L-1)为_______ 。

(5)在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的离子方程式为_______ 。
(6)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体25.0g,该废料中铜的质量分数约为_______ 。

请回答:
(1)试剂X是
(2)从CuSO4溶液中获取胆矾晶体的操作是
(3)写出溶液A转化为固体C的离子方程式
(4)由溶液E制取K2FeO4时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由图可知,工业生产中最佳条件(温度和Fe3+的质量浓度g·L-1)为

(5)在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的离子方程式为
(6)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体25.0g,该废料中铜的质量分数约为
您最近一年使用:0次
2021-10-26更新
|
269次组卷
|
3卷引用:山东省新泰市新泰中学2022届高三第一次阶段性考试化学试题
名校
10 . 镍是一种常用的催化剂。以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,制取纳米镍粉,同时获得净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]的工艺流程如图:
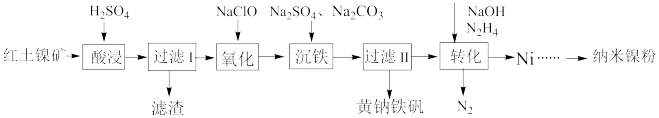
回答下列问题:
(1)黄钠铁矾[NaFe3(SO4)2(OH)6]中,铁的化合价为___ 价。
(2)“氧化”过程发生反应的离子方程式是___ 。
(3)“沉铁”过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域)。若反应在80℃时进行,加碳酸钠偏多,则所得黄钠铁矾中混有的杂质是___ ;检验沉铁反应是否完全的方法是___ 。

(4)“转化”过程,向“过滤II”所得滤液(富含Ni2+)中加入N2H4,控制溶液中NaOH的浓度,可得到不同晶态物质(NiSO4·N2H4、Ni或二者的混合物)。写出生成Ni的离子方程式___ ;在其他条件不变的情况下,随NaOH浓度增大,产物中Ni的含量增加,原因是:___ 。
(5)化学镀镍是金属表面镀镍的常用方法,以NiSO4为镀液,次亚磷酸钠(NaH2PO2)为还原剂,在90℃的酸性溶液中发生反应,NaH2PO2被氧化为亚磷酸(H3PO3)。写出化学镀镍反应的离子方程式___ 。

回答下列问题:
(1)黄钠铁矾[NaFe3(SO4)2(OH)6]中,铁的化合价为
(2)“氧化”过程发生反应的离子方程式是
(3)“沉铁”过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域)。若反应在80℃时进行,加碳酸钠偏多,则所得黄钠铁矾中混有的杂质是

(4)“转化”过程,向“过滤II”所得滤液(富含Ni2+)中加入N2H4,控制溶液中NaOH的浓度,可得到不同晶态物质(NiSO4·N2H4、Ni或二者的混合物)。写出生成Ni的离子方程式
(5)化学镀镍是金属表面镀镍的常用方法,以NiSO4为镀液,次亚磷酸钠(NaH2PO2)为还原剂,在90℃的酸性溶液中发生反应,NaH2PO2被氧化为亚磷酸(H3PO3)。写出化学镀镍反应的离子方程式
您最近一年使用:0次
2021-10-13更新
|
146次组卷
|
2卷引用:山东省六校(泰安一中、菏泽一中、章丘四中、东营一中、济宁一中、聊城一中、胜利一中)2022届高三“山东学情”10月联考化学试题A卷



