1 . 常温下,往烧杯中加入10mL1mol/LFeCl3溶液和10mL2mol/LKI溶液,c(I-)随时间变化如图所示,不考虑溶液混合时体积的改变。下列说法正确的是
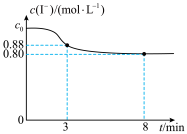
| A.c0=2 |
| B.3~8min内,Fe3+的平均反应速率为0.08mol/(L·min) |
| C.8min时,往烧杯中滴加KSCN溶液,溶液不变红 |
D.烧杯中发生反应的离子方程式为2Fe3++2I- 2Fe2++I2 2Fe2++I2 |
您最近一年使用:0次
名校
解题方法
2 . 氧化还原反应在工农业生产、日常生活中具有广泛用途。
(1)吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠( ),能消除人体内的活性氧,由此推断
),能消除人体内的活性氧,由此推断 的作用是作
的作用是作______ (填“氧化剂”或“还原剂”)。
(2)高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理。工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为:
)是一种新型绿色消毒剂,主要用于饮用水处理。工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为: 。请双线桥法标出上述反应中电子转移的方向和数目:
。请双线桥法标出上述反应中电子转移的方向和数目:____________ 。
(3) 是一种常用的消毒剂,工业上制备
是一种常用的消毒剂,工业上制备 的反应:
的反应: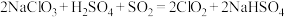
①氧化剂和还原剂的质量之比是____________ 。
②请用单线桥法标出上述反应电子转移的方向和数目:____________ 。
(4) 可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
①从 氧元素的化合价可推测,
氧元素的化合价可推测, 既具有
既具有______ 性,又具有______ 性。
② 被称为“绿色氧化剂”的理由是
被称为“绿色氧化剂”的理由是____________ 。
③已知反应物和生成物共有六种粒子: 、
、 、
、 、
、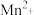 、
、 、
、 。反应后溶液紫红色褪去,并有气泡产生。则该反应的离子方程式为
。反应后溶液紫红色褪去,并有气泡产生。则该反应的离子方程式为____________ 。
(1)吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(
 ),能消除人体内的活性氧,由此推断
),能消除人体内的活性氧,由此推断 的作用是作
的作用是作(2)高铁酸钠(
 )是一种新型绿色消毒剂,主要用于饮用水处理。工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为:
)是一种新型绿色消毒剂,主要用于饮用水处理。工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为: 。请双线桥法标出上述反应中电子转移的方向和数目:
。请双线桥法标出上述反应中电子转移的方向和数目:(3)
 是一种常用的消毒剂,工业上制备
是一种常用的消毒剂,工业上制备 的反应:
的反应: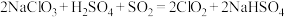
①氧化剂和还原剂的质量之比是
②请用单线桥法标出上述反应电子转移的方向和数目:
(4)
 可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
可作为矿业废液消毒剂,有“绿色氧化剂”的美称。①从
 氧元素的化合价可推测,
氧元素的化合价可推测, 既具有
既具有②
 被称为“绿色氧化剂”的理由是
被称为“绿色氧化剂”的理由是③已知反应物和生成物共有六种粒子:
 、
、 、
、 、
、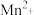 、
、 、
、 。反应后溶液紫红色褪去,并有气泡产生。则该反应的离子方程式为
。反应后溶液紫红色褪去,并有气泡产生。则该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 钠及其化合物的“价-类”二维图及部分转化关系如图所示,其中B为钠的另一种氧化物。下列有关说法正确的是
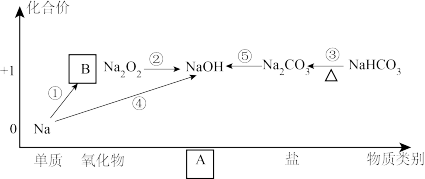
A.物质B为 ,是碱性氧化物,A的物质类别为碱 ,是碱性氧化物,A的物质类别为碱 |
| B.反应④通过加入还原剂实现转化 |
| C.钠放入硫酸铜溶液中可观察到红色固体析出 |
D.可用澄清的石灰水鉴别 溶液和 溶液和 溶液 溶液 |
您最近一年使用:0次
4 . 下列转化过程必须加入还原剂才能实现的是
A.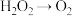 | B. | C.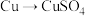 | D. |
您最近一年使用:0次
名校
解题方法
5 . “类推”是化学学习常用的一种方法,以下类推结论正确的是
选项 | 实际事实 | 类推结果 |
A |  只有氧化性 只有氧化性 |  也只有氧化性 也只有氧化性 |
B |  与 与 反应生成 反应生成 |  与 与 反应生成 反应生成 |
C |  可以与水反应生成 可以与水反应生成 |  也可以与水反应生成 也可以与水反应生成 |
D |  分子中有两个H属于二元酸 分子中有两个H属于二元酸 |  分子中有四个H属于多元酸 分子中有四个H属于多元酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 我国科学家成功利用CO2合成淀粉,使“粮食”生产从农耕种植转向工业制造成为可能,部分转化过程如下:
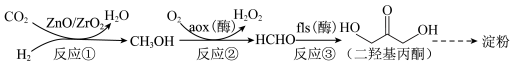
| A.反应①中1 mol CO2反应失去6 mol电子 | B.反应②中n(CH3OH):n(O2)=2:1 |
| C.反应③中发生了加成反应 | D.反应①~③在高温下反应速率会更快 |
您最近一年使用:0次
解题方法
7 . 下列反应不符合哲学中“量变引起质变”观点的是
| A.锌与硫酸 | B.FeBr2溶液和氯水 |
| C.铜和硝酸 | D.氨气和氯化氢 |
您最近一年使用:0次
解题方法
8 . Ⅰ.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是___________ 。(写化学式)
(2)步骤②中的离子方程式___________ 。
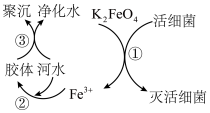
Ⅱ.高铁酸钾(极易溶于水)是优良的水处理剂,其原理如图所示:___________ (填“氧化”或“还原”)性;根据上述原理分析,K2FeO4作水处理剂净化水的过程中利用了Fe(OH)3胶体的性质,请写出Fe(OH)3胶体制备的化学方程式:___________ 。
Ⅲ.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3XO2与NaOH反应最多生成两种盐。
(4)H3XO2属于___________ (填编号)。
①一元酸 ②二元酸 ③三元酸
(5)写出 H3XO2溶液与少量NaOH溶液反应的化学方程式___________ 。
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是
(2)步骤②中的离子方程式
Ⅱ.高铁酸钾(极易溶于水)是优良的水处理剂,其原理如图所示:
Ⅲ.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3XO2与NaOH反应最多生成两种盐。
(4)H3XO2属于
①一元酸 ②二元酸 ③三元酸
(5)写出 H3XO2溶液与少量NaOH溶液反应的化学方程式
您最近一年使用:0次
9 . 用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2O3、FeO等)生产ZnSO4∙7H2O的流程如下(已知PbO不溶于稀硫酸酸):
(1)“酸浸”时用的稀酸是_______ (写名称)。
(2)加入NaClO的目的是_______ ,加入ZnO除杂时pH控制范围是_______ ~5.0。
(3)写出ZnO除杂得到滤渣2的离子反应方程式_______ 。
(4)滤渣3是_______ (写化学式) 。
(5)由滤液得到ZnSO4∙7H2O的操作是 蒸发浓缩、_______ 、 过滤、洗涤、干燥。
(6)已知Fe3+沉淀完全的标准为1.0×10-6mol。L-1,根据题目条件求常温下Fe(OH)3的Ksp=_______ 。

| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
| 沉淀完全的pH | 3.0 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是
(2)加入NaClO的目的是
(3)写出ZnO除杂得到滤渣2的离子反应方程式
(4)滤渣3是
(5)由滤液得到ZnSO4∙7H2O的操作是 蒸发浓缩、
(6)已知Fe3+沉淀完全的标准为1.0×10-6mol。L-1,根据题目条件求常温下Fe(OH)3的Ksp=
您最近一年使用:0次
10 . 氯气性质的微型实验装置如右图所示。①是浓盐酸,⑥是高锰酸钾,②至⑤是滤纸条,依次滴有氢氧化钠溶液、石蕊溶液、淀粉-KI溶液、含KSCN的 溶液,实验时滴几滴浓盐酸。已知:
溶液,实验时滴几滴浓盐酸。已知: 可与KSCN反应生成红色物质。下列说法不正确的是
可与KSCN反应生成红色物质。下列说法不正确的是
 溶液,实验时滴几滴浓盐酸。已知:
溶液,实验时滴几滴浓盐酸。已知: 可与KSCN反应生成红色物质。下列说法不正确的是
可与KSCN反应生成红色物质。下列说法不正确的是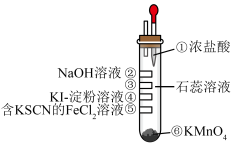
| A.③处先变红后褪色,是因为氯水具有酸性和强氧化性 |
| B.④处变蓝色 |
| C.⑤处变红色 |
D.本实验可推知氧化性: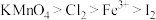 |
您最近一年使用:0次



