解题方法
1 . Ⅰ.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是___________ 。(写化学式)
(2)步骤②中的离子方程式___________ 。
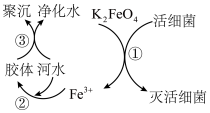
Ⅱ.高铁酸钾(极易溶于水)是优良的水处理剂,其原理如图所示:___________ (填“氧化”或“还原”)性;根据上述原理分析,K2FeO4作水处理剂净化水的过程中利用了Fe(OH)3胶体的性质,请写出Fe(OH)3胶体制备的化学方程式:___________ 。
Ⅲ.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3XO2与NaOH反应最多生成两种盐。
(4)H3XO2属于___________ (填编号)。
①一元酸 ②二元酸 ③三元酸
(5)写出 H3XO2溶液与少量NaOH溶液反应的化学方程式___________ 。
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是
(2)步骤②中的离子方程式
Ⅱ.高铁酸钾(极易溶于水)是优良的水处理剂,其原理如图所示:
Ⅲ.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3XO2与NaOH反应最多生成两种盐。
(4)H3XO2属于
①一元酸 ②二元酸 ③三元酸
(5)写出 H3XO2溶液与少量NaOH溶液反应的化学方程式
您最近一年使用:0次
2 . 用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2O3、FeO等)生产ZnSO4∙7H2O的流程如下(已知PbO不溶于稀硫酸酸):
(1)“酸浸”时用的稀酸是_______ (写名称)。
(2)加入NaClO的目的是_______ ,加入ZnO除杂时pH控制范围是_______ ~5.0。
(3)写出ZnO除杂得到滤渣2的离子反应方程式_______ 。
(4)滤渣3是_______ (写化学式) 。
(5)由滤液得到ZnSO4∙7H2O的操作是 蒸发浓缩、_______ 、 过滤、洗涤、干燥。
(6)已知Fe3+沉淀完全的标准为1.0×10-6mol。L-1,根据题目条件求常温下Fe(OH)3的Ksp=_______ 。

| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
| 沉淀完全的pH | 3.0 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是
(2)加入NaClO的目的是
(3)写出ZnO除杂得到滤渣2的离子反应方程式
(4)滤渣3是
(5)由滤液得到ZnSO4∙7H2O的操作是 蒸发浓缩、
(6)已知Fe3+沉淀完全的标准为1.0×10-6mol。L-1,根据题目条件求常温下Fe(OH)3的Ksp=
您最近一年使用:0次
3 . 氯气性质的微型实验装置如右图所示。①是浓盐酸,⑥是高锰酸钾,②至⑤是滤纸条,依次滴有氢氧化钠溶液、石蕊溶液、淀粉-KI溶液、含KSCN的 溶液,实验时滴几滴浓盐酸。已知:
溶液,实验时滴几滴浓盐酸。已知: 可与KSCN反应生成红色物质。下列说法不正确的是
可与KSCN反应生成红色物质。下列说法不正确的是
 溶液,实验时滴几滴浓盐酸。已知:
溶液,实验时滴几滴浓盐酸。已知: 可与KSCN反应生成红色物质。下列说法不正确的是
可与KSCN反应生成红色物质。下列说法不正确的是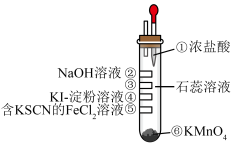
| A.③处先变红后褪色,是因为氯水具有酸性和强氧化性 |
| B.④处变蓝色 |
| C.⑤处变红色 |
D.本实验可推知氧化性: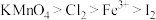 |
您最近一年使用:0次
解题方法
4 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确的是
实验目的 | 方案设计 | 现象 | 结论 | |
A | 验证NaCl、Na2SO4混合溶液中的Cl- | 取少量混合溶液于试管中,加入过量Ba(NO3)2溶液,静置,向上层清液中滴加稀硝酸酸化AgNO3溶液 | 若上层清液变浑浊 | 则混合溶液中含有Cl- |
B | 探究CF2Cl2分子的极性与非极性 | 用毛皮摩擦过的带电橡胶棒靠近CF2Cl2液流 | 液流方向改变 | CF2Cl2是极性分子 |
C | 比较HCOOH和H2S的酸性 | 分别测等物质的量浓度的HCOONH4和(NH4)2S溶液的pH | 前者的pH小 | 酸性:HCOOH>H2S |
D | 探究SO2和Fe3+的反应{已知[Fe(SO2)6]3+呈红棕色} | 将SO2气体通入FeCl3溶液中 | 溶液先变为红棕色,过一段时间又变成浅绿色 | SO2和Fe3+络合反应速率比氧化还原反应速率快,但氧化还原反应的平衡常数更大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 在溶液中能大量共存的离子组是
A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、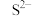 | D. 、 、 、 、 、 、 |
您最近一年使用:0次
6 . 我国的冶金工业十分发达,钢铁年产量已达到十亿吨,占世界产量的一半以上,同时有色金属产量也超过了七千万吨。
(1)铜是人类最早使用的金属,其电阻率小、延展性好,常用于制作电路板,在使用氯化铁溶液蚀刻铜制电路板时,发生反应的化学方程式为___________ 。
(2)铝与 溶液反应的化学方程式为
溶液反应的化学方程式为___________ ;铝的化学性质较活泼,但在空气中不会完全锈蚀,其原因是___________ 。
(3)电镀是一种常见的金属处理工艺,然而在生产过程中,电镀厂会产生大量的高毒性废水,将其直接排放会造成严重的污染。因此,废水的处理是电镀行业面临的主要问题之一。
①在电镀之前,镀件需要用酸性 溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的
溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的 固体,将
固体,将 还原为
还原为 ,则还原过程中发生反应的离子方程式为
,则还原过程中发生反应的离子方程式为___________ ,当有 被完全处理时,理论上需要加入
被完全处理时,理论上需要加入 的质量为
的质量为___________ 。
②为了减缓镀件表面的金属沉积速率,得到均匀、光滑的镀层,电解液中除重金属盐外,还需要加入剧毒的 。已知
。已知 中各原子均满足8电子稳定结构,则
中各原子均满足8电子稳定结构,则 的电子式为
的电子式为___________ 。在碱性的废电解液中通入氯气可以将 氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为___________ 。
(1)铜是人类最早使用的金属,其电阻率小、延展性好,常用于制作电路板,在使用氯化铁溶液蚀刻铜制电路板时,发生反应的化学方程式为
(2)铝与
 溶液反应的化学方程式为
溶液反应的化学方程式为(3)电镀是一种常见的金属处理工艺,然而在生产过程中,电镀厂会产生大量的高毒性废水,将其直接排放会造成严重的污染。因此,废水的处理是电镀行业面临的主要问题之一。
①在电镀之前,镀件需要用酸性
 溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的
溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的 固体,将
固体,将 还原为
还原为 ,则还原过程中发生反应的离子方程式为
,则还原过程中发生反应的离子方程式为 被完全处理时,理论上需要加入
被完全处理时,理论上需要加入 的质量为
的质量为②为了减缓镀件表面的金属沉积速率,得到均匀、光滑的镀层,电解液中除重金属盐外,还需要加入剧毒的
 。已知
。已知 中各原子均满足8电子稳定结构,则
中各原子均满足8电子稳定结构,则 的电子式为
的电子式为 氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
您最近一年使用:0次
名校
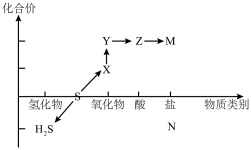
7 . 硫及其化合物的“价-类”二维图体现了化学变化之美。___________ (用化学式表示,下同),从硫元素的化合价角度分析,图中所示物质既有氧化性又有还原性的物质有___________ 。
(2)将X与H2S混合,反应的化学方程式为___________ ,其中氧化产物与还原产物的物质的量之比为___________ 。
(3)Z的稀溶液可与Ba(OH)2溶液发生反应,其离子方程式为___________ ;
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________;
(5)某小组实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2,有同学认为制得的SO2中可能混有杂质(不考虑水蒸气),其杂质气体的化学式为___________ 。
(2)将X与H2S混合,反应的化学方程式为
(3)Z的稀溶液可与Ba(OH)2溶液发生反应,其离子方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________;
| A.Na2S+S | B.Na2SO3+S | C.SO2+Na2SO4 | D.Na2SO3+Na2SO4 |
(5)某小组实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2,有同学认为制得的SO2中可能混有杂质(不考虑水蒸气),其杂质气体的化学式为
您最近一年使用:0次
8 . 天然气在实现“双碳”目标进程中发挥着重要的作用,成为能源低碳转型的首选能源之一。
(1)开采出的天然气中含有 ,
, 会直接影响化工合成,并产生污染。T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图1所示。
会直接影响化工合成,并产生污染。T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图1所示。______ 。
②根据反应机理图可知 、S、
、S、 三种物质在酸性条件下氧化性强弱顺序为
三种物质在酸性条件下氧化性强弱顺序为______ 。
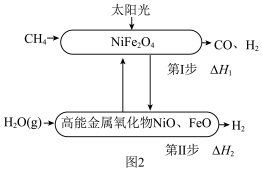
(2)甲烷重整制氢工艺与太阳能相结合可有效降低碳排放,一种利用太阳能催化甲烷蒸气重整制氢的反应原理如图2所示。 ,第Ⅱ步反应生成1mol
,第Ⅱ步反应生成1mol  的焓变为
的焓变为 ,利用太阳能催化甲烷蒸气重整制氢反应的热化学方程式为
,利用太阳能催化甲烷蒸气重整制氢反应的热化学方程式为_______ (用 、
、 表示)。
表示)。
②第Ⅰ、Ⅱ步反应的 随温度的变化如图3所示,升高温度,第Ⅱ步反应平衡
随温度的变化如图3所示,升高温度,第Ⅱ步反应平衡______ (填“向左”“向右”或“不”)移动。
_____ 。
(3) 超干重整
超干重整 可催化生产合成气:
可催化生产合成气:
 。在体积为2L的恒容密闭容器中,充入2mol
。在体积为2L的恒容密闭容器中,充入2mol  和3mol
和3mol  ,加入催化剂并加热至
,加入催化剂并加热至 发生反应,容器内的总压强
发生反应,容器内的总压强 随时间t的变化如图4所示。
随时间t的变化如图4所示。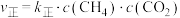 ,
,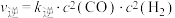 ,其中
,其中 、
、 为仅与温度有关的速率常数,平衡后若将温度由
为仅与温度有关的速率常数,平衡后若将温度由 升高到
升高到 ,则速率常数增大的倍数:
,则速率常数增大的倍数:
_____  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
②0~10min用 表示的平均反应速率为
表示的平均反应速率为______  。
。
(1)开采出的天然气中含有
 ,
, 会直接影响化工合成,并产生污染。T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图1所示。
会直接影响化工合成,并产生污染。T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图1所示。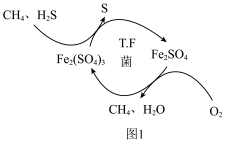
②根据反应机理图可知
 、S、
、S、 三种物质在酸性条件下氧化性强弱顺序为
三种物质在酸性条件下氧化性强弱顺序为(2)甲烷重整制氢工艺与太阳能相结合可有效降低碳排放,一种利用太阳能催化甲烷蒸气重整制氢的反应原理如图2所示。
 ,第Ⅱ步反应生成1mol
,第Ⅱ步反应生成1mol  的焓变为
的焓变为 ,利用太阳能催化甲烷蒸气重整制氢反应的热化学方程式为
,利用太阳能催化甲烷蒸气重整制氢反应的热化学方程式为 、
、 表示)。
表示)。②第Ⅰ、Ⅱ步反应的
 随温度的变化如图3所示,升高温度,第Ⅱ步反应平衡
随温度的变化如图3所示,升高温度,第Ⅱ步反应平衡

(3)
 超干重整
超干重整 可催化生产合成气:
可催化生产合成气:
 。在体积为2L的恒容密闭容器中,充入2mol
。在体积为2L的恒容密闭容器中,充入2mol  和3mol
和3mol  ,加入催化剂并加热至
,加入催化剂并加热至 发生反应,容器内的总压强
发生反应,容器内的总压强 随时间t的变化如图4所示。
随时间t的变化如图4所示。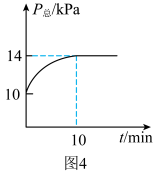
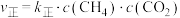 ,
,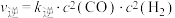 ,其中
,其中 、
、 为仅与温度有关的速率常数,平衡后若将温度由
为仅与温度有关的速率常数,平衡后若将温度由 升高到
升高到 ,则速率常数增大的倍数:
,则速率常数增大的倍数:
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。②0~10min用
 表示的平均反应速率为
表示的平均反应速率为 。
。
您最近一年使用:0次
名校
解题方法
9 . 常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,其中心原子Cl为sp2杂化已被联合国卫生组织(WTO)列为Al级高效安全消毒剂,其中心原子Cl为sp2杂化。已知,工业上制备二氧化氯的方法之一是用甲醇在酸性条件下与氯酸钠反应,其反应的化学方程式:CH3OH+6NaClO3+3H2SO4=CO2↑+6ClO2↑+3Na2SO4+5H2O,则下列说法错误的是
| A.CO2是非极性分子 | B.键角: < < |
| C.CH3OH在反应中发生氧化反应 | D.ClO2分子空间构型为V形 |
您最近一年使用:0次
10 . 细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如下图所示。_______ (填字母序号)。
a.N2转化为氨态氮 b.硝化过程 c.反硝化过程
(2)氮肥是水体中氨态氮的主要来源之一,氨气是生产氮肥的主要原料,工业合成氨的化学方程式为_______ 。
(3)硝化过程中,含氮物质发生_______ (填“氧化”或“还原”)反应。
(4)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02 mol 氮气时,转移的电子的物质的量为_______ mol。
(5)NO是大气污染气体,测定某气体样品中NO含量操作如下:将2L气样通入适量酸化的H2O2溶液中,使NO完全被氧化为 。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为
。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为 的离子方程式是
的离子方程式是______ 。上述过程中发生下列反应:3Fe2++ +4H+=NO↑+3Fe3++2H2O;
+4H+=NO↑+3Fe3++2H2O; + 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为
+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为_______ mg /L。(保留计算过程)
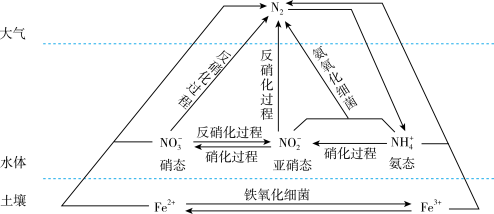
a.N2转化为氨态氮 b.硝化过程 c.反硝化过程
(2)氮肥是水体中氨态氮的主要来源之一,氨气是生产氮肥的主要原料,工业合成氨的化学方程式为
(3)硝化过程中,含氮物质发生
(4)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02 mol 氮气时,转移的电子的物质的量为
(5)NO是大气污染气体,测定某气体样品中NO含量操作如下:将2L气样通入适量酸化的H2O2溶液中,使NO完全被氧化为
 。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为
。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为 的离子方程式是
的离子方程式是 +4H+=NO↑+3Fe3++2H2O;
+4H+=NO↑+3Fe3++2H2O; + 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为
+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为
您最近一年使用:0次



