名校
解题方法
1 . 废旧三元锂离子电池正极材料主要成分为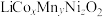 (含有铝箔、炭黑、有机物等杂质)。通过热处理、浸出、有价金属分离等过程回收钴、锰、镍、锂等金属的工艺流程如图所示:
(含有铝箔、炭黑、有机物等杂质)。通过热处理、浸出、有价金属分离等过程回收钴、锰、镍、锂等金属的工艺流程如图所示:

已知:①“碱浸”后的滤渣中主要含有 、
、 、
、 ,
, 、
、 ;
;
②已知 的溶解度如表所示:
的溶解度如表所示:
回答下列问题:
(1)“粉碎灼烧”的目的是___________ 。
(2)“酸浸”时加入 的目的是
的目的是________________ 。
(3)“沉锰”时用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中 的浓度,发生反应的离子方程式为
的浓度,发生反应的离子方程式为___________ 。某同学进行了如下操作:取溶液 ,稀释至
,稀释至 ,取
,取 稀释后的溶液于锥形瓶中,用浓度为
稀释后的溶液于锥形瓶中,用浓度为 溶液进行滴定,滴定终点时,用去的
溶液进行滴定,滴定终点时,用去的 溶液体积平均值为
溶液体积平均值为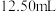 。
。
①滴定终点时的现象是______ ;
②经计算,此次实验测得的原溶液中 的浓度为
的浓度为_________ ;
③滴定终点后读数时发现滴定管尖嘴处有气泡,若其它环节无误,则此次实验测得的 浓度
浓度_______ (填“偏大”“偏小”或“不受影响”)。
(4)流程中用“热水洗涤”的原因是____________________ 。
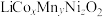 (含有铝箔、炭黑、有机物等杂质)。通过热处理、浸出、有价金属分离等过程回收钴、锰、镍、锂等金属的工艺流程如图所示:
(含有铝箔、炭黑、有机物等杂质)。通过热处理、浸出、有价金属分离等过程回收钴、锰、镍、锂等金属的工艺流程如图所示:
已知:①“碱浸”后的滤渣中主要含有
 、
、 、
、 ,
, 、
、 ;
;②已知
 的溶解度如表所示:
的溶解度如表所示:| 温度/℃ | 0 | 20 | 80 |
 | 1.54 | 1.33 | 0.85 |
(1)“粉碎灼烧”的目的是
(2)“酸浸”时加入
 的目的是
的目的是(3)“沉锰”时用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中
 的浓度,发生反应的离子方程式为
的浓度,发生反应的离子方程式为 ,稀释至
,稀释至 ,取
,取 稀释后的溶液于锥形瓶中,用浓度为
稀释后的溶液于锥形瓶中,用浓度为 溶液进行滴定,滴定终点时,用去的
溶液进行滴定,滴定终点时,用去的 溶液体积平均值为
溶液体积平均值为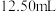 。
。①滴定终点时的现象是
②经计算,此次实验测得的原溶液中
 的浓度为
的浓度为③滴定终点后读数时发现滴定管尖嘴处有气泡,若其它环节无误,则此次实验测得的
 浓度
浓度(4)流程中用“热水洗涤”的原因是
您最近一年使用:0次
解题方法
2 . Ⅰ.金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是2NaCl(熔融) 2Na+Cl2↑。回答下列问题:
2Na+Cl2↑。回答下列问题:
(1)保存金属钠的正确方法是___________(填字母)。
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),请写出该反应的化学方程式:___________ ,生成物的颜色为___________ 。

(3)Na、NaOH久置在空气中最终都是变为___________ (填化学式)。
(4)将一小块金属钠投入CuCl2溶液中,发生反应的化学方程式为___________ 。
Ⅱ. 是重要的化工原料,具有多种用途。
是重要的化工原料,具有多种用途。
(5) 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与CO2反应的化学方程式
与CO2反应的化学方程式___________ 。
(6)将一定量的 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有___________ (填离子符号)。
(7)查阅资料知: 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。请回答下列问题:
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。请回答下列问题:
①已知 能发生如下反应:
能发生如下反应: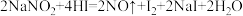 。上述反应中氧化剂是
。上述反应中氧化剂是___________ ,氧化产物是___________ ;HI在反应中体现了什么性质___________ 。
②根据上述反应鉴别 和NaCl,可选择以下物质中的
和NaCl,可选择以下物质中的___________ 进行实验(填序号)。
A.食用白醋 B.碘化钾淀粉试纸 C.淀粉 D.白酒
③某厂废液中含有3%—6%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的N2的是
转化为不引起二次污染的N2的是___________ (填序号)。
A.浓硫酸 B. C.HNO3 D.
C.HNO3 D.
 2Na+Cl2↑。回答下列问题:
2Na+Cl2↑。回答下列问题:(1)保存金属钠的正确方法是___________(填字母)。
| A.放在棕色瓶中 | B.放在细沙中 | C.放在水中 | D.放在煤油中 |
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),请写出该反应的化学方程式:

(3)Na、NaOH久置在空气中最终都是变为
(4)将一小块金属钠投入CuCl2溶液中,发生反应的化学方程式为
Ⅱ.
 是重要的化工原料,具有多种用途。
是重要的化工原料,具有多种用途。(5)
 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与CO2反应的化学方程式
与CO2反应的化学方程式(6)将一定量的
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有(7)查阅资料知:
 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。请回答下列问题:
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。请回答下列问题:①已知
 能发生如下反应:
能发生如下反应: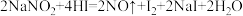 。上述反应中氧化剂是
。上述反应中氧化剂是②根据上述反应鉴别
 和NaCl,可选择以下物质中的
和NaCl,可选择以下物质中的A.食用白醋 B.碘化钾淀粉试纸 C.淀粉 D.白酒
③某厂废液中含有3%—6%的
 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的N2的是
转化为不引起二次污染的N2的是A.浓硫酸 B.
 C.HNO3 D.
C.HNO3 D.
您最近一年使用:0次
解题方法
3 . 硫酸铁铵晶体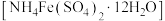 是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
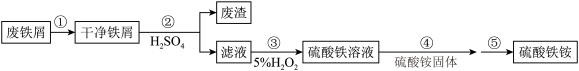
回答下列问题:
(1) 中
中 元素的化合价为
元素的化合价为____________ 。
(2)步骤②的离子反应方程式为____________ ,分离废渣的操作是____________ 。
(3)步骤③发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为____________ 。
(4)步骤⑤的具体操作有蒸发浓缩、____________ 、过滤洗涤,经干燥得到硫酸铁铵晶体。
(5)人体主要吸收 ,因此常以
,因此常以 做补铁剂,但其中
做补铁剂,但其中 常因保存不善而氧化为
常因保存不善而氧化为 。请你设计实验对市售某种
。请你设计实验对市售某种 补铁药片进行检测,判断其是否氧化变质。
补铁药片进行检测,判断其是否氧化变质。
某补铁口服液中的 含量为
含量为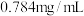 ,则该补铁口服液中
,则该补铁口服液中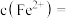
____________  。
。
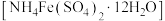 是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)
 中
中 元素的化合价为
元素的化合价为(2)步骤②的离子反应方程式为
(3)步骤③发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为
(4)步骤⑤的具体操作有蒸发浓缩、
(5)人体主要吸收
 ,因此常以
,因此常以 做补铁剂,但其中
做补铁剂,但其中 常因保存不善而氧化为
常因保存不善而氧化为 。请你设计实验对市售某种
。请你设计实验对市售某种 补铁药片进行检测,判断其是否氧化变质。
补铁药片进行检测,判断其是否氧化变质。| 实验步骤 | 实验现象 | 实验结论 |
步骤1:取市售 药片于烧杯中,加入适量蒸馏水。 药片于烧杯中,加入适量蒸馏水。 | 药片溶解 | |
| 步骤2:取少量步骤1所得溶液于试管,滴加几滴 | 该药片已变质。 |
 含量为
含量为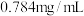 ,则该补铁口服液中
,则该补铁口服液中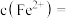
 。
。
您最近一年使用:0次
4 . 很多化学反应条件不同,产物不同,如 与KOH反应,常温下生成KClO,加热生成
与KOH反应,常温下生成KClO,加热生成 。实验室利用下图装置制备
。实验室利用下图装置制备 ,然后进一步探究其性质。
,然后进一步探究其性质。
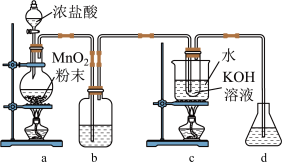
回答下列问题:
(1)装置a可用于实验室制 ,反应的化学方程式是
,反应的化学方程式是_____ 。
(2)装置b的作用是_____ ,可选用_____ 溶液。
(3)c中采用的加热方式是_____ ,反应的离子方程式为_____ ,该反应中氧化剂和还原剂的物质的量之比为_____ 。
(4)若d装置中溶液是NaOH溶液,其作用是_____ 。
(5)取c中溶液,滴加浓盐酸并加热,可产生黄绿色气体,结合上述 的制备实验,可说明在碱性条件下氧化性:
的制备实验,可说明在碱性条件下氧化性:
_____  (填“>”“<”或“=”,下同),酸性条件下氧化性:
(填“>”“<”或“=”,下同),酸性条件下氧化性:
_____  。
。
 与KOH反应,常温下生成KClO,加热生成
与KOH反应,常温下生成KClO,加热生成 。实验室利用下图装置制备
。实验室利用下图装置制备 ,然后进一步探究其性质。
,然后进一步探究其性质。
回答下列问题:
(1)装置a可用于实验室制
 ,反应的化学方程式是
,反应的化学方程式是(2)装置b的作用是
(3)c中采用的加热方式是
(4)若d装置中溶液是NaOH溶液,其作用是
(5)取c中溶液,滴加浓盐酸并加热,可产生黄绿色气体,结合上述
 的制备实验,可说明在碱性条件下氧化性:
的制备实验,可说明在碱性条件下氧化性:
 (填“>”“<”或“=”,下同),酸性条件下氧化性:
(填“>”“<”或“=”,下同),酸性条件下氧化性:
 。
。
您最近一年使用:0次
2024-01-21更新
|
110次组卷
|
3卷引用:四川省南充市阆中东风中学校2023-2024学年高一上学期第二次段考化学试题
5 . 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中KCN,其浓度为650 mg·L-1.现用氯氧化法处理,发生如下反应(其中N均为-3价、O均为-2价):KCN+2KOH+Cl2=KOCN+2KCl+H2O,该反应中被氧化的元素是___________ 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移的方向和数目:2KOCN+4KOH+3Cl2=2CO2↑+N2↑+6KCl+2H2O___________ 。
(3)若处理上述废水20.0L,使KCN完全转化为无毒物质,至少需要液氯___________ g。
(4)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是___________ 。
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1︰1.写出该反应的化学方程式:___________ 。(已知:氯元素最高化合价为+7价)
(1)某厂废水中KCN,其浓度为650 mg·L-1.现用氯氧化法处理,发生如下反应(其中N均为-3价、O均为-2价):KCN+2KOH+Cl2=KOCN+2KCl+H2O,该反应中被氧化的元素是
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移的方向和数目:2KOCN+4KOH+3Cl2=2CO2↑+N2↑+6KCl+2H2O
(3)若处理上述废水20.0L,使KCN完全转化为无毒物质,至少需要液氯
(4)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1︰1.写出该反应的化学方程式:
您最近一年使用:0次
6 . 离子反应和氧化还原反应是中学阶段重要的两大反应类型。请回答下列问题:
Ⅰ.某溶液中只可能含有Na+、Ca2+、CO 、Cl-四种离子中的一种或几种。现进行以下实验:取上述溶液少量,加入过量AgNO3溶液,产生白色沉淀,过滤,向沉淀中加入过量硝酸,沉淀部分溶解,并产生气体。由以上实验判断:
、Cl-四种离子中的一种或几种。现进行以下实验:取上述溶液少量,加入过量AgNO3溶液,产生白色沉淀,过滤,向沉淀中加入过量硝酸,沉淀部分溶解,并产生气体。由以上实验判断:
(1)该溶液中肯定存在的离子有_______ 。
(2)加入硝酸银溶液涉及的反应的离子方程式是_______ 。
Ⅱ.根据下表信息,解答有关问题。
(3)取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:滴加适量H2O2,紫红色褪去,并有无色气泡产生;再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
①在配制酸性KMnO4溶液时,不能用盐酸,原因是_______ 。
②KMnO4、H2O2、PbO2的氧化性由强到弱的顺序为_______ 。
③写出滴加适量H2O2发生反应的离子方程式并用单线桥标出电子转移_______ 。
(4)根据上述反应能否比较Cl2与H2O2的氧化性强弱?_______ (填“能”或“不能”)。
Ⅰ.某溶液中只可能含有Na+、Ca2+、CO
 、Cl-四种离子中的一种或几种。现进行以下实验:取上述溶液少量,加入过量AgNO3溶液,产生白色沉淀,过滤,向沉淀中加入过量硝酸,沉淀部分溶解,并产生气体。由以上实验判断:
、Cl-四种离子中的一种或几种。现进行以下实验:取上述溶液少量,加入过量AgNO3溶液,产生白色沉淀,过滤,向沉淀中加入过量硝酸,沉淀部分溶解,并产生气体。由以上实验判断:(1)该溶液中肯定存在的离子有
(2)加入硝酸银溶液涉及的反应的离子方程式是
Ⅱ.根据下表信息,解答有关问题。
| 氯气(Cl2) | KMnO4 | PbO2 |
| 有刺激性气味,呈黄绿色,有毒气体 | 易溶于水,溶液呈紫红色,可用于杀菌消毒;酸性下高锰酸钾被还原为Mn2+ | Pb的最高化合价为+4,其稳定化合价为+2,难溶于水,灰色固体 |
①在配制酸性KMnO4溶液时,不能用盐酸,原因是
②KMnO4、H2O2、PbO2的氧化性由强到弱的顺序为
③写出滴加适量H2O2发生反应的离子方程式并用单线桥标出电子转移
(4)根据上述反应能否比较Cl2与H2O2的氧化性强弱?
您最近一年使用:0次
7 . 《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫磺涂木片顶端分许,名曰发烛。”《资治通鉴》中记载:“陈宣帝太建九年,齐后妃贫苦,至以卖烛为业。”文中的发烛就是原始的火柴。

 在工业中用作制造火柴头的氧化剂。
在工业中用作制造火柴头的氧化剂。
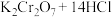 (浓)
(浓)
(1)__________ (填元素名称)元素被氧化,__________ (填化学式,下同)是氧化剂。
(2)__________ 是氧化产物,__________ 发生氧化反应。
(3)参加反应的盐酸,表现了__________ 性质(填“还原性”“氧化性”或“酸性”);
147g 参加反应时,被氧化的
参加反应时,被氧化的 为
为__________ g
(4)用单线桥表示出该反应电子转移的方向和数目__________ 。

 在工业中用作制造火柴头的氧化剂。
在工业中用作制造火柴头的氧化剂。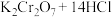 (浓)
(浓)
(1)
(2)
(3)参加反应的盐酸,表现了
147g
 参加反应时,被氧化的
参加反应时,被氧化的 为
为(4)用单线桥表示出该反应电子转移的方向和数目
您最近一年使用:0次
2023-11-02更新
|
34次组卷
|
2卷引用:四川省泸州市泸县第五中学2023-2024学年高一上学期12月月考化学试题
名校
8 . 硫和硒(34Se)位于同一主族,均是重要的非金属元素。
(1)含+4价硫的化合物有SO2、H2SO3和X等。若X属于钠盐,X的化学式为___________ 。
(2)生成SO2并检验性质
已知:FeCl3溶液呈酸性。
①ⅰ中发生反应的化学反应方程式为___________ 。
②ⅱ中现象说明SO2具有___________ 作用。
③将SO2通入FeCl3溶液中,发生的离子反应方程式为___________ 。
④证明发生了反应,可通过证明反应物被消耗,或者验证有新物质生成。某同学欲通过检验生成物离子的存在证明SO2和FeCl3溶液发生了反应,请帮他将检验方法补充完整:
实验结束后,取少量ⅲ中溶液于试管中___________ 。
(3)以工业硒为原料制备高纯硒时的主要物质转化如图。
工业硒(Se) SeO2
SeO2 H2SeO3
H2SeO3 Se
Se 高纯硒
高纯硒
①下列说法正确的是___________ (填字母序号)。
a.过程ⅰ中硒被还原 b.硒原子的最外层有6个电子
c.SeO2属于酸性氧化物 d.硒元素的非金属性强于硫元素的非金属性
②过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2.理论上,过程ⅰ消耗的O2与过程ⅲ消耗的N2H4·nH2O的物质的量之比为___________ (工业硒中杂质与O2的反应可忽略)。
(1)含+4价硫的化合物有SO2、H2SO3和X等。若X属于钠盐,X的化学式为
(2)生成SO2并检验性质
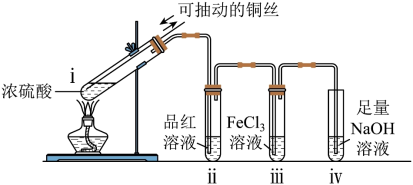
已知:FeCl3溶液呈酸性。
①ⅰ中发生反应的化学反应方程式为
②ⅱ中现象说明SO2具有
③将SO2通入FeCl3溶液中,发生的离子反应方程式为
④证明发生了反应,可通过证明反应物被消耗,或者验证有新物质生成。某同学欲通过检验生成物离子的存在证明SO2和FeCl3溶液发生了反应,请帮他将检验方法补充完整:
实验结束后,取少量ⅲ中溶液于试管中
(3)以工业硒为原料制备高纯硒时的主要物质转化如图。
工业硒(Se)
 SeO2
SeO2 H2SeO3
H2SeO3 Se
Se 高纯硒
高纯硒①下列说法正确的是
a.过程ⅰ中硒被还原 b.硒原子的最外层有6个电子
c.SeO2属于酸性氧化物 d.硒元素的非金属性强于硫元素的非金属性
②过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2.理论上,过程ⅰ消耗的O2与过程ⅲ消耗的N2H4·nH2O的物质的量之比为
您最近一年使用:0次
2023-10-01更新
|
96次组卷
|
2卷引用:四川省南充市嘉陵第一中学2022-2023学年高一下学期3月月考化学试题
名校
9 . 肼( )是我国导弹和运载火箭中广泛使用的液体燃料之一,具有较强的还原性。某实验小组拟用
)是我国导弹和运载火箭中广泛使用的液体燃料之一,具有较强的还原性。某实验小组拟用 和NaClO溶液反应制备肼,装置如图所示(夹持装置未画出)。
和NaClO溶液反应制备肼,装置如图所示(夹持装置未画出)。

(1)装置A中制备 的化学方程式为
的化学方程式为___________________________________ 。
(2)装置B中长颈漏斗的作用是_______________ ;仪器C中盛放的试剂为___________ 。
(3) 的电子式为
的电子式为__________________ ,装置B中制备 的化学方程式为
的化学方程式为___________________ ;
(4)由于反应放热,通常把B装置放于温度较低的水浴中,目的是______________ ;实验时,先打开A中的分液漏斗活塞得到饱和氨水后,再打开D中的漏斗活塞的原因是_____________________ 。
(5)测定产品中 的质量分数
的质量分数
取装置B中的溶液4.00g,并调节为弱酸性,加水配成500mL溶液,从中取25.00mL溶液与0.2000mol/L的 溶液反应(只有
溶液反应(只有 参与反应,其他物质不反应),反应过程中有无污染性的气体生成,消耗
参与反应,其他物质不反应),反应过程中有无污染性的气体生成,消耗 溶液的体积为20.00mL,则该产品中
溶液的体积为20.00mL,则该产品中 的质量分数为
的质量分数为___________ %。
 )是我国导弹和运载火箭中广泛使用的液体燃料之一,具有较强的还原性。某实验小组拟用
)是我国导弹和运载火箭中广泛使用的液体燃料之一,具有较强的还原性。某实验小组拟用 和NaClO溶液反应制备肼,装置如图所示(夹持装置未画出)。
和NaClO溶液反应制备肼,装置如图所示(夹持装置未画出)。
(1)装置A中制备
 的化学方程式为
的化学方程式为(2)装置B中长颈漏斗的作用是
(3)
 的电子式为
的电子式为 的化学方程式为
的化学方程式为(4)由于反应放热,通常把B装置放于温度较低的水浴中,目的是
(5)测定产品中
 的质量分数
的质量分数取装置B中的溶液4.00g,并调节为弱酸性,加水配成500mL溶液,从中取25.00mL溶液与0.2000mol/L的
 溶液反应(只有
溶液反应(只有 参与反应,其他物质不反应),反应过程中有无污染性的气体生成,消耗
参与反应,其他物质不反应),反应过程中有无污染性的气体生成,消耗 溶液的体积为20.00mL,则该产品中
溶液的体积为20.00mL,则该产品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]俗称莫尔盐,是一种常见的补血剂,石室中学2023届的同学们分小组制取了莫尔盐晶体并对其热分解产物进行了探究。
I.莫尔盐晶体的制备
(1)用如图1的装置制备FeSO4。

①废铁屑需要先进行碱煮,目的是_______ 。
②加入的废铁屑需过量,除废铁屑不纯外,主要原因是_______ 。
③用离子方程式解释C中所盛试剂的作用:_______ 。
(2)反应结束后趁热过滤,向滤液中加入H2SO4调节pH在1~2,迅速加入一定质量的(NH4)2SO4固体,在70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出莫尔盐晶体。乙醇的作用为_______ 。
II.莫尔盐晶体热分解产物探究
查阅文献得知:莫尔盐隔绝空气加热至500℃时可完全分解,产物复杂。
[提出猜想]
(3)莫尔盐晶体受热分解,同学们认为分解产物可能有以下几种情况:
A.FeO、NH3、SO3、H2O
B.FeO、NH3、SO2、H2O
C.Fe2O3、NH3、SO3、H2O
D.FeO、N2、SO2、H2O
E.Fe2O3、NH3、SO3、SO2、H2O
F.Fe2O3、NH3、SO3、SO2、N2、H2O
经认真分析,通过推理即可确定猜想_______ (填序号)不成立。
[实验探究]
(4)甲组同学设计如图2的实验装置,观察到A中固体逐渐变为红棕色,B中白色固体变蓝,D中酚酞溶液变红色,由此可知莫尔盐分解的产物中有H2O、_______ (填化学式)。进一步实验证实A中充分反应后的固体残留物中不含FeO,操作方法及实验现象:取少量A中固体残留物于试管中,_______ 。

(5)乙组选用甲组实验中的装置A和图3所示的装置进行实验,验证了莫尔盐分解的产物中还有SO2、SO3和N2。

①乙组同学的实验装置中,依次连接的合理顺序(用装置的字母表示)为A、E、_______ 。(各装置中试剂均足量)
②实验中,准确称量莫尔盐7.8400g,加热充分反应后,测得装置A中固体残留物的质量为1.6000g,装置F中生成白色沉淀的质量为5.8250g。写出该条件下莫尔盐受热分解的化学方程式:_______ 。(已M[(NH4)2Fe(SO4)2•6H2O]=392g•mol-1,分解产物被充分吸收,不考虑其损失)
I.莫尔盐晶体的制备
(1)用如图1的装置制备FeSO4。

①废铁屑需要先进行碱煮,目的是
②加入的废铁屑需过量,除废铁屑不纯外,主要原因是
③用离子方程式解释C中所盛试剂的作用:
(2)反应结束后趁热过滤,向滤液中加入H2SO4调节pH在1~2,迅速加入一定质量的(NH4)2SO4固体,在70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出莫尔盐晶体。乙醇的作用为
II.莫尔盐晶体热分解产物探究
查阅文献得知:莫尔盐隔绝空气加热至500℃时可完全分解,产物复杂。
[提出猜想]
(3)莫尔盐晶体受热分解,同学们认为分解产物可能有以下几种情况:
A.FeO、NH3、SO3、H2O
B.FeO、NH3、SO2、H2O
C.Fe2O3、NH3、SO3、H2O
D.FeO、N2、SO2、H2O
E.Fe2O3、NH3、SO3、SO2、H2O
F.Fe2O3、NH3、SO3、SO2、N2、H2O
经认真分析,通过推理即可确定猜想
[实验探究]
(4)甲组同学设计如图2的实验装置,观察到A中固体逐渐变为红棕色,B中白色固体变蓝,D中酚酞溶液变红色,由此可知莫尔盐分解的产物中有H2O、

(5)乙组选用甲组实验中的装置A和图3所示的装置进行实验,验证了莫尔盐分解的产物中还有SO2、SO3和N2。

①乙组同学的实验装置中,依次连接的合理顺序(用装置的字母表示)为A、E、
②实验中,准确称量莫尔盐7.8400g,加热充分反应后,测得装置A中固体残留物的质量为1.6000g,装置F中生成白色沉淀的质量为5.8250g。写出该条件下莫尔盐受热分解的化学方程式:
您最近一年使用:0次
2023-06-20更新
|
594次组卷
|
4卷引用:四川省成都市石室中学2023届高三下学期高考适应性考试(一)理科综合化学试题
四川省成都市石室中学2023届高三下学期高考适应性考试(一)理科综合化学试题四川省乐山沫若中学2023-2024学年高三上学期第一次月考理科综合化学试题(已下线)第17讲实验方案的设计与评价(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)



