解题方法
1 . 铁及其化合物与生产、生活息息相关。回答下列问题:
(1) 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是___________ 。
(2)印刷电路板的制作原理是用足量的 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:___________ 。
(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用CO将其还原的化学方程式为___________ 。
(4)某废料铁泥的主要成分为 、FeO、Fe和杂质(杂质不与硫酸反应)。现取wg废料铁泥提取
、FeO、Fe和杂质(杂质不与硫酸反应)。现取wg废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:

①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、___________ 、___________ 。
②能检验溶液A中含有 的试剂是
的试剂是___________ (填字母)。
A.铁粉 B.酸性 溶液 C.KSCN溶液
溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为___________ 。
(1)
 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是(2)印刷电路板的制作原理是用足量的
 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用CO将其还原的化学方程式为
(4)某废料铁泥的主要成分为
 、FeO、Fe和杂质(杂质不与硫酸反应)。现取wg废料铁泥提取
、FeO、Fe和杂质(杂质不与硫酸反应)。现取wg废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、
②能检验溶液A中含有
 的试剂是
的试剂是A.铁粉 B.酸性
 溶液 C.KSCN溶液
溶液 C.KSCN溶液③步骤Ⅱ中发生反应的离子方程式为
您最近一年使用:0次
名校
2 . 价类二维图是学习元素及其化合物知识的重要模型,如图为氯元素的价类二维图。
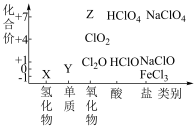
(1)根据图中信息写出Z的化学式________ 。
(2) 的电离方程式为
的电离方程式为________ 。
(3) 既有氧化性又有还原性,结合上图说明理由
既有氧化性又有还原性,结合上图说明理由_______ 。
(4)在 的反应中,当参与反应的Y为1mol时,转移电子的物质的量为
的反应中,当参与反应的Y为1mol时,转移电子的物质的量为____ mol。
(5)写出由X转化为Y的离子方程式___________ 。

(1)根据图中信息写出Z的化学式
(2)
 的电离方程式为
的电离方程式为(3)
 既有氧化性又有还原性,结合上图说明理由
既有氧化性又有还原性,结合上图说明理由(4)在
 的反应中,当参与反应的Y为1mol时,转移电子的物质的量为
的反应中,当参与反应的Y为1mol时,转移电子的物质的量为(5)写出由X转化为Y的离子方程式
您最近一年使用:0次
3 . 取一定量的酸性硫酸锰( )溶液,向其中依次加入下列物质,对应现象如表所示:
)溶液,向其中依次加入下列物质,对应现象如表所示:
已知:
①金属铋(Bi)价态为+3时较稳定, 在水溶液中以离子形态存在;
在水溶液中以离子形态存在;
②铋酸钠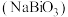 无色,难溶于水,高锰酸根离子呈紫红色;
无色,难溶于水,高锰酸根离子呈紫红色;
③淀粉溶液遇 变为蓝色。
变为蓝色。
(1)写出步骤1中的离子反应方程式______________ ,氧化产物为_____________ (填离子符号)。
(2)写出步骤2中的离子反应方程式________________________________ 。
(3)步骤2中过量的 可以氧化
可以氧化 ,则步骤3中现象A为
,则步骤3中现象A为________________________ 。
(4)由上述现象可知, 、
、 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为______________ 。
(5)根据上述结论,推断下列离子反应可能发生且书写正确的是__________ (填字母)。
a.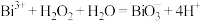
b.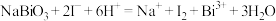
c.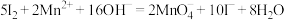
d.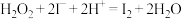
 )溶液,向其中依次加入下列物质,对应现象如表所示:
)溶液,向其中依次加入下列物质,对应现象如表所示:| 步骤1 | 步骤2 | 步骤3 | |
| 依次加入 | 适量 | 过量的 溶液 溶液 | 适量 -淀粉混合液 -淀粉混合液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 现象A |
①金属铋(Bi)价态为+3时较稳定,
 在水溶液中以离子形态存在;
在水溶液中以离子形态存在;②铋酸钠
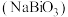 无色,难溶于水,高锰酸根离子呈紫红色;
无色,难溶于水,高锰酸根离子呈紫红色;③淀粉溶液遇
 变为蓝色。
变为蓝色。(1)写出步骤1中的离子反应方程式
(2)写出步骤2中的离子反应方程式
(3)步骤2中过量的
 可以氧化
可以氧化 ,则步骤3中现象A为
,则步骤3中现象A为(4)由上述现象可知,
 、
、 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(5)根据上述结论,推断下列离子反应可能发生且书写正确的是
a.
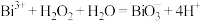
b.
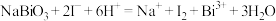
c.
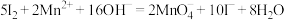
d.
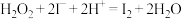
您最近一年使用:0次
名校
解题方法
4 . 高铁酸钾(① )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于②水而形成暗紫色溶液,静置后会分解并释放出大量③氧气,同时生成④
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于②水而形成暗紫色溶液,静置后会分解并释放出大量③氧气,同时生成④ 和⑤
和⑤ 胶体。高铁酸钾具有强的氧化能力,可以处理池塘塘底泥生成的⑥
胶体。高铁酸钾具有强的氧化能力,可以处理池塘塘底泥生成的⑥ 、⑦
、⑦ 等。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法。
等。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法。
(1)在上述有标号①~⑦的物质中,属于盐的是___________ (填标号,下同),属于酸的是___________ ,属于非电解质的是___________ 。
(2)电解法:通过电解得到 ,然后向
,然后向 溶液中加入适量饱和
溶液中加入适量饱和 溶液,沉淀结晶,过滤得到较纯的
溶液,沉淀结晶,过滤得到较纯的 固体。“沉淀结晶”的离子方程式为
固体。“沉淀结晶”的离子方程式为___________ 。
(3)次氯酸盐氧化法:
①请用双线桥法标出电子转移方向与数目___________ 。
②上述反应中的还原剂为________ ,氧化性:
_________ (填“大于”或“小于”) 。
。
(4)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠: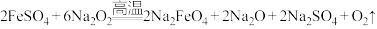 ,再加入适量饱和
,再加入适量饱和 溶液反应得到
溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是 和水反应:
和水反应:_________ (用化学方程式表示)。
 )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于②水而形成暗紫色溶液,静置后会分解并释放出大量③氧气,同时生成④
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于②水而形成暗紫色溶液,静置后会分解并释放出大量③氧气,同时生成④ 和⑤
和⑤ 胶体。高铁酸钾具有强的氧化能力,可以处理池塘塘底泥生成的⑥
胶体。高铁酸钾具有强的氧化能力,可以处理池塘塘底泥生成的⑥ 、⑦
、⑦ 等。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法。
等。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法。(1)在上述有标号①~⑦的物质中,属于盐的是
(2)电解法:通过电解得到
 ,然后向
,然后向 溶液中加入适量饱和
溶液中加入适量饱和 溶液,沉淀结晶,过滤得到较纯的
溶液,沉淀结晶,过滤得到较纯的 固体。“沉淀结晶”的离子方程式为
固体。“沉淀结晶”的离子方程式为(3)次氯酸盐氧化法:

①请用双线桥法标出电子转移方向与数目
②上述反应中的还原剂为

 。
。(4)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
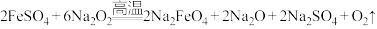 ,再加入适量饱和
,再加入适量饱和 溶液反应得到
溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是 和水反应:
和水反应:
您最近一年使用:0次
2023-11-16更新
|
93次组卷
|
3卷引用:陕西省渭南市2023-2024学年高一上学期11月期中化学试题
名校
5 . 亚硝酸钠( )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。
(1)根据 的化合价,推测
的化合价,推测 具有
具有___________ (填“氧化性”、“还原性”或“氧化性和还原性”)。
(2)该化学兴趣小组为了验证推测的结果,设计实验操作如下表所示,请完善表格中的实验现象和结论(已知I₂遇淀粉变蓝)。
(3)通过上述实验可知, 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为___________ 。
(4)上述实验②中所发生的化学反应的离子方程式为:___________ 。
(5)根据我国食品添加剂使用标准,亚硝酸钠在肉制品中的最大使用量是0.15g/kg;则200g15%的 溶液最少可生产的肉制品的质量为
溶液最少可生产的肉制品的质量为___________ kg。
 )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。(1)根据
 的化合价,推测
的化合价,推测 具有
具有(2)该化学兴趣小组为了验证推测的结果,设计实验操作如下表所示,请完善表格中的实验现象和结论(已知I₂遇淀粉变蓝)。
| 实验 | 实验操作及现象或结果 | 结论 |
| ① | 取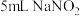 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 |  具有 具有 |
| ② | 取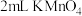 溶液(先酸化好)于试管中,滴加足量的 溶液(先酸化好)于试管中,滴加足量的 溶液,可观察到的实验现象为 溶液,可观察到的实验现象为 |  具有还原性 具有还原性 |
| ③ |  固体与70%硫酸反应生成了NO和 固体与70%硫酸反应生成了NO和 两种气体 两种气体 |  具有 具有 |
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(4)上述实验②中所发生的化学反应的离子方程式为:
(5)根据我国食品添加剂使用标准,亚硝酸钠在肉制品中的最大使用量是0.15g/kg;则200g15%的
 溶液最少可生产的肉制品的质量为
溶液最少可生产的肉制品的质量为
您最近一年使用:0次
6 . 图示分析是学习化学重要手段之一,学习过程中常遇到各种“数形结合”问题。结合所给图示回答相关问题:
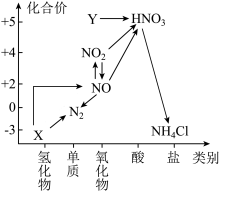
(1)从元素化合价和物质类别两个维度学习、研究物质的性质及转化,是一种行之有效的方法。氮元素的“价-类”二维图的信息如图所示:
①写出X的电子式___________ ,Y的化学式___________
②图中关于 转化为
转化为 的反应过程,下列说法不正确的是
的反应过程,下列说法不正确的是___________
a.氮元素的化合价不发生变化
b.该转化过程中, 一定既是氧化剂,又是还原剂
一定既是氧化剂,又是还原剂
c.若用 与
与 反应制取
反应制取 ,可生成另一种产物
,可生成另一种产物
(2)研究表明硝酸与金属反应时,最容易生成亚硝酸( ,弱酸),然后才转化成
,弱酸),然后才转化成 ,如果溶液中存在更强的氧化剂,如过氧化氧,可以将新产生的亚硝酸再氧化成硝酸。下图为金属在不同浓度的
,如果溶液中存在更强的氧化剂,如过氧化氧,可以将新产生的亚硝酸再氧化成硝酸。下图为金属在不同浓度的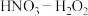 混合溶液中的溶解速率和生成
混合溶液中的溶解速率和生成 的体积
的体积 的变化示意图,请回答下列问题:
的变化示意图,请回答下列问题:

①最佳溶解金属的混合溶液中 的质量分数为
的质量分数为___________ ,理由是___________ 。
②过氧化氢与亚硝酸反应的化学方程式为___________
(3)在焙烧 的过程中,固体质量的变化值(纵坐标)随温度变化的曲线如图所示,
的过程中,固体质量的变化值(纵坐标)随温度变化的曲线如图所示, 时,剩余固体物质的化学式为
时,剩余固体物质的化学式为___________ 。


(1)从元素化合价和物质类别两个维度学习、研究物质的性质及转化,是一种行之有效的方法。氮元素的“价-类”二维图的信息如图所示:
①写出X的电子式
②图中关于
 转化为
转化为 的反应过程,下列说法不正确的是
的反应过程,下列说法不正确的是a.氮元素的化合价不发生变化
b.该转化过程中,
 一定既是氧化剂,又是还原剂
一定既是氧化剂,又是还原剂c.若用
 与
与 反应制取
反应制取 ,可生成另一种产物
,可生成另一种产物
(2)研究表明硝酸与金属反应时,最容易生成亚硝酸(
 ,弱酸),然后才转化成
,弱酸),然后才转化成 ,如果溶液中存在更强的氧化剂,如过氧化氧,可以将新产生的亚硝酸再氧化成硝酸。下图为金属在不同浓度的
,如果溶液中存在更强的氧化剂,如过氧化氧,可以将新产生的亚硝酸再氧化成硝酸。下图为金属在不同浓度的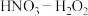 混合溶液中的溶解速率和生成
混合溶液中的溶解速率和生成 的体积
的体积 的变化示意图,请回答下列问题:
的变化示意图,请回答下列问题:
①最佳溶解金属的混合溶液中
 的质量分数为
的质量分数为②过氧化氢与亚硝酸反应的化学方程式为
(3)在焙烧
 的过程中,固体质量的变化值(纵坐标)随温度变化的曲线如图所示,
的过程中,固体质量的变化值(纵坐标)随温度变化的曲线如图所示, 时,剩余固体物质的化学式为
时,剩余固体物质的化学式为
您最近一年使用:0次
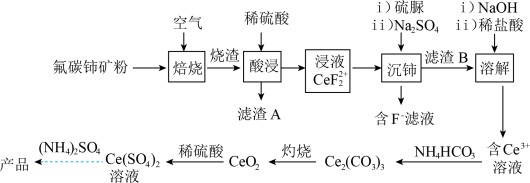
7 . 硫酸铈铵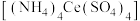 是分析化学常用的滴定剂。以氟碳铈矿(含
是分析化学常用的滴定剂。以氟碳铈矿(含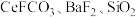 等)为原料制备硫酸铈铵的工艺流程如图所示。
等)为原料制备硫酸铈铵的工艺流程如图所示。
已知部分信息如下:
① 在空气中易被氧化为
在空气中易被氧化为 。
。
②“沉铈”时发生的反应之一: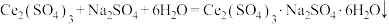 。
。
回答下列问题:
(1) 中铈元素的化合价为
中铈元素的化合价为___________ 价,“滤渣A”的主要成分是___________ (填化学式)。
(2)“焙烧”中常采用高压空气、逆流操作(空气从焙烧炉下部通入,矿粉从中上部加入),这样操作的目的是___________ 。
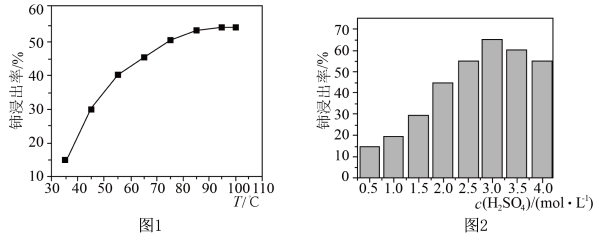
(3)“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是___________ 。
(4)“沉铈”时,硫脲作___________ (填“还原剂”或“氧化剂”)。
(5)“溶解”时,为防止 被氧化,可以加入
被氧化,可以加入___________ (填标号)。
a. b.
b. c.
c.
(6)在有机合成中,硫酸铈铵常作合成丙酸异戊酯的催化剂。其他条件相同,酯产率与催化剂质量的关系如图3所示。工业生产中,选择的最佳催化剂质量为___________ g。

(7)测定产品纯度。称取 产品溶于水,配制成
产品溶于水,配制成 溶液,准确量取
溶液,准确量取 配制的溶液于锥形瓶中,加入
配制的溶液于锥形瓶中,加入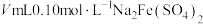 溶液,恰好完全反应。该产品纯度为
溶液,恰好完全反应。该产品纯度为___________  。(杂质不参与反应,滴定反应为
。(杂质不参与反应,滴定反应为 )
)
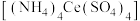 是分析化学常用的滴定剂。以氟碳铈矿(含
是分析化学常用的滴定剂。以氟碳铈矿(含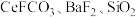 等)为原料制备硫酸铈铵的工艺流程如图所示。
等)为原料制备硫酸铈铵的工艺流程如图所示。
已知部分信息如下:
①
 在空气中易被氧化为
在空气中易被氧化为 。
。②“沉铈”时发生的反应之一:
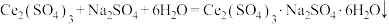 。
。回答下列问题:
(1)
 中铈元素的化合价为
中铈元素的化合价为(2)“焙烧”中常采用高压空气、逆流操作(空气从焙烧炉下部通入,矿粉从中上部加入),这样操作的目的是
(3)“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是

(4)“沉铈”时,硫脲作
(5)“溶解”时,为防止
 被氧化,可以加入
被氧化,可以加入a.
 b.
b. c.
c.
(6)在有机合成中,硫酸铈铵常作合成丙酸异戊酯的催化剂。其他条件相同,酯产率与催化剂质量的关系如图3所示。工业生产中,选择的最佳催化剂质量为

(7)测定产品纯度。称取
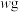 产品溶于水,配制成
产品溶于水,配制成 溶液,准确量取
溶液,准确量取 配制的溶液于锥形瓶中,加入
配制的溶液于锥形瓶中,加入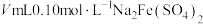 溶液,恰好完全反应。该产品纯度为
溶液,恰好完全反应。该产品纯度为 。(杂质不参与反应,滴定反应为
。(杂质不参与反应,滴定反应为 )
)
您最近一年使用:0次
名校
解题方法
8 . 磷化铝、磷化锌、磷化钙与水反应产生高毒的 气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以
气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以 计)的含量低于
计)的含量低于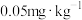 时算合格。可用以下方法测定粮食中残留的磷化物含量:
时算合格。可用以下方法测定粮食中残留的磷化物含量:

操作流程:安装吸收装置→ 的产生与吸收→转移
的产生与吸收→转移 吸收溶液→亚硫酸钠标准溶液滴定。
吸收溶液→亚硫酸钠标准溶液滴定。
实验装置:C中盛100g原粮,D中盛有20.00mL 溶液(
溶液( 酸化)。
酸化)。
请回答下列问题:
(1)仪器E的名称是___________ ;以磷化钙为例,写出磷化钙与水反应生成的除 之外另一产物的电子式:
之外另一产物的电子式:___________ 。
(2)通入空气的作用是___________ 。焦性没食子酸可以吸收氧化性气体,若没有B装置,则实验中测得的 含量将
含量将___________ (填“偏低”、“偏高”或“不变”)。
(3)D中 被氧化成磷酸,所发生反应的离子方程式为
被氧化成磷酸,所发生反应的离子方程式为___________ 。
(4)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 溶液(已知:
溶液(已知:
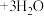 ),消耗
),消耗 标准溶液11.00mL,则该原粮质量
标准溶液11.00mL,则该原粮质量___________ (填“合格”或“不合格”)。
 气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以
气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以 计)的含量低于
计)的含量低于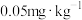 时算合格。可用以下方法测定粮食中残留的磷化物含量:
时算合格。可用以下方法测定粮食中残留的磷化物含量:
操作流程:安装吸收装置→
 的产生与吸收→转移
的产生与吸收→转移 吸收溶液→亚硫酸钠标准溶液滴定。
吸收溶液→亚硫酸钠标准溶液滴定。实验装置:C中盛100g原粮,D中盛有20.00mL
 溶液(
溶液( 酸化)。
酸化)。请回答下列问题:
(1)仪器E的名称是
 之外另一产物的电子式:
之外另一产物的电子式:(2)通入空气的作用是
 含量将
含量将(3)D中
 被氧化成磷酸,所发生反应的离子方程式为
被氧化成磷酸,所发生反应的离子方程式为(4)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用
 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 溶液(已知:
溶液(已知:
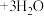 ),消耗
),消耗 标准溶液11.00mL,则该原粮质量
标准溶液11.00mL,则该原粮质量
您最近一年使用:0次
2023-09-17更新
|
146次组卷
|
2卷引用:陕西省商洛市山阳中学2022-2023学年高三一模考试化学试题
9 . 工业上以黄铁矿( )为原料制备硫酸的工艺流程如图所示:
)为原料制备硫酸的工艺流程如图所示:

已知:① ;
;
②从接触室出来的混合气体中含有 、
、 、
、 、
、 等气体。
等气体。
回答下列问题:
(1)为了加快黄铁矿在沸腾炉中的反应速率,可采取的措施为___________ (写1种即可), 中硫元素的化合价为
中硫元素的化合价为___________ 价。
(2)对于反应 :
:
① 在生活中的一种用途为
在生活中的一种用途为___________ (写1种即可)。
②该反应中每转移 电子,此时生成的
电子,此时生成的 的体积为
的体积为___________ L(标准状况下)。
③将该反应生成的 通入酸性高锰酸钾溶液褪色,体现了
通入酸性高锰酸钾溶液褪色,体现了 的
的___________ (填“还原”、“氧化”或“酸”)性,发生该反应的离子方程式为___________ 。
(3)从接触室出来的气体可用 溶液吸收,写出
溶液吸收,写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:___________ 。
 )为原料制备硫酸的工艺流程如图所示:
)为原料制备硫酸的工艺流程如图所示:
已知:①
 ;
;②从接触室出来的混合气体中含有
 、
、 、
、 、
、 等气体。
等气体。回答下列问题:
(1)为了加快黄铁矿在沸腾炉中的反应速率,可采取的措施为
 中硫元素的化合价为
中硫元素的化合价为(2)对于反应
 :
:①
 在生活中的一种用途为
在生活中的一种用途为②该反应中每转移
 电子,此时生成的
电子,此时生成的 的体积为
的体积为③将该反应生成的
 通入酸性高锰酸钾溶液褪色,体现了
通入酸性高锰酸钾溶液褪色,体现了 的
的(3)从接触室出来的气体可用
 溶液吸收,写出
溶液吸收,写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:
您最近一年使用:0次
名校
解题方法
10 . 高铁酸钠(Na2FeO4)是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取Na2FeO4并回收金属Cu,工艺流程如下:
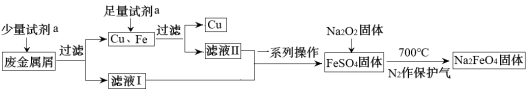
(1)试剂a为___________ (填化学式)。
(2)证明滤液I中无Fe3+的实验方法是___________ ;用离子方程式解释滤液I不含有Fe3+可能的原因___________ 。
(3)流程中Na2O2不可暴露在空气中时间过长,原因是___________ (用化学方程式表示)。
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中___________ 作还原剂;每生成1mol Na2FeO4转移的电子数为___________ 。
(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为____________ ,配平该化学方程式,化学计量数从左至右分别为___________ 。
(6)用Na2FeO4代替Cl2处理饮用水的优点是___________ (只答一条即可)。

(1)试剂a为
(2)证明滤液I中无Fe3+的实验方法是
(3)流程中Na2O2不可暴露在空气中时间过长,原因是
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2
 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为
(6)用Na2FeO4代替Cl2处理饮用水的优点是
您最近一年使用:0次



