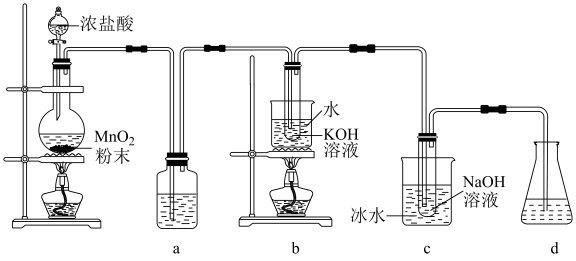
1 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
(1)盛放MnO2粉末的仪器名称是________ ,a中的试剂为________ 。
(2)b中采用的加热方式是_________ ,c中化学反应的离子方程式是________________ ,采用冰水浴冷却的目的是____________ 。
(3)d的作用是________ ,可选用试剂________ (填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,________ ,__________ ,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____ 色。可知该条件下KClO3的氧化能力____ NaClO(填“大于”或“小于”)。
(1)盛放MnO2粉末的仪器名称是
(2)b中采用的加热方式是
(3)d的作用是
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显
您最近一年使用:0次
2020-07-09更新
|
20999次组卷
|
54卷引用:海南省华中师范大学海南附属中学2021届高三上学期第四次月考化学试题
海南省华中师范大学海南附属中学2021届高三上学期第四次月考化学试题海南省东方市琼西中学2021-2022学年高三上学期第一次月考化学试题2020年全国统一考试化学试题(新课标Ⅲ)(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编重庆市渝北区、合川区、江北区等七区2019-2020学年高一下学期期末联考化学试题黑龙江省牡丹江市第一高级中学2021届高三上学期开学考试化学试题四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题福建省永安市第三中学2021届高三10月月考化学试题吉林省汪清县第六中学2021届高三第三次月考模拟化学试题(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测湖南省岳阳市平江县第一中学2021届高三上学期10月月考化学试题黑龙江省哈尔滨市第三十二中学2021届高三上学期期末考试化学试题 (已下线)专题10 化学实验基础——备战2021年高考化学纠错笔记广西壮族自治区蒙山中学2020-2021学年高一下学期第一次月考化学试题辽宁省大连市普兰店区第二中学2020-2021学年高二4月阶段性测试化学试题(已下线)重点7 探究型实验综合题-2021年高考化学专练【热点·重点·难点】(已下线)押全国卷理综第26题 实验综合-备战2021年高考化学临考题号押题(课标全国卷)(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向11 氯及其化合物-备战2022年高考化学一轮复习考点微专题河北省沧州市第一中学2020-2021学年高一下学期开学测试化学试题山东省枣庄市第三中学2022届高三第一次月考化学试题(已下线)专题3 从海水中获得的化学物质(章末培优)-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)山西省太原市第五十六中学2021-2022学年高三上学期第一次月考化学试题2020年全国卷Ⅲ化学真题变式题广西梧州市2020-2021学年高一下学期第一次月考化学试题(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习陕西省西北农林科技大学附属中学2021-2022学年高一上学期期末考试化学试题(已下线)押全国卷理综第26题 实验综合-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点10 实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)西藏自治区拉萨中学2021-2022学年高一下学期期中考试理综化学试题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)(已下线)第06练 以气体的实验室制备突破非金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)微专题20 新型含氯化合物的制备与性质探究(ClO2、NOCl等)-备战2023年高考化学一轮复习考点微专题(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题云南省临沧市民族中学2022-2023学年高二上学期第二次月考化学试题(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题湖南省郴州市汝城县第一中学2022-2023学年高一上学期期中考试化学试题陕西省渭南市渭南中学2021-2022学年高三上学期9月月考化学试题陕西省渭南市集才中学老城分校2021-2022学年高三上学期期末考试化学试题(已下线)专题七 非金属元素及其化合物-实战高考·二轮复习核心突破湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第四章 非金属及其化合物 第18讲 氯及其化合物(已下线)专题03 化学实验专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)02 物质性质、实验原理的探究型综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)专题19 实验综合题黑龙江省齐齐哈尔中学2022-2023学年高三上学期11月期中考试化学试题河南省郸城三中2023-2024学年高一上学期期中考试化学试卷 河南省唐河县鸿唐高级中学2023-2024学年高三上学期10月月考化学试题甘肃省平凉市泾川县第三中学2023-2024学年高三上学期第3次月考化学试题甘肃省天水市甘谷县第三中学2023-2024学年高一上学期12月第三次月考化学试卷04 2024年苏州震泽高二3月月考
解题方法
2 . 氯气是一种重要的化工原料,下图为实验室制取氯气的装置。

请回答下列问题:
(1)仪器E中收集的Cl2颜色是_______ ;
(2)仪器A的名称是_______ ;
(3)仪器C中的饱和食盐水可以除去Cl2中混有的杂质气体是_______ (填化学式):
(4)自来水厂使用ClO2给自来水进行消毒,ClO2中氯元素的化合价是_______ 。
(5)在新冠疫情防控期间,公共场所要求勤通风勤消毒,其中84消毒液经常用于公共场所消毒,制取84消毒液发生化学反应的离子方程式是_______ 。

请回答下列问题:
(1)仪器E中收集的Cl2颜色是
(2)仪器A的名称是
(3)仪器C中的饱和食盐水可以除去Cl2中混有的杂质气体是
(4)自来水厂使用ClO2给自来水进行消毒,ClO2中氯元素的化合价是
(5)在新冠疫情防控期间,公共场所要求勤通风勤消毒,其中84消毒液经常用于公共场所消毒,制取84消毒液发生化学反应的离子方程式是
您最近一年使用:0次
2022-05-05更新
|
796次组卷
|
2卷引用:海南省海口市枫叶国际学校2022-2023学年高一上学期期中检测化学试题
解题方法
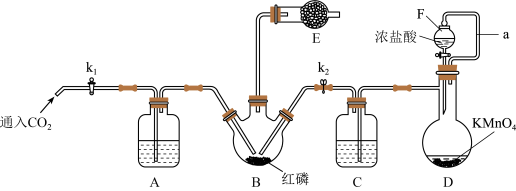
3 .  是重要的化工原料,实验室利用红磷制取粗
是重要的化工原料,实验室利用红磷制取粗 的装置如图,夹持装置略去,已知红磷与少量
的装置如图,夹持装置略去,已知红磷与少量 反应生成
反应生成 ,与过量
,与过量 反应生成
反应生成 ,
, 遇水会强烈水解生成
遇水会强烈水解生成 ,遇
,遇 会生成
会生成 。
。 、
、 的熔沸点见下表。
的熔沸点见下表。
回答下列问题:
(1)A、C中所盛试剂为___________ ,装置中a的作用是___________ 。
(2)实验时,检查装置气密性后,先打开 通入
通入 ,再迅速加入红磷,通入
,再迅速加入红磷,通入 的作用是
的作用是___________ 。
(3)装置B中的反应需要65~70℃,较适合的加热方式为___________ ,装置E中盛有碱石灰,其作用为___________ 。
(4)实验结束后,装置B中制得的 粗产品中常混有
粗产品中常混有 、
、 等。加入过量红磷加热可将
等。加入过量红磷加热可将 转化为
转化为 ,通过
,通过___________ (填操作名称),即可得到较纯净的 产品。
产品。
(5) 纯度测定
纯度测定
步骤I:取ag上述所得 产品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成250mL溶液;
产品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成250mL溶液;
步骤Ⅱ:取25.00mL上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入 mL
mL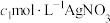 溶液(过量),使
溶液(过量),使 完全转化为AgCl沉淀(
完全转化为AgCl沉淀( 可溶于稀硝酸);
可溶于稀硝酸);
步骤Ⅲ:加入少硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用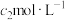 KSCN溶液滴定过量的
KSCN溶液滴定过量的 溶液(
溶液( 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去 mLKSCN溶液。
mLKSCN溶液。
步骤I中发生反应的化学方程式为___________ ,产品中 的质量分数为
的质量分数为___________ %,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会___________ (填“偏大”“偏小”或“不变”)。
 是重要的化工原料,实验室利用红磷制取粗
是重要的化工原料,实验室利用红磷制取粗 的装置如图,夹持装置略去,已知红磷与少量
的装置如图,夹持装置略去,已知红磷与少量 反应生成
反应生成 ,与过量
,与过量 反应生成
反应生成 ,
, 遇水会强烈水解生成
遇水会强烈水解生成 ,遇
,遇 会生成
会生成 。
。
 、
、 的熔沸点见下表。
的熔沸点见下表。| 物质 | 熔点/℃ | 沸点/℃ |
 | 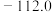 | 75.5 |
 | 1.3 | 105.3 |
(1)A、C中所盛试剂为
(2)实验时,检查装置气密性后,先打开
 通入
通入 ,再迅速加入红磷,通入
,再迅速加入红磷,通入 的作用是
的作用是(3)装置B中的反应需要65~70℃,较适合的加热方式为
(4)实验结束后,装置B中制得的
 粗产品中常混有
粗产品中常混有 、
、 等。加入过量红磷加热可将
等。加入过量红磷加热可将 转化为
转化为 ,通过
,通过 产品。
产品。(5)
 纯度测定
纯度测定步骤I:取ag上述所得
 产品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成250mL溶液;
产品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成250mL溶液;步骤Ⅱ:取25.00mL上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
 mL
mL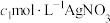 溶液(过量),使
溶液(过量),使 完全转化为AgCl沉淀(
完全转化为AgCl沉淀( 可溶于稀硝酸);
可溶于稀硝酸);步骤Ⅲ:加入少硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用
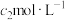 KSCN溶液滴定过量的
KSCN溶液滴定过量的 溶液(
溶液( 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去 mLKSCN溶液。
mLKSCN溶液。步骤I中发生反应的化学方程式为
 的质量分数为
的质量分数为 的含量会
的含量会
您最近一年使用:0次
4 . 三氯化硼可用于制造高纯硼、有机合成的催化剂、硅酸盐分解时的助熔剂、可对钢铁进行硼化,半导体的掺杂源,合金精制中作为除氧剂、氮化物和碳化物的添加剂,还可用来制造氮化硼及硼烷化合物等,是一种重要的化工原料。查阅资料可知:①BCl3的熔点为−107.3 ℃,沸点为12.5 ℃,与水(包括水蒸气)能剧烈反应生成硼酸(H3BO3)和白雾;②硼与铝的性质相似,与强酸或强碱溶液均能反应,与HCl气体也能反应。据此,某同学设计了三氯化硼的制备装置如图。请回答下列问题:
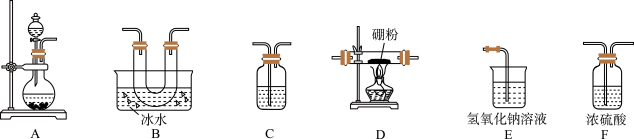
(1)A装置可用漂白粉固体与浓盐酸反应制氯气,反应的化学方程式为_______
(2)为了完成三氯化硼的制备,装置从左到右的连接顺序为_______ (根据需要,仪器可不用,也可重复使用)。
(3)装置C的作用为_______

(1)A装置可用漂白粉固体与浓盐酸反应制氯气,反应的化学方程式为
(2)为了完成三氯化硼的制备,装置从左到右的连接顺序为
(3)装置C的作用为
您最近一年使用:0次
5 . 二氯化硫(SCl2)是一种重要的化工原料,被广泛用作有机合成的氯化剂和润滑油的处理剂。工业上的合成方法之一是:
①2S(s)+Cl2(g) S2Cl2(l);
S2Cl2(l);
②S2Cl2(l)+Cl2(g)=2SCl2(l)。
已知相关物质的性质如下表所示:
某小组在实验室模拟工业制备二氯化硫时设计了如下实验装置(部分夹持装置已略去)。

回答下列问题:
(1)装置A中发生反应的离子方程式为_______ 。
(2)C装置中盛放的试剂为_______ ,D装置中X仪器的名称是_______ 。
(3)第①步反应需要控制温度在100~110℃,温度不宜过高的原因是_______ ,判断第①步反应已经进行完全的实验现象是_______ 。
(4)第②步反应后得到SCl2粗品,从混合物中分离出产品的操作方法是_______ 。
(5)装置E的作用是_______ 。
(6)向水中加入几滴制备的SCl2,可观察到淡黄色浑浊,并有刺激性气味的无色气体逸出,根据实验现象,写出SCl2与水反应的化学方程式_______ 。
①2S(s)+Cl2(g)
 S2Cl2(l);
S2Cl2(l);②S2Cl2(l)+Cl2(g)=2SCl2(l)。
已知相关物质的性质如下表所示:
| 物质 | 外观 | 熔点/℃ | 沸点/℃ | 水溶性 |
| S | 淡黄色粉末 | 118 | 445 | 不溶 |
| S2Cl2 | 黄红色液体 | -80 | 138(分解) | 剧烈反应 |
| SCl2 | 红棕色液体 | -78 | 60 | 剧烈反应 |

回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)C装置中盛放的试剂为
(3)第①步反应需要控制温度在100~110℃,温度不宜过高的原因是
(4)第②步反应后得到SCl2粗品,从混合物中分离出产品的操作方法是
(5)装置E的作用是
(6)向水中加入几滴制备的SCl2,可观察到淡黄色浑浊,并有刺激性气味的无色气体逸出,根据实验现象,写出SCl2与水反应的化学方程式
您最近一年使用:0次
名校
6 . 次氯酸钠是家庭洗涤剂中的含“氯”漂白剂。某兴趣小组用如图所示装置(在冰水浴条件下)制备 溶液并对产品成分含量进行测定。
溶液并对产品成分含量进行测定。
回答下列问题:
Ⅰ.制备 溶液:
溶液:

(1)仪器X的名称为___________ ;按照气流方向,装置正确的连接顺序为a___________ (填小写字母)。
(2)装置A中反应的化学方程式为___________ 。
(3)装置E中各生成物的物质的量和溶液的温度随时间的变化如图所示,若发现装置E中温度计的温度上升过快,可能导致产物中存在杂质,为避免此状况,装置A应进行的操作为___________ 。

Ⅱ.测定产品中有效成分含量:
①取10mL仪器X中的产品于碘量瓶中,加入50mL蒸馏水、足量KI溶液和稀硫酸,迅速盖紧瓶塞后,在暗处静置5min;
②加入指示剂,用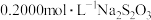 标准溶液滴定至终点,平行测定三次,
标准溶液滴定至终点,平行测定三次, 标准溶液的平均用量为48.00mL。(已知:
标准溶液的平均用量为48.00mL。(已知: ,杂质不参与反应)
,杂质不参与反应)
(4)步骤①中反应的离子方程式为___________ 。
(5)步骤②中加入的指示剂为___________ ;达到滴定终点时的判断依据为___________ 。
(6)产品中
___________  。
。
 溶液并对产品成分含量进行测定。
溶液并对产品成分含量进行测定。回答下列问题:
Ⅰ.制备
 溶液:
溶液:
(1)仪器X的名称为
(2)装置A中反应的化学方程式为
(3)装置E中各生成物的物质的量和溶液的温度随时间的变化如图所示,若发现装置E中温度计的温度上升过快,可能导致产物中存在杂质,为避免此状况,装置A应进行的操作为

Ⅱ.测定产品中有效成分含量:
①取10mL仪器X中的产品于碘量瓶中,加入50mL蒸馏水、足量KI溶液和稀硫酸,迅速盖紧瓶塞后,在暗处静置5min;
②加入指示剂,用
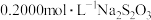 标准溶液滴定至终点,平行测定三次,
标准溶液滴定至终点,平行测定三次, 标准溶液的平均用量为48.00mL。(已知:
标准溶液的平均用量为48.00mL。(已知: ,杂质不参与反应)
,杂质不参与反应)(4)步骤①中反应的离子方程式为
(5)步骤②中加入的指示剂为
(6)产品中

 。
。
您最近一年使用:0次
2023-05-11更新
|
512次组卷
|
6卷引用:海南省农垦中学2023-2024学年高二上学期第一次月考化学试题
海南省农垦中学2023-2024学年高二上学期第一次月考化学试题湖南省衡阳市名校协作体2023届高三第三次模拟考试化学试题湖北省2023届高三5月联考化学试题陕西省西安市长安区第一中学2022-2023学年高二下学期期末考试化学试题(已下线)考点巩固卷13 化学实验基础(二)(3个考点30题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)实验综合题
名校
解题方法
7 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。
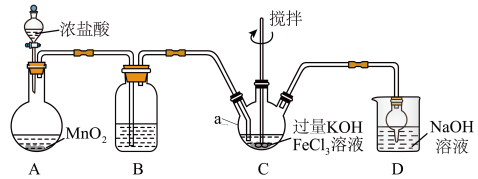
(1)仪器a的名称是______ ,装置B中除杂质所用试剂是______ ,装置D的作用是_____ 。
(2)A中发生反应的化学方程式为______ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是______ 。
(4)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和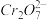 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的化学方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(4)写出C中总反应的离子方程式:
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和
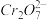 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
2023-01-11更新
|
703次组卷
|
8卷引用:实验综合题
(已下线)实验综合题2019年四川省绵阳市高三第二次诊断性考试理综化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题辽宁省实验中学、东北育才学校、鞍山一中、大连八中、大连二十四中五校联考2021-2022学年高三上学期期末联考化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题十八化学实验综合题解题策略
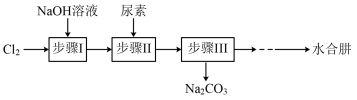
8 . 水合肼(N2H4·H2O)是一种用途广泛的化工原料,在空气中会与CO2反应产生烟雾。利用尿素制备N2H4·H2O的实验流程如下图所示:
回答下列问题:
(1)步骤I制备NaClO溶液的离子方程式为___________ ;该反应为放热反应,为避免副反应发生,需控制温度不高于40°C,可采取的措施是___________ (任答一条)。
(2)由步骤II和步骤III获得N2H4·H2O的装置如图1所示,反应原理为: CO(NH2)2+ 2NaOH+ NaClO= Na2CO3+ N2H4·H2O +NaCl
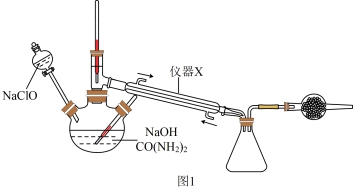
①仪器X的名称为___________ ,干燥管中盛装的试剂为___________ 。
②N2H4的电子式为___________ 。
③反应过程中,如果分液漏斗中溶液滴速过快,部分N2H4·H2O与NaClO反应产生大量氮气,该化学反应方程式为___________ 。
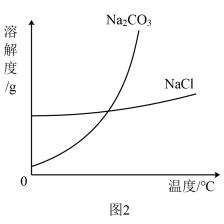
④蒸馏获得水合肼粗品后,剩余溶液进一步处理还可获得副产品NaCl和Na2CO3,NaCl和Na2CO3的溶解度曲线如图2所示。获得NaCl粗品的操作是___________ 、___________ 、洗涤、干燥。
(3)馏分中水合肼含量的测定方法:称取馏分0.2500g,加入适量NaHCO3固体,配成溶液,用0.1500 mol·L-1的标准I2溶液滴定。
①滴定时,碘的标准溶液盛放在___________ (填 “酸式”或“碱式”)滴定管中。
②实验测得消耗I2溶液的体积为18.00 mL,馏分中N2H4·H2O的质量分数为___________ 。 (已知:N2H4·H2O +2I2=N2 ↑+ 4HI+H2O)

回答下列问题:
(1)步骤I制备NaClO溶液的离子方程式为
(2)由步骤II和步骤III获得N2H4·H2O的装置如图1所示,反应原理为: CO(NH2)2+ 2NaOH+ NaClO= Na2CO3+ N2H4·H2O +NaCl

①仪器X的名称为
②N2H4的电子式为
③反应过程中,如果分液漏斗中溶液滴速过快,部分N2H4·H2O与NaClO反应产生大量氮气,该化学反应方程式为
④蒸馏获得水合肼粗品后,剩余溶液进一步处理还可获得副产品NaCl和Na2CO3,NaCl和Na2CO3的溶解度曲线如图2所示。获得NaCl粗品的操作是

(3)馏分中水合肼含量的测定方法:称取馏分0.2500g,加入适量NaHCO3固体,配成溶液,用0.1500 mol·L-1的标准I2溶液滴定。
①滴定时,碘的标准溶液盛放在
②实验测得消耗I2溶液的体积为18.00 mL,馏分中N2H4·H2O的质量分数为
您最近一年使用:0次
解题方法
9 . MnO2可用于制取Cl2和O2。实验室制取纯净、干燥的Cl2的装置如下图。
(1)实验室制取Cl2的化学方程式是___________ 。
(2)除杂装置①中的试剂是___________ 。
(3)实验室加热MnO2和KClO3的固体混合物制取O2,同时生成KCl,反应中MnO2是催化剂,化学方程式是___________ 。
(4)在(3)中得到的O2有刺激性气味,推测反应生成了Cl2,反应的化学方程式:2KClO3 + 2MnO2 K2Mn2O8 + Cl2↑+ O2↑。每生成1 mol O2,该反应共转移电子
K2Mn2O8 + Cl2↑+ O2↑。每生成1 mol O2,该反应共转移电子___________ mol。

(1)实验室制取Cl2的化学方程式是
(2)除杂装置①中的试剂是
(3)实验室加热MnO2和KClO3的固体混合物制取O2,同时生成KCl,反应中MnO2是催化剂,化学方程式是
(4)在(3)中得到的O2有刺激性气味,推测反应生成了Cl2,反应的化学方程式:2KClO3 + 2MnO2
 K2Mn2O8 + Cl2↑+ O2↑。每生成1 mol O2,该反应共转移电子
K2Mn2O8 + Cl2↑+ O2↑。每生成1 mol O2,该反应共转移电子
您最近一年使用:0次
2022-01-14更新
|
531次组卷
|
3卷引用:海南省三亚华侨学校(南新校区)2021-2022学年高一下学期开学摸底考试化学试题
名校
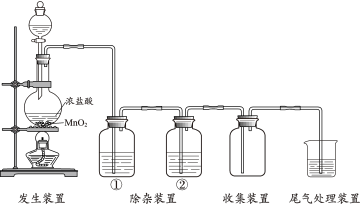
10 . 二氯异氰尿酸钠C3N3O3Cl2Na为白色固体,难溶于冷水,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂。实验室用如图所示装置制备二氯异氰尿酸钠(夹持装置已略去)。请回答下列问题:

已知:实验原理为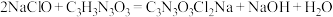
(1)仪器a的名称为___________ ,装置A中的药品是___________ (填化学式),装置C中的试剂为___________ (填化学式)。
(2)实验发现装置B中NaOH溶液的利用率较低,改进方法是___________ 。
(3)①当装置B内出现___________ 现象时,打开装置B的活塞加入C3H3N3O3溶液,在反应过程中仍不断通入Cl2的目的是___________ 。
②实验过程中B的温度必须保持为7℃~12℃,pH值控制在6.5-8.5的范围,则该实验的受热方式是___________ (填“冷水浴”或“热水浴”)。若温度过高,pH过低,会生成NCl3和CO2等,写出该反应的化学方程式___________ 。
(4)二氯异氰尿酸钠缓慢水解产生HClO消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的氯元素含量。准确称取a g样品,用容量瓶配成250 mL溶液;取25.00 mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min;用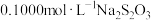 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液v mL。
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液v mL。
已知:实验检测原理为: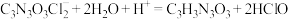


①该样品的氯元素含量___________ %(用含a、v的代数式表示)
②下列操作会导致样品的氯元素含量测定值偏低的是___________ (填标号)。
a.盛装Na2S2O3标准溶液的滴定管未润洗
b.滴定管在滴定前有气泡,滴定后无气泡
c.碘量瓶中加入的稀硫酸偏少

已知:实验原理为
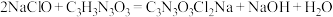
(1)仪器a的名称为
(2)实验发现装置B中NaOH溶液的利用率较低,改进方法是
(3)①当装置B内出现
②实验过程中B的温度必须保持为7℃~12℃,pH值控制在6.5-8.5的范围,则该实验的受热方式是
(4)二氯异氰尿酸钠缓慢水解产生HClO消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的氯元素含量。准确称取a g样品,用容量瓶配成250 mL溶液;取25.00 mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min;用
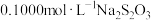 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液v mL。
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液v mL。已知:实验检测原理为:
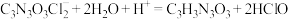


①该样品的氯元素含量
②下列操作会导致样品的氯元素含量测定值偏低的是
a.盛装Na2S2O3标准溶液的滴定管未润洗
b.滴定管在滴定前有气泡,滴定后无气泡
c.碘量瓶中加入的稀硫酸偏少
您最近一年使用:0次
2022-01-22更新
|
517次组卷
|
6卷引用:实验综合题
(已下线)实验综合题辽宁省营口市普通高中2021-2022学年高三上学期期末教学质量检测化学试题(已下线)二轮拔高卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)(已下线)回归教材重难点10 综合实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点10 实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)湖北省枣阳市第一中学2021-2022学年高三下学期2月月考化学试题



