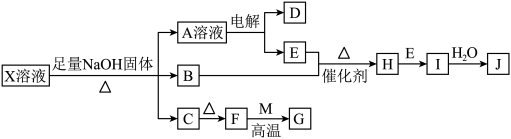
1 . 某些无机物的转化关系(部分反应物和生成物未列出)如图。已知常温常压下,M为有毒气体,D为密度最小的气体,单质E为无色气体,F可用作红色颜料,G是常见的金属单质,气体B能使湿润的红色石蕊试纸变蓝。___________ ;X溶液可以确定含有的阳离子为___________ (填离子符号)。
(2)检验NaOH中阳离子的方法为___________ 。
(3)写出B和E反应生成H的化学方程式:___________ 。
(4)B和H在一定条件下反应能生成一种单质,则该反应中氧化产物与还原产物的物质的量之比为___________ 。
(5)F→G在工业上的应用为___________ 。
(6)过量G和J的稀溶液反应的离子方程式为___________ ,该反应中J体现的性质为___________ 。
(2)检验NaOH中阳离子的方法为
(3)写出B和E反应生成H的化学方程式:
(4)B和H在一定条件下反应能生成一种单质,则该反应中氧化产物与还原产物的物质的量之比为
(5)F→G在工业上的应用为
(6)过量G和J的稀溶液反应的离子方程式为
您最近一年使用:0次
名校
解题方法
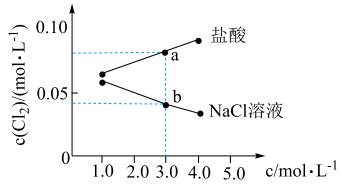
2 . 在相同温度和压强下,研究 分别在不同浓度的盐酸和
分别在不同浓度的盐酸和 溶液中的溶解度(用溶解
溶液中的溶解度(用溶解 的物质的量浓度表示)变化如下图所示。
的物质的量浓度表示)变化如下图所示。
已知 溶解存在下列过程:
溶解存在下列过程:
①
②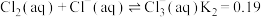
③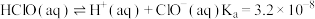
下列说法错误的是
 分别在不同浓度的盐酸和
分别在不同浓度的盐酸和 溶液中的溶解度(用溶解
溶液中的溶解度(用溶解 的物质的量浓度表示)变化如下图所示。
的物质的量浓度表示)变化如下图所示。
已知
 溶解存在下列过程:
溶解存在下列过程:①

②
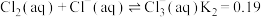
③
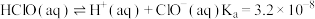
下列说法错误的是
A. 点时, 点时,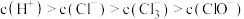 |
B.b点时,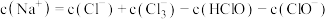 |
C.当 溶液浓度介于 溶液浓度介于 之间时,随 之间时,随 溶液浓度增大, 溶液浓度增大, 溶解度减小,溶液中 溶解度减小,溶液中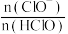 减小 减小 |
D.当盐酸浓度介于 之间时, 之间时, 溶解度随盐酸浓度增大而增大,可能的原因是反应①被抑制,反应②为主要反应从而促进 溶解度随盐酸浓度增大而增大,可能的原因是反应①被抑制,反应②为主要反应从而促进 溶解 溶解 |
您最近一年使用:0次
名校
3 . 向含有Fe2+、I-、Br- (已知还原性 >Fe2+>Br-)的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。
>Fe2+>Br-)的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。
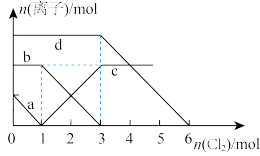
(1)图中线a、b、c、d依次代表___________ 、___________ 、___________ 、___________ 离子的物质的量变化情况(填写离子符号)。
(2)当通入2mol 时,溶液中发生反应的离子方程式是:
时,溶液中发生反应的离子方程式是:___________ 。
(3)原溶液中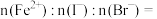
___________ 。
(4)在通入氯气的总反应中,下列离子方程式中不可能的发生的是___________
 >Fe2+>Br-)的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。
>Fe2+>Br-)的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。
(1)图中线a、b、c、d依次代表
(2)当通入2mol
 时,溶液中发生反应的离子方程式是:
时,溶液中发生反应的离子方程式是:(3)原溶液中
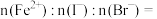
(4)在通入氯气的总反应中,下列离子方程式中不可能的发生的是___________
A. |
B. |
C.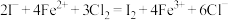 |
D. |
您最近一年使用:0次
名校
4 . 某学习小组通过如图所示装置探究 与
与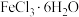 ,能否反应产生
,能否反应产生 ,已知
,已知 的升华温度为315℃。下列相关说法
的升华温度为315℃。下列相关说法不正确 的是
 与
与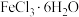 ,能否反应产生
,能否反应产生 ,已知
,已知 的升华温度为315℃。下列相关说法
的升华温度为315℃。下列相关说法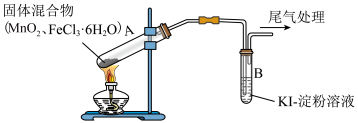
| 操作 | 现象 |
| 点燃酒精灯,加热 | ⅰ.试管A中部分固体溶解,上方出现白雾 ⅱ.稍后,试管A中产生黄色气体,管壁附着黄色液滴 ⅲ.试管B中溶液变蓝 |
A.为保证实验的严谨性,应另设置加热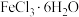 的对照实验 的对照实验 |
B.黄色气体中可能含有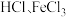 和 和 |
C.为进一步确认黄色气体是否含有 ,应在A、B间增加盛有 ,应在A、B间增加盛有 饱和溶液的洗气瓶 饱和溶液的洗气瓶 |
D.若实验证明A中产生 ,综合上述现象,试管A中的固体产物可能为 ,综合上述现象,试管A中的固体产物可能为 |
您最近一年使用:0次
2024-01-27更新
|
301次组卷
|
3卷引用: 北京市首都师范大学附属中学2023-2024学年高三上学期1月阶段化学练习
名校
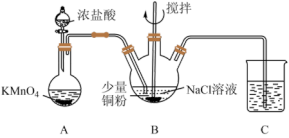
5 . CuCl在工业生产中有着重要应用。利用以下装置制备CuCl并测定产品纯度。
已知:Ⅰ.CuCl是白色固体,不溶于水和乙醇,在潮湿空气中可被迅速氧化。
Ⅱ.Na2[CuCl3]为无色溶液,加水稀释即析出CuCl白色固体。
(1)制取Cl2:该实验条件下可以替代装置A中KMnO4的物质有___________ (填标号,下同),
A.KClO3B.MnO2C.浓硫酸
为吸收Cl2尾气,装置C中不可选用试剂是___________ 。
A.Na2S溶液B.饱和食盐水C.FeCl2溶液D.饱和石灰水
(2)制备CuCl:打开分液漏斗旋塞与搅拌器,装置B中依次发生反应的离子方程式为:
①Cu+Cl2=Cu2++2Cl-
②___________
③CuCl+2Cl- [CuCl3]2-
[CuCl3]2-
观察到___________ 时停止反应。将B中溶液倾入盛有蒸馏水的烧杯中,立即得到白色CuCl沉淀,抽滤得CuCl粗品。下述有关抽滤的描述错误的是___________ (填标号)。
A.过滤速率快,且得到的固体较为干燥
B.布氏漏斗的颈口斜面应与吸滤瓶支管口相对
C.结束时先关闭抽气系统再拔吸滤瓶的橡胶管
D.不宜过滤胶状沉淀或颗粒较小的沉淀
(3)洗涤CuCl:洗涤时最好用95%的乙醇洗涤滤饼3~4次,其目的是___________ 。
(4)CuCl纯度测定:称取所制备的氯化亚铜成品3.00g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用0.0200mol·L-1的K2Cr2O7溶液滴定至终点,再重复滴定2次,三次平均消耗K2Cr2O7溶液20.00mL(滴定过程中Cr2O 转化为Cr3+,Cl-不反应),则成品中CuCl的纯度为
转化为Cr3+,Cl-不反应),则成品中CuCl的纯度为___________ %。滴定时盛装K2Cr2O7溶液的仪器名称是___________ 。
已知:Ⅰ.CuCl是白色固体,不溶于水和乙醇,在潮湿空气中可被迅速氧化。
Ⅱ.Na2[CuCl3]为无色溶液,加水稀释即析出CuCl白色固体。
(1)制取Cl2:该实验条件下可以替代装置A中KMnO4的物质有
A.KClO3B.MnO2C.浓硫酸
为吸收Cl2尾气,装置C中不可选用试剂是
A.Na2S溶液B.饱和食盐水C.FeCl2溶液D.饱和石灰水
(2)制备CuCl:打开分液漏斗旋塞与搅拌器,装置B中依次发生反应的离子方程式为:
①Cu+Cl2=Cu2++2Cl-
②
③CuCl+2Cl-
 [CuCl3]2-
[CuCl3]2-观察到
A.过滤速率快,且得到的固体较为干燥
B.布氏漏斗的颈口斜面应与吸滤瓶支管口相对
C.结束时先关闭抽气系统再拔吸滤瓶的橡胶管
D.不宜过滤胶状沉淀或颗粒较小的沉淀
(3)洗涤CuCl:洗涤时最好用95%的乙醇洗涤滤饼3~4次,其目的是
(4)CuCl纯度测定:称取所制备的氯化亚铜成品3.00g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用0.0200mol·L-1的K2Cr2O7溶液滴定至终点,再重复滴定2次,三次平均消耗K2Cr2O7溶液20.00mL(滴定过程中Cr2O
 转化为Cr3+,Cl-不反应),则成品中CuCl的纯度为
转化为Cr3+,Cl-不反应),则成品中CuCl的纯度为
您最近一年使用:0次
2024-01-02更新
|
582次组卷
|
4卷引用:山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题
山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题山东省名校联考2024届高三上学期模拟预测化学试题(已下线)T17-实验综合题(已下线)化学(山东卷02)-2024年高考押题预测卷
名校
6 . 某小组同学探究不同条件下氯气与二价锰化合物的反应,实验记录如下:
资料:水溶液中, 为棕黑色沉淀,
为棕黑色沉淀, 为白色沉淀,
为白色沉淀, 呈绿色;浓碱性条件下,
呈绿色;浓碱性条件下, 可被
可被 还原为
还原为 ;
; 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
下列说法错误的是
| 序号 | 实验方案 | 实验现象 | |
| 实验装置 | 试剂a | ||
| ① | 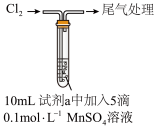 | 水 | 产生黑色沉淀,放置后不发生变化 |
| ② | 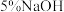 溶液 溶液 | 产生黑色沉淀,放置后溶液变为紫色,仍有沉淀 | |
| ③ | 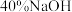 溶液 溶液 | 产生黑色沉淀,放置后溶液变为紫色,仍有沉淀 | |
| ④ | 取③中放置后的悬浊液 ,加入 ,加入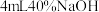 溶液 溶液 | 溶液紫色迅速变为绿色,且绿色缓慢加深 | |
| ⑤ | 取③中放置后的悬浊液 ,加入 ,加入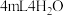 | 溶液紫色缓慢加深 | |
 为棕黑色沉淀,
为棕黑色沉淀, 为白色沉淀,
为白色沉淀, 呈绿色;浓碱性条件下,
呈绿色;浓碱性条件下, 可被
可被 还原为
还原为 ;
; 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。下列说法错误的是
| A.对比实验①和②可知,碱性环境中,二价锰化合物可被氧化到更高价态 |
B.④中溶液紫色迅速变为绿色的可能原因是: 被 被 还原生成 还原生成 |
C.⑤中紫色缓慢加深的主要原因是: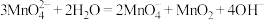 |
D.③中未得到绿色溶液,可能是因为 被氧化为 被氧化为 的反应速率快于 的反应速率快于 被还原为 被还原为 的反应速率 的反应速率 |
您最近一年使用:0次
2023-12-12更新
|
260次组卷
|
2卷引用:安徽省示范高中培优联盟2023-2024学年高二上学期冬季联赛化学试题
名校
7 . 下列方案设计、现象和结论正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 比较 和 和 溶液碱性强弱 溶液碱性强弱 | 同温下,向等浓度的两溶液中分别滴入3滴酚酞,观察现象 | 观察到红色较深的是 ,说明碱性 ,说明碱性 大于 大于 |
| B | 区别 和 和 固体 固体 | 分别在两支试管中分别加入少量待检验固体,再加入几滴水,用温度计测定变化 | 温度升高的是 固体,温度降低的是 固体,温度降低的是 固体 固体 |
| C | 检验纯碱溶液中是否存在NaCl | 向待测液中加入 溶液,观察现象 溶液,观察现象 | 若有白色沉淀产生,则溶液中存在 |
| D | 检验 是否有漂白性 是否有漂白性 | 将干燥的 通入装有潮湿有色布条的广口瓶中,观察现象 通入装有潮湿有色布条的广口瓶中,观察现象 | 若有色布条颜色逐渐褪去,则说明 有漂白性 有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-29更新
|
581次组卷
|
3卷引用:浙江省杭州市富阳区实验中学2023-2024学年高一上学期12月月考化学试卷
名校
8 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速反应产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为______ 。
②除杂装置B中盛装的试剂为________ 。
③C中有多个反应发生,其中生成高铁酸钾的化学反应方程式为_________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
I.由方案I中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl—氧化,该离子还可能由反应_______ 产生(用离子方程式表示)。
II.方案II可证明K2FeO4氧化Cl—,用KOH溶液洗涤的目的是排除______ 的干扰。
②根据K2FeO4的制备实验得出:氧化性Cl2______ FeO (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速反应产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为
②除杂装置B中盛装的试剂为
③C中有多个反应发生,其中生成高铁酸钾的化学反应方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。 |
II.方案II可证明K2FeO4氧化Cl—,用KOH溶液洗涤的目的是排除
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
名校
9 . 完成下列问题。
Ⅰ.配制 0.50 mol/L NaOH 溶液用于中和热测定。
(1)若实验中大约要使用 245 mL NaOH 溶液, 至少需要称量 NaOH 固体__________ g。
(2)从下图中选择称量 NaOH 固体所需要的仪器(填字母):________ 。
(3)取 50 mL NaOH 溶液和 30 mL 硫酸溶液进行中和热测定实验实验数值结果小于 57.3 kJ/mol,产生偏差的原因可能是(填字母)___________ 。
a.实验装置保温、隔热效果差
b.配制 0.50 mol/L NaOH 溶液时俯视刻度线读数
c.分多次把 NaOH 溶液倒入盛有硫酸的小烧杯中
d.用温度计测定 NaOH 溶液起始温度后直接测定 H2SO4溶液的温度
e.用量筒量取 NaOH 溶液的体积时仰视读数
Ⅱ.铋酸钠(NaBiO3)广泛应用于制药业,其粉末呈浅黄色,不溶于冷水,遇沸水或酸则迅速分解。某同学设计如下实验,利用白色且难溶于水的 Bi(OH)3在 NaOH 溶液中与 Cl2反应制备 NaBiO3, 并探究其应用,请按要求回答下列问题:
NaBiO3的制备,实验装置如下图(加热和夹持仪器已略去)
(4)A装置制备的气体是___________ ;B 装置的作用是___________ ;补全上图 D装置图___________ (并标注试剂名称)。
(5)C 中反应的离子方程式为___________ ,当观察到现象为___________ 时,可以初步判断 C 中反应已经完成。
(6)反应完成后,处理装置 A 烧瓶中残留气体需进行的操作:___________ ;为从装置 C中获得尽可能多的产品,需进行的操作:___________ 、过滤、洗涤、干燥。
(7)铋酸钠的应用,检测 Mn2+。向含有 Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是___________ 。
Ⅰ.配制 0.50 mol/L NaOH 溶液用于中和热测定。
(1)若实验中大约要使用 245 mL NaOH 溶液, 至少需要称量 NaOH 固体
(2)从下图中选择称量 NaOH 固体所需要的仪器(填字母):
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
a.实验装置保温、隔热效果差
b.配制 0.50 mol/L NaOH 溶液时俯视刻度线读数
c.分多次把 NaOH 溶液倒入盛有硫酸的小烧杯中
d.用温度计测定 NaOH 溶液起始温度后直接测定 H2SO4溶液的温度
e.用量筒量取 NaOH 溶液的体积时仰视读数
Ⅱ.铋酸钠(NaBiO3)广泛应用于制药业,其粉末呈浅黄色,不溶于冷水,遇沸水或酸则迅速分解。某同学设计如下实验,利用白色且难溶于水的 Bi(OH)3在 NaOH 溶液中与 Cl2反应制备 NaBiO3, 并探究其应用,请按要求回答下列问题:
NaBiO3的制备,实验装置如下图(加热和夹持仪器已略去)

(4)A装置制备的气体是
(5)C 中反应的离子方程式为
(6)反应完成后,处理装置 A 烧瓶中残留气体需进行的操作:
(7)铋酸钠的应用,检测 Mn2+。向含有 Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是
您最近一年使用:0次
名校
解题方法
10 . 硫代硫酸钠Na2S2O3(又名大苏打),化学性质不稳定,在酸性溶液中会分解成 和S;还具有较强的还原性,可做脱氯剂等。实验室用
和S;还具有较强的还原性,可做脱氯剂等。实验室用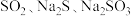 ,为原料通过如下装置(略去部分夹持仪器)生产硫代硫酸钠。
,为原料通过如下装置(略去部分夹持仪器)生产硫代硫酸钠。
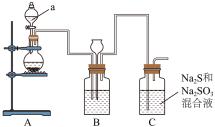
回答下列问题:
(1)仪器a的名称是___________ 。
(2)利用 固体和较浓的硫酸溶液在装置A中制取
固体和较浓的硫酸溶液在装置A中制取 气体,该反应的化学方程式为
气体,该反应的化学方程式为___________ 。
(3)装置B盛装的液体最好为___________ 。
①饱和 溶液②饱和
溶液②饱和 溶液③饱和
溶液③饱和 溶液④浓硫酸
溶液④浓硫酸
(4)该实验装置有不完善的地方,以下装置中能完善该实验的是___________。(下列装置中试剂均为 溶液)
溶液)
(5)停止反应后,烧瓶C中的溶液经___________ (填写操作名称)、洗涤、干燥可得到Na2S2O3·5H2O晶体;产品中可能含有Na2SO3、Na2SO4等杂质,为检验产品中是否含有Na2SO4,下列试剂及添加顺序正确的时___________ 。(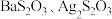 均为白色沉淀)
均为白色沉淀)
A.先加入稀硝酸再加入 溶液 B.先加入稀盐酸再加入
溶液 B.先加入稀盐酸再加入 溶液
溶液
C.先加入 溶液,再加入硫酸溶液 D.先加入稀盐酸再加入
溶液,再加入硫酸溶液 D.先加入稀盐酸再加入 溶液
溶液
(6) 做脱氯剂可除去自来水中残留的
做脱氯剂可除去自来水中残留的 ,从而消除
,从而消除 对环境的污染,写出该原理的离子反应方程式
对环境的污染,写出该原理的离子反应方程式___________ 。
 和S;还具有较强的还原性,可做脱氯剂等。实验室用
和S;还具有较强的还原性,可做脱氯剂等。实验室用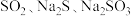 ,为原料通过如下装置(略去部分夹持仪器)生产硫代硫酸钠。
,为原料通过如下装置(略去部分夹持仪器)生产硫代硫酸钠。
回答下列问题:
(1)仪器a的名称是
(2)利用
 固体和较浓的硫酸溶液在装置A中制取
固体和较浓的硫酸溶液在装置A中制取 气体,该反应的化学方程式为
气体,该反应的化学方程式为(3)装置B盛装的液体最好为
①饱和
 溶液②饱和
溶液②饱和 溶液③饱和
溶液③饱和 溶液④浓硫酸
溶液④浓硫酸(4)该实验装置有不完善的地方,以下装置中能完善该实验的是___________。(下列装置中试剂均为
 溶液)
溶液)A. | B.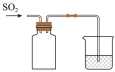 | C.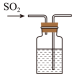 | D.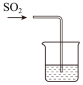 |
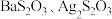 均为白色沉淀)
均为白色沉淀)A.先加入稀硝酸再加入
 溶液 B.先加入稀盐酸再加入
溶液 B.先加入稀盐酸再加入 溶液
溶液C.先加入
 溶液,再加入硫酸溶液 D.先加入稀盐酸再加入
溶液,再加入硫酸溶液 D.先加入稀盐酸再加入 溶液
溶液(6)
 做脱氯剂可除去自来水中残留的
做脱氯剂可除去自来水中残留的 ,从而消除
,从而消除 对环境的污染,写出该原理的离子反应方程式
对环境的污染,写出该原理的离子反应方程式
您最近一年使用:0次



