解题方法
1 . Ⅰ.NaClO是“84”消毒液的有效成分。请回答下列问题:
(1)NaClO中Cl元素的化合价是________ 。
(2)浸泡衣物时加入“84”消毒液,在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:_______________ 。(已知酸性: )
)
(3)若将“84”消毒液与洁厕灵(主要成分是HCl)混合使用,会产生黄绿色的有毒气体,其反应的离子方程式是____________________ 。
Ⅱ. 是一种有毒气体,如果泄漏会造成严重的危害。
是一种有毒气体,如果泄漏会造成严重的危害。
(1)已知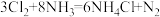 ,化工厂可用浓氨水来检验
,化工厂可用浓氨水来检验 是否泄漏。该反应中被氧化和未被氧化的
是否泄漏。该反应中被氧化和未被氧化的 分子的个数比为
分子的个数比为______________ 。
(2)喷射石灰乳等碱性物质可以减轻少量 泄漏造成的危害。
泄漏造成的危害。 和石灰乳反应的化学方程式是
和石灰乳反应的化学方程式是__________________ 。
(3)实验室常用烧碱溶液吸收 。若将
。若将 通入热的烧碱溶液中,可以得到NaCl、NaClO和
通入热的烧碱溶液中,可以得到NaCl、NaClO和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为15∶2时,混合液中
的个数比为15∶2时,混合液中 和
和 的个数比为
的个数比为_______________ 。
(1)NaClO中Cl元素的化合价是
(2)浸泡衣物时加入“84”消毒液,在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:
 )
)(3)若将“84”消毒液与洁厕灵(主要成分是HCl)混合使用,会产生黄绿色的有毒气体,其反应的离子方程式是
Ⅱ.
 是一种有毒气体,如果泄漏会造成严重的危害。
是一种有毒气体,如果泄漏会造成严重的危害。(1)已知
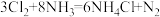 ,化工厂可用浓氨水来检验
,化工厂可用浓氨水来检验 是否泄漏。该反应中被氧化和未被氧化的
是否泄漏。该反应中被氧化和未被氧化的 分子的个数比为
分子的个数比为(2)喷射石灰乳等碱性物质可以减轻少量
 泄漏造成的危害。
泄漏造成的危害。 和石灰乳反应的化学方程式是
和石灰乳反应的化学方程式是(3)实验室常用烧碱溶液吸收
 。若将
。若将 通入热的烧碱溶液中,可以得到NaCl、NaClO和
通入热的烧碱溶液中,可以得到NaCl、NaClO和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为15∶2时,混合液中
的个数比为15∶2时,混合液中 和
和 的个数比为
的个数比为
您最近一年使用:0次
2020-10-02更新
|
987次组卷
|
6卷引用:人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 作业帮
人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 作业帮(已下线)【浙江新东方】34高一必修第一册(苏教2019)专题3 第一单元 氯气及氯的化合物4吉林省吉林市永吉县第四中学2022-2023学年高一上学期期中考试化学试题(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用【定心卷】2.2.1 氯气的性质随堂练习-人教版2023-2024学年必修第一册
2 . 甲型H1N1流感病毒曾在全球广泛传播,给人类健康、社会经济带来了巨大的负面影响。我国采取积极应对措施,使病毒得到了有效的控制,从很大程度上减少了损失,在这里,消毒液功不可没。
(1)生产消毒液是将氯气通入NaOH溶液中,该反应的离子方程式为________ 。
(2)取少量消毒液滴加AgNO3溶液,现象是出现白色沉淀,说明消毒液中有____ 离子(写离子符号),该反应的的离子方程式为____________ 。
(3)消毒液稀释后喷洒在空气中,可以生成具有漂白性的物质,该物质为_________ ;该物质有漂白性是因为它有强的氧化性,但是它也很不稳定,写出它分解反应的化学方程式:_________ 。
(1)生产消毒液是将氯气通入NaOH溶液中,该反应的离子方程式为
(2)取少量消毒液滴加AgNO3溶液,现象是出现白色沉淀,说明消毒液中有
(3)消毒液稀释后喷洒在空气中,可以生成具有漂白性的物质,该物质为
您最近一年使用:0次
19-20高一·浙江·阶段练习
3 . 请回答下列问题。
(1)设NA表示阿伏加德罗常数:
①6.8g熔触的KHSO4中含有___ 个阳离子;
②0.1molNa2O2与水完全反应,转移______ 个电子;
③标准状况下,22.4L氩气含有原子数为____________ ;
④常温常压下,32gO2和O3的混合物含有_____ NA个氧原子。
(2)食盐不慎洒落在天然气的火焰上,观察的现象是________ ,该变化是________ 变化(填“物理”或“化学”)。
(3)清理卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与84消毒液(主要成分是次氯酸钠)而发生氯气中毒事件。请从氧化还原反应的角度分析原因:________________ 。
(4)下列反应可用于检查司机是否酒后开车:2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3(绿色)+3CH3COOH+2K2SO4+( )。方程式中空格内的系数和物质(化学式)为_____ 该反应中氧化产物是___________ ;还原产物是___________ ;反应中生成0.1molCr3+离子,转移的电子总数为________ 个。
(5)由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。现有10mL明胶的水溶液与5mLK2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明 能够透过半透膜
能够透过半透膜___________ 。
(1)设NA表示阿伏加德罗常数:
①6.8g熔触的KHSO4中含有
②0.1molNa2O2与水完全反应,转移
③标准状况下,22.4L氩气含有原子数为
④常温常压下,32gO2和O3的混合物含有
(2)食盐不慎洒落在天然气的火焰上,观察的现象是
(3)清理卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与84消毒液(主要成分是次氯酸钠)而发生氯气中毒事件。请从氧化还原反应的角度分析原因:
(4)下列反应可用于检查司机是否酒后开车:2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3(绿色)+3CH3COOH+2K2SO4+( )。方程式中空格内的系数和物质(化学式)为
(5)由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。现有10mL明胶的水溶液与5mLK2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
 能够透过半透膜
能够透过半透膜
您最近一年使用:0次
4 . Ⅰ、实 验室可以用KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O回答下列问题:
验室可以用KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O回答下列问题:
(1)该反应中被氧化的元素是__________ .
(2)氧化性:KMnO4__________ Cl2(填“>”、“<”或“= ”)
”)
(3)该反应中氧化 剂和氧化产物的物质的量之比为
剂和氧化产物的物质的量之比为__________ .
(4)用双线桥法表示该反应中电子转移的方向和数目:_________
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(5)每生成标准状况下2.24L Cl2,反应中转移电子的物质的量为__________ .
Ⅱ、实验室常用以下方法制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊试液中,可以观察到的现象是:________________ ,请你解释其中的原因 __________________________________________________
(2)为保证实验安全,常用NaOH溶液吸收多余的氯气。写出反应的化学方程式__________________________________ ;
 验室可以用KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O回答下列问题:
验室可以用KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O回答下列问题:(1)该反应中被氧化的元素是
(2)氧化性:KMnO4
 ”)
”)(3)该反应中氧化
 剂和氧化产物的物质的量之比为
剂和氧化产物的物质的量之比为(4)用双线桥法表示该反应中电子转移的方向和数目:
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(5)每生成标准状况下2.24L Cl2,反应中转移电子的物质的量为
Ⅱ、实验室常用以下方法制取氯气:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:(1)把氯气通入紫色石蕊试液中,可以观察到的现象是:
(2)为保证实验安全,常用NaOH溶液吸收多余的氯气。写出反应的化学方程式
您最近一年使用:0次
2018-01-25更新
|
221次组卷
|
5卷引用:山东省桓台县2017-2018学年高一上学期期末考试化学试题
山东省桓台县2017-2018学年高一上学期期末考试化学试题山东省桓台第二中学2017-2018学年高一上学期期末考试化学试题辽宁省抚顺中学2017-2018学年高一上学期期末考试化学试题黑龙江省牡丹江中学2017-2018学年高一上学期期末考试化学试题(已下线)【艺体生百日捷进提升系列-技能方法】专题3.12 卤族方面试题的解题方法与技巧
5 . 据报道,日常生活中,将洁厕液与84消毒液混合使用会发生中毒的事故。
1.两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是_______ ,写出氯原子最外层电子排布的轨道表示式_____________ 。
2.84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式______ .若将84消毒液长期露置于空气中,溶液中的主要成分将变为________ 。(填化学式)
3.洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是____
A. 酸性:HF>HCl>HBr>HI
B. 键能:H—F>H—Cl>H—Br>H—I
C. 熔点:HF<HCl<HBr<HI
D. 还原性:HF<HCl<HBr<HI
4.洁厕液与84消毒液混合后会发生氧化还原反应,生成有毒的氯气。写出该反应的离子方程式____ 。
5.下列氧化还原反应中,与上述反应类型不同的是____
A. Na2S2O3+ H2SO4 → Na2SO4+ S + SO2+ H2O
B. 2FeCl3+ Fe → 2FeCl2
C. S + 2H2SO4(浓) 3SO2+ 2H2O
3SO2+ 2H2O
D. KClO3+ 5KCl + 3H2SO4 → 3K2SO4 + 3Cl2 + 3H2O
6.若以物质单位质量得到的电子数衡量物质的消毒效率,则下列常用的消毒剂中,消毒效率最高的是____
A. NaClO B. ClO2 C. Cl2 D. Ca(ClO)2
1.两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是
2.84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式
3.洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是
A. 酸性:HF>HCl>HBr>HI
B. 键能:H—F>H—Cl>H—Br>H—I
C. 熔点:HF<HCl<HBr<HI
D. 还原性:HF<HCl<HBr<HI
4.洁厕液与84消毒液混合后会发生氧化还原反应,生成有毒的氯气。写出该反应的离子方程式
5.下列氧化还原反应中,与上述反应类型不同的是
A. Na2S2O3+ H2SO4 → Na2SO4+ S + SO2+ H2O
B. 2FeCl3+ Fe → 2FeCl2
C. S + 2H2SO4(浓)
 3SO2+ 2H2O
3SO2+ 2H2OD. KClO3+ 5KCl + 3H2SO4 → 3K2SO4 + 3Cl2 + 3H2O
6.若以物质单位质量得到的电子数衡量物质的消毒效率,则下列常用的消毒剂中,消毒效率最高的是
A. NaClO B. ClO2 C. Cl2 D. Ca(ClO)2
您最近一年使用:0次
6 . 消毒液在我们日常生活中必不可少,请结合相关知识回答下列问题。
(1)生产消毒液时将氯气通入NaOH溶液中,发生反应的离子方程式为__ 。
(2)取少量消毒液滴加到AgNO3溶液中,现象是出现白色沉淀,说明消毒液中有____ 。
(3)消毒液稀释后喷洒在空气中,可以生成有漂白性的物质,请写出此过程的离子反应方程式:___________ ;
该物质有漂白性是因为它有强氧化性,但是它也很不稳定,请写出它分解的化学反应方程式:_______________ 。
(1)生产消毒液时将氯气通入NaOH溶液中,发生反应的离子方程式为
(2)取少量消毒液滴加到AgNO3溶液中,现象是出现白色沉淀,说明消毒液中有
(3)消毒液稀释后喷洒在空气中,可以生成有漂白性的物质,请写出此过程的离子反应方程式:
该物质有漂白性是因为它有强氧化性,但是它也很不稳定,请写出它分解的化学反应方程式:
您最近一年使用:0次
7 . 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:
在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,KMnO4晶体迅速溶解,然后产生气体,立即将表面皿盖好。
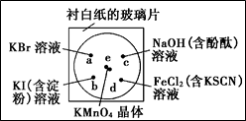
已知:2KMnO4 + 16HCl(浓) == 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O ]。
(1) e处反应的离子方程式为____________ 。
该反应中氧化剂和还原剂的物质的量之比为____________ 。
(2) b处的实验现象为____________ ,d处的实验现象为____________ 。
(3) c处反应的化学方程式为____________ 。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的个数约为____________ 。
(4) 通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
____________ (填“能”或“不能”),若能,其氧化性由强到弱的顺序是____________ 。
在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,KMnO4晶体迅速溶解,然后产生气体,立即将表面皿盖好。

已知:2KMnO4 + 16HCl(浓) == 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O ]。
(1) e处反应的离子方程式为
该反应中氧化剂和还原剂的物质的量之比为
(2) b处的实验现象为
(3) c处反应的化学方程式为
(4) 通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
您最近一年使用:0次
名校
8 . 氯酸钾是一种强氧化剂,在不同条件下KClO3将KI氧化为I2或KIO3。某实验小组在实验室中对KClO3和KI的反应进行了探究。回答下列问题:
实验一 制取氯酸钾

(1)A中反应的化学方程式为_______ 。实验开始时,首先进行的实验步骤是________ 。
(2)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由是__ (填“是”或“否”,若选择“是”请说明理由,若选择“否”则不需说明理由)
实验二 氯酸钾与碘化钾反应的研究
(3)该小组研究条件对反应产物的影响,系列a实验的记录表如下(实验在室温下进行):
①系列a实验的实验目的是__ .②设计1号试管实验的作用是__ .
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为______ .
实验一 制取氯酸钾

(1)A中反应的化学方程式为
(2)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由是
实验二 氯酸钾与碘化钾反应的研究
(3)该小组研究条件对反应产物的影响,系列a实验的记录表如下(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
①系列a实验的实验目的是
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为
您最近一年使用:0次
解题方法
9 . (1)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:_________ 。
(2)碘与氢氧化钠反应的生成物中含有IO3-,写出反应过程的离子方程式:___ 。
(3) 电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:_____________ 。
(4)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是_______ 。
(5) 用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。
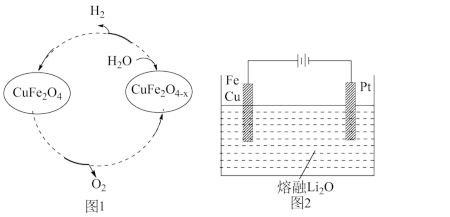
①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为_________ 。
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为_________ 。
(2)碘与氢氧化钠反应的生成物中含有IO3-,写出反应过程的离子方程式:
(3) 电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:
(4)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是
(5) 用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为
您最近一年使用:0次



