名校
解题方法
1 . 下列解释事实的化学用语不正确的是
A.碳酸钙与稀盐酸反应: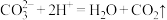 |
B.铜与稀硝酸反应: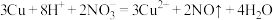 |
C.氨的催化氧化反应: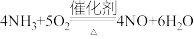 |
D.少量二氧化硫与氢氧化钠溶液反应: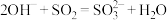 |
您最近一年使用:0次
2022-02-20更新
|
457次组卷
|
5卷引用:北京市中央民族大学附属中学2021-2022学年高三上学期12月月考化学试题
名校
解题方法
2 . 含氮化合物过多蓄积会导致水体富营养化,需将其从水体中除去,该过程称为脱氮。常用的脱氮方法有吹脱法和折点氯化法。
吹脱法:调节水体 至8左右,然后持续向水中吹入空气。
至8左右,然后持续向水中吹入空气。
折点氯化法:调节水体 至6左右,向水中加入适量
至6左右,向水中加入适量 。
。
下列分析不正确的是
吹脱法:调节水体
 至8左右,然后持续向水中吹入空气。
至8左右,然后持续向水中吹入空气。折点氯化法:调节水体
 至6左右,向水中加入适量
至6左右,向水中加入适量 。
。下列分析不正确的是
A.含氨和铵盐的水体中存在平衡: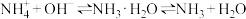 |
B.吹脱法的原理是通过鼓气降低 浓度,从而降低水中 浓度,从而降低水中 与 与 的含量 的含量 |
C.折点氯化法除 的原理为: 的原理为: |
D.吹脱法无法对含 的水体脱氮,但折点氯化法可以对含 的水体脱氮,但折点氯化法可以对含 的水体脱氮 的水体脱氮 |
您最近一年使用:0次
2021-10-19更新
|
1056次组卷
|
17卷引用:北京市北京中国人民大学附属中学2022届高三10月检测化学试卷
北京市北京中国人民大学附属中学2022届高三10月检测化学试卷北京市海淀区2019-2020学年高三期中考试化学试题(已下线)课时24 环境污染与保护-2022年高考化学一轮复习小题多维练(全国通用)(已下线)2022年新高考化学时事热点情境化考题---化学与文化生活(已下线)备战2022年高考化学精准检测卷【全国卷】11(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市交通大学附属中学2023-2024学年高一上学期12月月考化学试题2020届高三化学海淀区高三第一学期期中练习(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》湖北省龙泉中学、潜江中学2020届高三12月联考理综化学试题山东省济宁市泗水县2021届高三上学期期中考试化学试题天津市五校2022-2023学年高三上学期期中联考化学试题天津市咸水沽第一中学2022-2023学年高三上学期线上期末考试化学试题(已下线)章末综合评价(四)THUSSAT新高考地区2022年12月诊断性测试化学试题 重庆市2023-2024学年高三下学期2月月度质量检测化学试题(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
解题方法
3 . 实验室模拟氨催化氧化法的实验装置如图所示。下列说法错误的是

| A.装置①中可以盛装碱石灰 |
| B.氨催化氧化可直接生成NO2 |
| C.装置④中溶液可能会变红 |
| D.装置⑤的作用是处理尾气,气体X的主要成分为N2 |
您最近一年使用:0次
2021-10-12更新
|
1271次组卷
|
8卷引用:2021年北京高考化学试题变式题1-10
2021年北京高考化学试题变式题1-10湖北省京山市、安陆市等百校联考2022届高三月考化学试题江西省丰城市第九中学2021-2022学年高三上学期期中考试(日新班)化学试题(已下线)提升卷01-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)重庆市荣昌中学校2023-2024学年高三下学期开学考试化学试题(已下线)2024届广东省华南师范大学附属中学 广雅中学 深圳中学 广东实验中学高三上学期四校联考化学试题广东省云浮市云安区云安中学2023-2024学年高三下学期3月考试化学试题江苏省南京市金陵中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
4 . 氨气在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式_______ ;
② 的稳定性比
的稳定性比
_______ (填写“强”或“弱”)。
(2)如下图所示,向 固体上滴几滴浓氨水,迅速盖上盖,观察现象。
固体上滴几滴浓氨水,迅速盖上盖,观察现象。
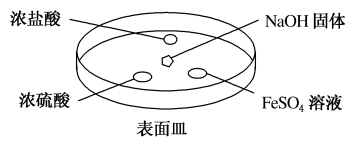
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_______ 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是_______ (写化学式,一种即可)。
③ 液滴中先出现白色沉淀,写出离子反应方程式
液滴中先出现白色沉淀,写出离子反应方程式_______ 。白色沉淀迅速变成灰绿色沉淀,过一段时间后变成红褐色,写出化学反应方程式_______ 。
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为_______ 。若反应中有 电子发生转移时,生成亚硝酸的质量为
电子发生转移时,生成亚硝酸的质量为_______ g(小数点后保留两位有效数字)。
(4) 可以转化为其他含氮物质,下图为
可以转化为其他含氮物质,下图为 转化为
转化为 的流程。
的流程。
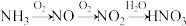
①写出 与
与 反应转化为
反应转化为 的化学方程式
的化学方程式_______ 。
② 转化为
转化为 的整个过程中,为提高氮原子的利用率,可采取的措施是
的整个过程中,为提高氮原子的利用率,可采取的措施是_______ 。
(1)①氮气用于工业合成氨,写出氮气的电子式
②
 的稳定性比
的稳定性比
(2)如下图所示,向
 固体上滴几滴浓氨水,迅速盖上盖,观察现象。
固体上滴几滴浓氨水,迅速盖上盖,观察现象。
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是
③
 液滴中先出现白色沉淀,写出离子反应方程式
液滴中先出现白色沉淀,写出离子反应方程式(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为
 电子发生转移时,生成亚硝酸的质量为
电子发生转移时,生成亚硝酸的质量为(4)
 可以转化为其他含氮物质,下图为
可以转化为其他含氮物质,下图为 转化为
转化为 的流程。
的流程。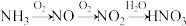
①写出
 与
与 反应转化为
反应转化为 的化学方程式
的化学方程式②
 转化为
转化为 的整个过程中,为提高氮原子的利用率,可采取的措施是
的整个过程中,为提高氮原子的利用率,可采取的措施是
您最近一年使用:0次
5 . 氮气经过一系列反应可以得到硝酸,如图所示:
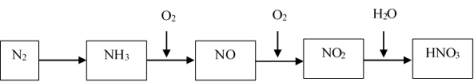
请回答:
(1)用NH3制取NO的化学方程式是___________ 。
(2)NO2易溶于水,写出它与水反应的化学方程式是___________ 。
(3)实验室常用如图装置制取并收集氨气。
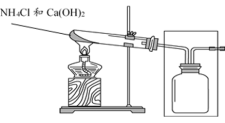
①试管中反应的化学方程式是___________ 。
②请将方框中的收集装置补充完整。__________
③将蘸有浓盐酸的棉球放在玻璃片上,用集满NH3的集气瓶扣住棉球,可观察到的现象是___________ 。
④甲同学设计了如图所示的装置进行尾气处理,乙同学认为该设计不合理,其理由是___________ 。
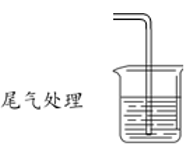

请回答:
(1)用NH3制取NO的化学方程式是
(2)NO2易溶于水,写出它与水反应的化学方程式是
(3)实验室常用如图装置制取并收集氨气。

①试管中反应的化学方程式是
②请将方框中的收集装置补充完整。
③将蘸有浓盐酸的棉球放在玻璃片上,用集满NH3的集气瓶扣住棉球,可观察到的现象是
④甲同学设计了如图所示的装置进行尾气处理,乙同学认为该设计不合理,其理由是

您最近一年使用:0次
名校
解题方法
6 . 下列解释事实的方程式不正确的是
A. 遇HCl产生白烟: 遇HCl产生白烟: |
B.NO遇空气变为红棕色: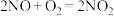 |
C. 发生催化氧化反应生成NO: 发生催化氧化反应生成NO: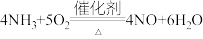 |
D.Cu与稀 混合产生无色气体: 混合产生无色气体: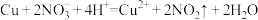 |
您最近一年使用:0次
2021-07-22更新
|
547次组卷
|
10卷引用:北京回民学校2020-2021 学年高一下学期期中考试化学试题
北京回民学校2020-2021 学年高一下学期期中考试化学试题北京育才学校2020-2021学年高一下学期期中考试化学试题北京市第五十六中学2020-2021学年高一下学期期中考试化学试题北京市西城区2019-2020学年高一下学期期末考试化学试题辽宁省葫芦岛市普通高中2020-2021学年高一下学期期末学业质量监测化学试题重庆市清华中学2020-2021学年高一下学期第二次月考化学试题北京市顺义区杨镇第一中学2021-2022学年高一下学期期中考试化学试题北京市西城区第三十五中学2022-2023学年高一下学期3月月考化学试题北京市第八中学2022-2023学年高一下学期期中考试(选考班)化学试题北京市大兴一中2023-2024学年高一下学期3月月考化学试题
7 . 氮是自然界中生物体生命活动不可缺少的重要元素,其化合物种类丰富。
Ⅰ.氨是重要的化工原料,实验室可通过图1装置制取。
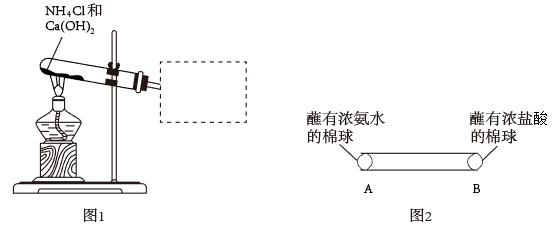
(1)写出实验室制取NH3的化学方程式___________ 。
(2)请将图l方框中用试管 收集NH3的装置补充完整___________ 。
(3)图2中,玻璃管内可观察到的现象是___________ (已知:相同条件下,相对分子质量小的气体,运动速率较快)。
(4)图2中,反应的生成物溶于水得到溶液a。取溶液a少许于试管中,___________ (填:操作和现象),则证明溶液a含有 。
。
II.研究氮的循环和转化对生产、生活有重要的价值。某工厂制硝酸的流程如下图所示。
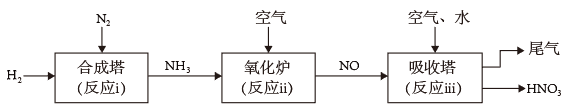
(5)上述转化中,属于氮的固定的是___________ (填“i”“ii”或“iii”)。
(6)写出“氧化炉”中反应的化学方程式___________ 。
(7)“吸收塔”排出的尾气中会含有NO、NO2等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。纯碱溶液与NO2反应的原理如下,请将该化学方程式补充完整:Na2CO3 + 2NO2 = NaNO3 +___________ + CO2
Ⅰ.氨是重要的化工原料,实验室可通过图1装置制取。

(1)写出实验室制取NH3的化学方程式
(2)请将图l方框中用
(3)图2中,玻璃管内可观察到的现象是
(4)图2中,反应的生成物溶于水得到溶液a。取溶液a少许于试管中,
 。
。II.研究氮的循环和转化对生产、生活有重要的价值。某工厂制硝酸的流程如下图所示。

(5)上述转化中,属于氮的固定的是
(6)写出“氧化炉”中反应的化学方程式
(7)“吸收塔”排出的尾气中会含有NO、NO2等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。纯碱溶液与NO2反应的原理如下,请将该化学方程式补充完整:Na2CO3 + 2NO2 = NaNO3 +
您最近一年使用:0次
2021-07-06更新
|
306次组卷
|
2卷引用:北京市大兴区2020-2021学年高一下学期期末考试化学试题
名校
解题方法
8 . 中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如图1所示。

(1)根据图1信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_______
a.SO2 b.NOx c.VOCs d.NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图2所示;写出稀燃过程中NO发生的主要反应的方程式_______ 。

(3)科学家经过研究发现中国霾呈中性,其主要原因如图3所示:
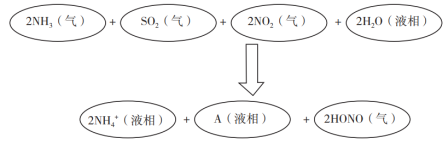
请推断A的化学式为_______ ,并说明理由:_______ 。
(4)在微生物作用下可实现NH →NO
→NO →NO
→NO 转化,称为硝化过程。在碱性条件下,NH
转化,称为硝化过程。在碱性条件下,NH 被氧气氧化为NO
被氧气氧化为NO 的反应离子方程式为
的反应离子方程式为_______ 。
(5)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
①上述转化过程中表现氧化性的物质为_______ ,若该溶液为1000 mL(吸收前后溶液体积不变),该过程转移的电子数为_______ mol。
②表中y=_______ 。

(1)根据图1信息可以看出,下列哪种气体污染物不是由机动车行驶造成的
a.SO2 b.NOx c.VOCs d.NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图2所示;写出稀燃过程中NO发生的主要反应的方程式

(3)科学家经过研究发现中国霾呈中性,其主要原因如图3所示:

请推断A的化学式为
(4)在微生物作用下可实现NH
 →NO
→NO →NO
→NO 转化,称为硝化过程。在碱性条件下,NH
转化,称为硝化过程。在碱性条件下,NH 被氧气氧化为NO
被氧气氧化为NO 的反应离子方程式为
的反应离子方程式为(5)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
| 离子 | Na+ | SO | NO | H+ | Cl- |
| 浓度/(mol/L) | 5.5×10-3 | y | 6.0×10-4 | 2.0×10-4 | 3.4×10-3 |
①上述转化过程中表现氧化性的物质为
②表中y=
您最近一年使用:0次
2021-06-15更新
|
343次组卷
|
2卷引用:北京市第二十中学2020-2021学年高一下学期期末考试化学试题
名校
解题方法
9 . 按要求填空。
(1)实验室制备NH3的化学方程式_______ 。
(2)工业上SO2转化为SO3的化学方程式_______ 。
(3)工业合成氨的化学方程式为_______ 。
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为_______ 。
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为_______ (用化学方程式表示)。
(6)氮肥是水体中氨态氮的主要来源之一。检验氨态氮肥中NH 的实验方案是
的实验方案是_______ 。
(7)NH 在水体中过多蓄积会导致水体富营养化。将水体调节为酸性后加入适量NaClO,可将其转化为无污染气体。写出该反应的离子方程式:
在水体中过多蓄积会导致水体富营养化。将水体调节为酸性后加入适量NaClO,可将其转化为无污染气体。写出该反应的离子方程式:_______ 。
(1)实验室制备NH3的化学方程式
(2)工业上SO2转化为SO3的化学方程式
(3)工业合成氨的化学方程式为
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为
(6)氮肥是水体中氨态氮的主要来源之一。检验氨态氮肥中NH
 的实验方案是
的实验方案是(7)NH
 在水体中过多蓄积会导致水体富营养化。将水体调节为酸性后加入适量NaClO,可将其转化为无污染气体。写出该反应的离子方程式:
在水体中过多蓄积会导致水体富营养化。将水体调节为酸性后加入适量NaClO,可将其转化为无污染气体。写出该反应的离子方程式:
您最近一年使用:0次
2021-05-25更新
|
259次组卷
|
2卷引用:北京师范大学第二附属中学2020-2021学年高一下学期期中考试化学试题
名校
解题方法
10 . 二氧化氮是主要的大气污染物之一,工业上在一定条件下用NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。

回答下列问题:
(1)用装置A制备NH3,其中发生反应的化学方程式为___________ ;装置B内的试剂是___________ 。
(2)装置D中发生反应的化学方程式是___________ ,铜丝可抽动的优点是___________ 。
(3)用装置M的方法收集氨气,是因为氨气的密度比空气___________ (填“大”或“小”)。
(4)工业利用氨气制取硝酸,其转化关系是: NH3 A
A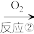 B
B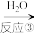 硝酸,相应化学方程式是①
硝酸,相应化学方程式是①___________ ;②___________ ;③___________ 。
(5)NH3和NO2在M中充分反应,产生两种对环境友好的物质,该反应的化学方程式为___________ ,M中可观察到的现象是___________ 。

回答下列问题:
(1)用装置A制备NH3,其中发生反应的化学方程式为
(2)装置D中发生反应的化学方程式是
(3)用装置M的方法收集氨气,是因为氨气的密度比空气
(4)工业利用氨气制取硝酸,其转化关系是: NH3
 A
A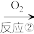 B
B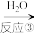 硝酸,相应化学方程式是①
硝酸,相应化学方程式是①(5)NH3和NO2在M中充分反应,产生两种对环境友好的物质,该反应的化学方程式为
您最近一年使用:0次
2021-05-13更新
|
274次组卷
|
2卷引用:北京三中2020-2021学年高一下学期期中考试化学试题



