1 . 利用下列实验装置和试剂进行实验,能达到实验目的的是
 |  | 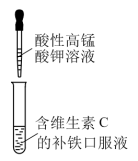 |  |
| A.铜与浓硝酸反应制NO2 | B.分离FeCl3溶液和氢氧化铁胶体 | C.证明补铁口服液中存在Fe2+ | D.加热NH4Cl固体制NH3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-02-09更新
|
604次组卷
|
4卷引用:福建省三明市普通高中2021-2022学年高一上学期期末质量检测化学试题
2 . 用如图装置(夹持装置已略去)进行 制备及性质实验。下列说法不正确的是
制备及性质实验。下列说法不正确的是
 制备及性质实验。下列说法不正确的是
制备及性质实验。下列说法不正确的是
A.甲中制备 利用了 利用了 的分解反应 的分解反应 |
| B.乙中的集气瓶内a导管短、b导管长 |
C.若将丙中的 换成苯,仍能防止倒吸 换成苯,仍能防止倒吸 |
D.向收集好的 中通入少量 中通入少量 ,可能观察到白烟 ,可能观察到白烟 |
您最近一年使用:0次
2021-04-09更新
|
1668次组卷
|
13卷引用:福建省厦门英才学校2021届高三4模考试化学试题
福建省厦门英才学校2021届高三4模考试化学试题北京市海淀区2021届高三一模化学试题安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题辽宁省抚顺市重点高中2020-2021学年高一下学期期末考试化学试题天津市新华中学2021-2022学年高三下学期 统练2 化学试题(已下线)北京市第四中学2021-2022学年高一下学期期中考试化学试题北京市育才学校2022届高三下学期三模化学试题北京市房山区2021-2022学年高三上学期期末考试化学试题上海市民立中学2022-2023学年高一上学期期末考试化学试题陕西省咸阳市武功县普集高级中学2022-2023学年高三上学期11月期中化学试题北京市第一六六中学2023-2024学年高三上学期期中考试化学试题北京市北京师范大学第二附属中学2021-2022学年高三上学期期中考试化学试题湖北省武汉三牛中学2023-2024学年高一下学期3月月考 化学试
名校
3 . Ⅰ.某实验小组利用以下装置制取氨气并探究氨气的性质:_______ 。
(2)装置B中的干燥剂是_______ (填名称)。
(3)装置C中的现象是_______ 。
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是_______ ,发生反应的化学方程式为_______ 。
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是_______ (填“E”或“F”)。
Ⅱ.现有一定量的Cu和CuO混合物,向其中加入0.6L 2.0mol/L稀硝酸,混合物完全溶解,同时生成4. 48L NO(标准状况)。向所得溶液中加入一定体积1. 0mol/LNaOH溶液, 恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32. 0g固体。
(6)试计算:原混合物中CuO的质量_______ ;

(2)装置B中的干燥剂是
(3)装置C中的现象是
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是
Ⅱ.现有一定量的Cu和CuO混合物,向其中加入0.6L 2.0mol/L稀硝酸,混合物完全溶解,同时生成4. 48L NO(标准状况)。向所得溶液中加入一定体积1. 0mol/LNaOH溶液, 恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32. 0g固体。
(6)试计算:原混合物中CuO的质量
您最近一年使用:0次
2022-08-25更新
|
1049次组卷
|
4卷引用:福建省福州高级中学2022-2023学年高一下学期期中考试化学试题
4 . 某小组设计如图所示装置(夹持装置略去)制备 。下列说法错误的是
。下列说法错误的是

 。下列说法错误的是
。下列说法错误的是
| A.③中的三颈烧瓶和④中的分液漏斗中可分别盛放饱和食盐水和浓氨水 |
B.应先向三颈烧瓶中通入足量 ,再通入足量 ,再通入足量 |
C. 也可由稀硫酸与碳酸钙粉末反应制取 也可由稀硫酸与碳酸钙粉末反应制取 |
| D.实验中产生的尾气可以通过浓NaOH溶液处理 |
您最近一年使用:0次
2022-02-09更新
|
614次组卷
|
3卷引用:福建省三明市普通高中2021-2022学年高二上学期期末质量检测化学试题
福建省三明市普通高中2021-2022学年高二上学期期末质量检测化学试题(已下线)第05讲 氨(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)广东省茂名高州市长坡中学2021-2022学年高一下学期3月月考化学试题
解题方法
5 . 用如图所示装置进行NH3与CuO反应的实验。下列说法错误的


| A.加入药品前须检验装置的气密性 | B.a中药品为氯化铵固体 |
| C.b中固体变红,可能有Cu2O生成 | D.c中能收集到氨水,d中可收集到N2 |
您最近一年使用:0次
6 . 硫氰化钾 是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备
是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备 并进行相关探究实验。
并进行相关探究实验。

已知:① 是一种不溶于水且密度大于水的非极性试剂;
是一种不溶于水且密度大于水的非极性试剂;
② 。
。
请回答下列问题:
(1) 的电子式为
的电子式为___________ 。
(2)装置A用于实验室制备氨气,该反应的化学方程式为___________ 。
(3)装置B中,三口烧瓶内盛有 、水和固体催化剂,通入氨气的导管需要插入
、水和固体催化剂,通入氨气的导管需要插入 液体中,其目的是
液体中,其目的是___________ 。
(4)待三口烧瓶内液体不再分层时,熄灭装置A处的酒精灯,关闭 ,移开水浴。将装置B继续加热至
,移开水浴。将装置B继续加热至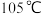 ,待
,待 完全分解后,打开
完全分解后,打开 ,缓缓滴入适量
,缓缓滴入适量 溶液,充分反应后制得
溶液,充分反应后制得 溶液。装置C中仪器a的名称为
溶液。装置C中仪器a的名称为___________ ,装置C处的烧杯中产生淡黄色浑浊的原因是___________ (用离子方程式表示)。
(5)过滤装置C中吸收尾气后的悬浊液,得到滤液x。现取少量滤液x进行如图所示的探究实验。
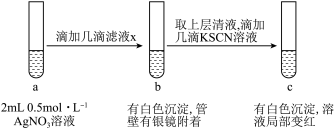
已知: 。
。
①试管b中产生银镜的原因是___________ (用离子方程式表示)。
②观察到试管c中出现上述实验现象后,用力振荡试管c,又观察到红色褪去且白色沉淀增多,结合平衡移动的知识解释其原因___________ 。
 是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备
是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备 并进行相关探究实验。
并进行相关探究实验。
已知:①
 是一种不溶于水且密度大于水的非极性试剂;
是一种不溶于水且密度大于水的非极性试剂;②
 。
。请回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A用于实验室制备氨气,该反应的化学方程式为
(3)装置B中,三口烧瓶内盛有
 、水和固体催化剂,通入氨气的导管需要插入
、水和固体催化剂,通入氨气的导管需要插入 液体中,其目的是
液体中,其目的是(4)待三口烧瓶内液体不再分层时,熄灭装置A处的酒精灯,关闭
 ,移开水浴。将装置B继续加热至
,移开水浴。将装置B继续加热至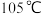 ,待
,待 完全分解后,打开
完全分解后,打开 ,缓缓滴入适量
,缓缓滴入适量 溶液,充分反应后制得
溶液,充分反应后制得 溶液。装置C中仪器a的名称为
溶液。装置C中仪器a的名称为(5)过滤装置C中吸收尾气后的悬浊液,得到滤液x。现取少量滤液x进行如图所示的探究实验。

已知:
 。
。①试管b中产生银镜的原因是
②观察到试管c中出现上述实验现象后,用力振荡试管c,又观察到红色褪去且白色沉淀增多,结合平衡移动的知识解释其原因
您最近一年使用:0次
7 . 二氧化氮是主要的大气污染物之一,工业上在一定条件下用NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略),回答:
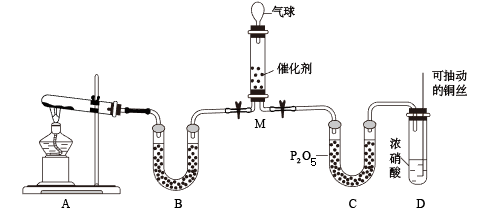
(1)用装置A制备NH3,其中发生反应的化学方程式为____ ,装置B内的试剂是____ 。
(2)装置C的作用的___ ,铜丝可抽动的优点是___ ,装置D中发生反应的离子方程式是____ 。
(3)NH3和NO2在M中充分反应,产生两种对环境友好的物质,该反应的化学方程式为___ 。M中可观察到的现象是____ 。

(1)用装置A制备NH3,其中发生反应的化学方程式为
(2)装置C的作用的
(3)NH3和NO2在M中充分反应,产生两种对环境友好的物质,该反应的化学方程式为
您最近一年使用:0次
2022-03-01更新
|
530次组卷
|
3卷引用:福建省泉州市第十六中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
8 . 氨气在工农业生产中有着重要应用,请回答下列问题:
I.实验室用消石灰和氯化铵固体制备 ,并验证其还原性。
,并验证其还原性。________ ,用消石灰和氯化铵固体共热制取氨气的发生装置为________ (填“A”或“B”),写出该反应的化学方程式:________
(2)欲收集一瓶干燥的 ,选择如图的装置,其连接顺序为:发生装置→
,选择如图的装置,其连接顺序为:发生装置→________ (按气流方向,用小写字母表示)
(3)将制得的氨气通入灼热氧化铜粉末中,一段时间后,黑色粉末逐渐变红,并产生无毒的气体,写出该反应的化学方程式:________ 。
II.实验室利用下列装置模拟工业生产制备少量硝酸。 通入水中生成硝酸,该反应中氧化剂与还原剂的质量比为
通入水中生成硝酸,该反应中氧化剂与还原剂的质量比为________ 。
(5)NaOH溶液的作用为________ 。
I.实验室用消石灰和氯化铵固体制备
 ,并验证其还原性。
,并验证其还原性。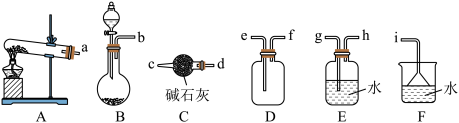
(2)欲收集一瓶干燥的
 ,选择如图的装置,其连接顺序为:发生装置→
,选择如图的装置,其连接顺序为:发生装置→(3)将制得的氨气通入灼热氧化铜粉末中,一段时间后,黑色粉末逐渐变红,并产生无毒的气体,写出该反应的化学方程式:
II.实验室利用下列装置模拟工业生产制备少量硝酸。
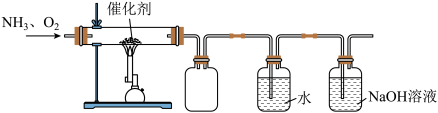
 通入水中生成硝酸,该反应中氧化剂与还原剂的质量比为
通入水中生成硝酸,该反应中氧化剂与还原剂的质量比为(5)NaOH溶液的作用为
您最近一年使用:0次
2023-03-15更新
|
452次组卷
|
2卷引用:福建省福州延安中学2023-2024学年高一下学期4月期中考试化学试题
名校
9 . “价-类”二维图是学习元素化合物性质的重要方法,利用所学知识能更好的了解氮的循环。

(1)I.“价-类”二维图中A的类别为___________ ; 丙为钠盐,其化学式为___________ 。
(2)甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为___________ 。
(3)用以下物质研究乙的性质,预测能与乙发生反应的物质为___________(填标号)。
(4)丁主要用于染料、医药、印染、漂白等方面,且丁的焰色反应呈黄色。丁在酸性条件下,与KI按物质的量1∶1恰好完全反应,且生成能使淀粉变蓝的物质,则产物中含氮元素物质的化学式为___________ 。
II.海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。
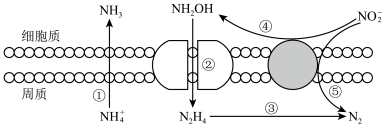
(5)以上六种含氮微粒中,一共呈现了氮元素的___________ 种价态。
(6)反应③和⑤中,若生成等量的N2,则转移的电子数之比为___________ 。

(1)I.“价-类”二维图中A的类别为
(2)甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为
(3)用以下物质研究乙的性质,预测能与乙发生反应的物质为___________(填标号)。
| A.Na2SO4 | B.Mg | C.CO2 | D.NH3·H2O |
II.海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。

(5)以上六种含氮微粒中,一共呈现了氮元素的
(6)反应③和⑤中,若生成等量的N2,则转移的电子数之比为
您最近一年使用:0次
2022-01-19更新
|
549次组卷
|
3卷引用:福建省南平市2020-2021学年高一上学期期末质量检测化学试题
名校
解题方法
10 . 利用下列装置和试剂进行实验,不能达到实验目的的是
| A | B | C | D |
 | 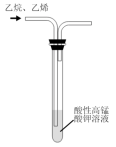 |  | 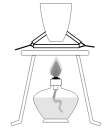 |
| 制备少量氨气 | 获得纯净的乙烷 | 探究温度对平衡的影响 | 灼烧海带 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



