1 . 下列物质的转变在给定条件下能通过一步反应实现的是
A.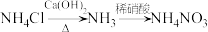 |
B. |
C.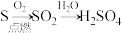 |
D.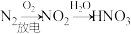 |
您最近一年使用:0次
2022-05-05更新
|
303次组卷
|
3卷引用:湖北省部分示范高中2021-2022学年高一下学期期中考试化学试题
解题方法
2 . 常温下,下列各组粒子在指定溶液中能大量共存的是
A.强酸性溶液: 、 、 、 、 、 、 |
B.无色透明溶液: 、 、 、 、 、 、 |
C.使酚酞变红的溶液: 、 、 、 、 、 、 |
D.加入铝粉放出 的溶液: 的溶液: 、 、 、 、 、 、 |
您最近一年使用:0次
2022-04-21更新
|
142次组卷
|
2卷引用:湖北省荆、荆、襄、宜四地七校2021-2022学年高一下学期期中联考化学试题
3 . 如图是某元素的价类二维图,其中 是一种强碱,
是一种强碱, 为正盐,通常条件下
为正盐,通常条件下 是无色液体,
是无色液体, 的相对分子质量比
的相对分子质量比 小
小 ,各物质转化关系如图所示。下列说法正确的是
,各物质转化关系如图所示。下列说法正确的是
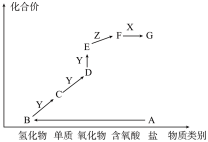
 是一种强碱,
是一种强碱, 为正盐,通常条件下
为正盐,通常条件下 是无色液体,
是无色液体, 的相对分子质量比
的相对分子质量比 小
小 ,各物质转化关系如图所示。下列说法正确的是
,各物质转化关系如图所示。下列说法正确的是
A. 和 和 能发生复分解反应生成盐 能发生复分解反应生成盐 | B. 的反应可用于检验 的反应可用于检验 |
C. 一般用排空气法收集 一般用排空气法收集 | D.同主族元素的氢化物中 的沸点最低 的沸点最低 |
您最近一年使用:0次
名校
解题方法
4 . 下列说法错误的是
① 与
与 反应生成
反应生成 和NO,故
和NO,故 是酸性氧化物
是酸性氧化物
②氨气溶于水得到的氨水能导电,氨气是电解质
③固态氯化氢不导电,液态氯化氢可以导电
④实验室中取用后剩余的钠要放回原试剂瓶中
⑤碱性氧化物一定是金属氧化物
⑥钠与浓NH4Cl溶液反应,放出的气体中含H2和NH3
①
 与
与 反应生成
反应生成 和NO,故
和NO,故 是酸性氧化物
是酸性氧化物②氨气溶于水得到的氨水能导电,氨气是电解质
③固态氯化氢不导电,液态氯化氢可以导电
④实验室中取用后剩余的钠要放回原试剂瓶中
⑤碱性氧化物一定是金属氧化物
⑥钠与浓NH4Cl溶液反应,放出的气体中含H2和NH3
| A.④⑤⑥ | B.①②③ | C.②④ | D.①②③⑤ |
您最近一年使用:0次
2022-02-18更新
|
320次组卷
|
2卷引用:湖北省襄阳市第一中学2021-2022学年高一上学期10月测试二化学试题
名校
解题方法
5 . 下列反应的离子方程式书写正确的是
| A.盐酸除铁锈:6H+ + Fe2O3 = 2Fe3++3H2O |
B.Na2O2与CO2反应制备O2:Na2O2+CO2=2Na++CO +O2↑ +O2↑ |
C.向碳酸氢铵溶液中加过量石灰水并加热: +OH- +OH- NH3↑+H2O NH3↑+H2O |
D.用酸化的高锰酸钾溶液氧化双氧水:2 +6H++H2O2=2Mn2++3O2↑+4H2O +6H++H2O2=2Mn2++3O2↑+4H2O |
您最近一年使用:0次
21-22高三上·上海杨浦·期中
名校
解题方法
6 . 下列指定反应的离子方程式正确的是
A.用过量氨水吸收工业尾气中的 ; ;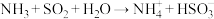 |
B. 溶液中加入少量 溶液中加入少量 溶液: 溶液: |
C.等物质的量的 、 、 、 、 三种溶液混合: 三种溶液混合: |
D. 溶液与少量 溶液与少量 溶液反应: 溶液反应: |
您最近一年使用:0次
2021-11-26更新
|
1566次组卷
|
4卷引用:一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)
(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)上海市复旦大学附属中学2021-2022学年高三上学期期中考试化学试题(已下线)3.3 氮的循环-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)福建省泉州市两校2021-2022学年高一下学期期中联考化学试题
名校
解题方法
7 . 某强酸性透明溶液中可能含有 、
、 、
、 、
、 、
、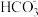 、
、 中的几种。为了确定其组成,现做以下实验:
中的几种。为了确定其组成,现做以下实验:
①取该溶液 ,加入足量的
,加入足量的 溶液,加热,得到标况下
溶液,加热,得到标况下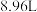 气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到
气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到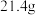 固体。
固体。
②向上述滤液中加入足量的 溶液,产生白色沉淀,过滤,洗涤,干燥得到
溶液,产生白色沉淀,过滤,洗涤,干燥得到 固体。
固体。
已知:含 的盐与强碱混合后,加热可以产生
的盐与强碱混合后,加热可以产生 。
。
(1)该溶液中一定含有___________ ;可能含有___________ ,可以用定性分析操作___________ 来进行检验。若含有,现象是:___________ 。
(2)计算:该 溶液中,若
溶液中,若 ,则
,则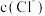
___________ 。
(3)已知 与
与 在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式
在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式___________ ;当某溶液 中大量存在
中大量存在 时,
时, 溶液中不可能大量含有
溶液中不可能大量含有___________ 。
a. b.
b.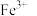 c.
c. d.
d. e.
e.
 、
、 、
、 、
、 、
、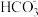 、
、 中的几种。为了确定其组成,现做以下实验:
中的几种。为了确定其组成,现做以下实验:①取该溶液
 ,加入足量的
,加入足量的 溶液,加热,得到标况下
溶液,加热,得到标况下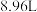 气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到
气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到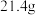 固体。
固体。②向上述滤液中加入足量的
 溶液,产生白色沉淀,过滤,洗涤,干燥得到
溶液,产生白色沉淀,过滤,洗涤,干燥得到 固体。
固体。已知:含
 的盐与强碱混合后,加热可以产生
的盐与强碱混合后,加热可以产生 。
。(1)该溶液中一定含有
(2)计算:该
 溶液中,若
溶液中,若 ,则
,则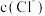
(3)已知
 与
与 在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式
在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式 中大量存在
中大量存在 时,
时, 溶液中不可能大量含有
溶液中不可能大量含有a.
 b.
b.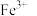 c.
c. d.
d. e.
e.
您最近一年使用:0次
2021-11-21更新
|
263次组卷
|
2卷引用:湖北省鄂东南省级示范高中教育教学改革联盟学校2021-2022学年高一上学期期中联考化学试题
8 . 铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用基准试剂,其制备过程如图:

下列说法错误的是

下列说法错误的是
| A.过程Ⅰ过滤可得到NaHCO3晶体 |
| B.过程Ⅱ加入稀硫酸的目的是为了除去滤液A中混有的杂质NaHCO3 |
| C.铵明矾能析出是因为其溶解度比(NH4)2SO4、Al2(SO4)3的均小 |
| D.向铵明矾溶液中逐滴加入NaOH溶液并加热,依次观察到的现象为:先有刺激性气味气体逸出,接着有白色沉淀生成,最后白色沉淀溶解 |
您最近一年使用:0次
2021-09-11更新
|
247次组卷
|
3卷引用:湖北省新高考联考协作体2021-2022学年高三上学期起点考试化学试题
名校
解题方法
9 . 下列各组离子能在溶液中大量共存的是
A.K+、NH 、 、 、OH- 、OH- | B.Na+、H+、HCO 、Cl- 、Cl- |
C.H+、K+、NO 、SO 、SO | D.Na+、Ca2+、 、ClO- 、ClO- |
您最近一年使用:0次
2021-09-02更新
|
277次组卷
|
9卷引用:湖北省襄阳市第一中学2021-2022学年高一上学期9月月考化学试题
湖北省襄阳市第一中学2021-2022学年高一上学期9月月考化学试题(已下线)【浙江新东方】双师211高一下云南省曲靖市罗平县第二中学2019-2020学年高一下学期期中考试化学试题湖南省邵东县第三中学2020-2021学年高一下学期第一次月考化学试题甘肃省民勤县第一中学2021-2022学年高一下学期期中考试化学(选修)试题福建省厦门市湖滨中学2021-2022学年高一下学期期中考试化学试题河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题山西省太原市外国语学校2022-2023学年高一下学期3月月考化学试题湖南省株洲市炎陵县2022-2023学年高一下学期3月月考化学试题
解题方法
10 . 工业以黄铁矿为原料生产硫酸,吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
计算:该铵盐中氮元素的质量分数_______ (计算结果保留两位小数)
| 铵盐的质量(g) | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量(g) | m | m | 1.29 | 0 |
计算:该铵盐中氮元素的质量分数
您最近一年使用:0次



