名校
解题方法
1 . 下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:把混合气体通入酸性KMnO4溶液中洗气
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤
③除去CO2中少量的SO2:气体通过盛有饱和碳酸钠溶液的洗气瓶
④除去乙醇中少量的水:加足量生石灰,蒸馏
①除去乙烷中少量的乙烯:把混合气体通入酸性KMnO4溶液中洗气
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤
③除去CO2中少量的SO2:气体通过盛有饱和碳酸钠溶液的洗气瓶
④除去乙醇中少量的水:加足量生石灰,蒸馏
| A.①② | B.②④ | C.③④ | D.②③ |
您最近一年使用:0次
2023-04-28更新
|
941次组卷
|
3卷引用:湖北省恩施州高中教育联盟2022-2023学年高一下学期期中考试化学试题
名校
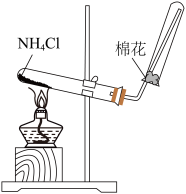
2 . 某兴趣小组为探究浓硫酸与铜的反应,设计了如下装置。

(1)铜丝与浓硫酸反应的化学方程式为_______ 。
(2)为验证品红被 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象_______ 。
(3)浸NaOH溶液的棉团作用是_______ 。
(4)为进一步探究 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。

某合作学习小组设计实验,对 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)
①查阅资料 不同浓度的 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的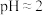 。
。
②提出猜想 猜想1: 被
被 氧化
氧化
猜想2: 在酸性条件下被
在酸性条件下被 氧化
氧化
猜想3:_______
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、 和
和 固体
固体
④交流讨论 小组同学认为,综合上述两个实验不足以证明猜想3成立。
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:_______ (只需提供设计思路,不需要写出具体操作步骤)。

(1)铜丝与浓硫酸反应的化学方程式为
(2)为验证品红被
 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象(3)浸NaOH溶液的棉团作用是
(4)为进一步探究
 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
某合作学习小组设计实验,对
 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)①查阅资料 不同浓度的
 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的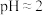 。
。②提出猜想 猜想1:
 被
被 氧化
氧化猜想2:
 在酸性条件下被
在酸性条件下被 氧化
氧化猜想3:
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、
 和
和 固体
固体| 实验步骤 | 实验现象和结论 |
| 实验1:取少量反应后的上层清液于试管中,滴入少量 | 出现 与 与 发生的离子方程式为 发生的离子方程式为 |
实验2:往图中的装置中加入100mL 固体,再通入过量 固体,再通入过量 。 。 | 出现白色沉淀,说明猜想2成立。 |
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:
您最近一年使用:0次
2022-04-29更新
|
1045次组卷
|
6卷引用:湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)热点1实验方案设计四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)
3 . 以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为_______ 。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。
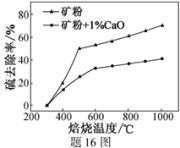
已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1— )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于_______ 。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是__ 。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由__ (填化学式)转化为__ (填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=_______ 。

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—
 )×100%
)×100%①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由
(4)“过滤”得到的滤渣中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=
您最近一年使用:0次
2018-06-10更新
|
6408次组卷
|
17卷引用:江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)
江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)2018年全国普通高等学校招生统一考试化学(江苏卷)(已下线)2018年高考题及模拟题汇编 专题15 工艺流程题【全国百强校】江苏省徐州市第一中学2019届高三上学期第一次月考化学试题江苏师范大学附属实验学校2019届高三上学期10月学情调研化学试题(已下线)2019年5月14日 《每日一题》人教必修2——金属矿物的开发利用2020届高考化学二轮复习大题精准训练——化学工艺流程专题山东省2020届高三新高考仿真模拟化学试题江苏省苏州新草桥中学2020届高三上学期10月月考化学试题(已下线)专题3.2 铝及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)专题3.2 铝及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)第12讲 镁、铝、铜及其化合物 金属冶炼(精讲)——2021年高考化学一轮复习讲练测江苏省镇江中学2020-2021学年高二下学期期末模拟测试化学试题(已下线)第8讲 金属材料(不锈钢、铝合金、合金)(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)江西省宜春市丰城市第九中学2021-2022学年高三上学期第三次月考化学试题(已下线)第08讲 金属材料(练)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省北镇市满族高级中学2022-2023学年高三上学期第一次质量检测化学试题
4 . 下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是
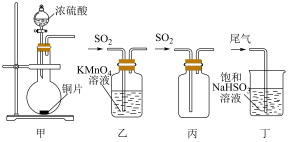
| A.用装置甲制取SO2 | B.用装置乙验证SO2的漂白性 |
| C.用装置丙收集SO2 | D.用装置丁处理实验中的尾气 |
您最近一年使用:0次
2024-03-25更新
|
794次组卷
|
108卷引用:重庆市第三十中学2018-2019学年高一下学期期中考试化学试题
重庆市第三十中学2018-2019学年高一下学期期中考试化学试题福建省莆田市莆田第二十五中学2020届高三上学期期中考试化学试题上海市同济大学第一附属中学2019—2020学年高三上学期期中考试化学试题福建省漳州市平和县第一中学2021届高三上学期期中考试化学试题(已下线)【苏州新东方】04 吴县中学甘肃省金昌市第一中学2020-2021学年高一下学期期中考试化学(理)试题江苏省盐城市滨海县五汛中学2021-2022学年高二上学期期中考试化学试题上海市七宝中学 2021-2022学年高一下学期期中考试化学试题广东省广州市育才中学2021-2022学年高一下学期期中考试化学试题天津市第二十一中学2021-2022学年高一下学期期中学情调研化学试题江苏省南京市中华中学2021-2022学年高三上学期期中考试化学试题四川省自贡市荣县2022-2023学年高一下学期4月期中考试化学试题广东省广州市协和中学2022-2023学年高一下学期期中考试化学试题广东省广州科学城中学2022-2023学年高一下学期期中考试化学试题河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题2017年全国普通高等学校招生统一考试化学(江苏卷精编版)安徽省宣城市2016-2017学年高一下学期期末调研测试化学试题江苏省海安高级中学2018届高三1月月考化学试题北京市丰台区2018届高三上学期期末考试化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.15 物质的制备及实验方案设计与评价重庆市第一中学2017-2018学年高一下学期第一次月考化学试题北京市密云区2017-2018学年高三第二学期阶段性练习理综化学试题(已下线)解密16 化学实验基础(教师版)——备战2018年高考化学之高频考点解密【全国百强校】四川省雅安中学2018-2019学年高一上学期开学考试化学试题山东省淄博市淄川中学2019届高三上学期开学考试化学试题【校级联考】湖北省宜昌县域高中协同发展共合体2018-2019学年高一上学期期末考试化学试题【全国百强校】吉林省延边市第二中学2018-2019学年高一下学期开学考试化学试题步步为赢 高二化学暑假作业:作业十二 化学实验基础知识重庆市璧山大路中学校2018-2019学年高一下学期4月月考化学试题百所名校联考-非金属及其化合物安徽省合肥二中2019-2020学年度高三上学期第一次段考化学试题安徽省芜湖市严桥中学2019-2020学年高三第一学期第三次月考化学试题宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题2019年秋高三化学复习强化练习—— 硫及其化合物上海市普陀区2020届高三上学期一模化学试题江苏省苏州市2018-2019学年高一上学期期末考试化学试题2020届高三化学一轮复习 化学基础实验(选择题和大题训练)(已下线)专题3.4 硫及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》第2章 第3节 化学反应的利用福建省福州市第一中学2020年高一在线自测自评质检化学试题(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题福建省泉州第十六中学2019-2020学年高一下学期5月月考化学试题(已下线)专题4.3 硫及其化合物(练)——2020年高考化学一轮复习讲练测(已下线)专题4.3 硫及其化合物(讲)——2020年高考化学一轮复习讲练测北京市丰台区首师大附属云岗中学2019届高三上学期10月月考化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第二次调研考试化学试题(已下线)考点15 常见非金属元素单质及其重要化合物3——硫-2020年【衔接教材·暑假作业】新高三一轮复习化学(已下线)第6单元 常见的非金属元素(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷广东省珠海市2019-2020学年高一下学期期末学业质量监测化学试题苏教版(2020)高一必修第一册专题4 总结检测鲁科版(2019)高一必修第一册第3章 物质的性质与转化 总结检测鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关北京师范大学珠海分校附属外国语学校2019-2020学年高一下学期期末考试化学试题高一必修第一册(鲁科2019)第3章 第2节 硫的转化 高考帮高一必修第二册(人教2019版)第五章 素养检测高一必修第一册(苏教2019版)专题4 C 高考挑战区湖南省长沙市雅礼中学2021届高三上学期第二次月考化学试题(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(精练)-2021年高考化学一轮复习讲练测高一必修第一册(苏教2019)专题4 第一单元 含硫化合物的性质3安徽省灵璧县第一中学2020-2021学年高一上学期12月月考试题山东省胶州市实验中学2020-2021学年高一上学期12月月考化学试题(已下线)练习9 硫和二氧化硫-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)专题4 第一单元综合拔高练-高中化学苏教2019版必修第一册(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物宁夏银川一中2020-2021学年高一上学期期末考试(GAC)化学试题(已下线)5.1.3 不同价态含硫物质的转化(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)江苏省苏州市苏州大学附属中学2020-2021学年高一上学期月考化学试卷2湖南省长沙市第一中学2020-2021学年高一下学期第一次月考化学试题江苏省苏州市园区苏州大学附属中学2020-2021学年高一上学期12月月考化学试题黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高一4月月考化学试题黑龙江省哈尔滨市第一六二中学校2020-2021学年高一下学期4月月考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题江苏省启东市吕四中学2020-2021学年高一下学期第二次月考化学试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(B)试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(A)试题吉林省白城一中、大安一中、通榆一中、洮南一中、镇赉一中2020-2021学年高一下学期期末考试化学试题(已下线)考向12 硫及其化合物-备战2022年高考化学一轮复习考点微专题江苏省昆山市周市高级中学2020-2021学年高一上学期第二次模块测试化学试题广东省深圳市第七高级中学2022届高三第一次月考化学试卷江苏省盐城市伍佑中学2021-2022学年高二上学期第一次阶段考试化学(必修)试题浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题陕西省西安市高新第一中学2020届高三教学质量监测理综化学试题江苏省徐州市沛县2021-2022学年高三上学期第一次学情调研化学试题(已下线)考向34 物质的检验、分离和提纯-备战2022年高考化学一轮复习考点微专题江苏省徐州市2021-2022学年高一上学期12月月考化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一上学期12月质量检测化学试题(已下线)第10练 硫及其化合物-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)甘肃省张掖市第二中学 2021-2022学年高一下学期3月月考化学试题宁夏青铜峡市高级中学2021-2022学年高一上学期期末考试化学试题(已下线)卷13 化学基础实验(检验、鉴别、分离、提纯)-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)【期末复习】必刷题(1)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)新疆维吾尔自治区阿克苏地区第二中学2021-2022学年高一年级下学期第二次月考化学试题(已下线)【教材实验热点】06 二氧化硫的漂白性(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题江西省上饶市2019-2020学年高一下学期期末教学质量测试化学试题四川省资阳市乐至中学2022-2023学年高一下学期3月月考化学试题(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)考点巩固卷04 非金属及其化合物(4大考点60题)?-2024年高考化学一轮复习考点通关卷(新高考通用)山东省鄄城县第一中学2023-2024学年高三上学期9月月考化学试题(已下线)押题卷01-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)福建省漳州市第一中学2023-2024学年高一上学期化学12月月考(第二单元)江西省丰城市东煌学校2022-2023学年高一下学期6月期末考试化学试题广东实验中学越秀学校2023-2024学年高一3月段考化学试题黑龙江省双鸭山市第一中学2023-2024学年高一下学期4月月考化学试题(已下线)北京市西城区2024届高三下学期第三次模拟测试化学试题广东省东莞市东华高级中学 东华松山湖高级中学 2024届高三下学期第三次模拟考试 化学试题
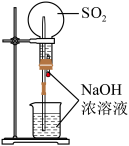
5 . 某化学小组为了研究 和
和 的漂白性,设计了如图所示的实验装置:
的漂白性,设计了如图所示的实验装置:

请完成下列空格:
(1)盛装70%浓硫酸的仪器名称________ 。
(2)A装置中发生反应的化学方程式是_______ 。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是________ 。
(4)利用下图所示装置探究两种气体按不同比例混合后漂白性的强弱。

①盛有浓硫酸洗气瓶除干燥气体外,另外一个作用是_______ ;
②实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其可能原因是________ (用相应的离子方程式作答);
③通气一段时间后,请设计实验验证NaOH溶液中含有
________ 。
 和
和 的漂白性,设计了如图所示的实验装置:
的漂白性,设计了如图所示的实验装置:
请完成下列空格:
(1)盛装70%浓硫酸的仪器名称
(2)A装置中发生反应的化学方程式是
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是
(4)利用下图所示装置探究两种气体按不同比例混合后漂白性的强弱。

①盛有浓硫酸洗气瓶除干燥气体外,另外一个作用是
②实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其可能原因是
③通气一段时间后,请设计实验验证NaOH溶液中含有

您最近一年使用:0次
名校
6 . 用下列实验装置进行相应实验,有关说法不正确的是
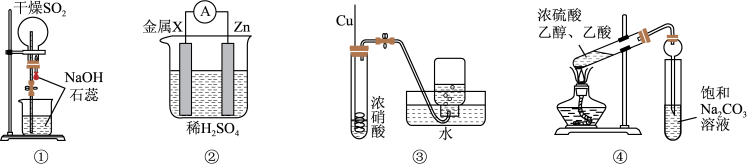
| A.装置①可用于演示喷泉实验 |
| B.装置②可用于比较金属X和Zn的金属活动性强弱 |
| C.装置③可用于实验室制备并收集NO2 |
| D.装置④可用于制备乙酸乙酯 |
您最近一年使用:0次
2022-03-31更新
|
1847次组卷
|
16卷引用:湖南省常德市石门县第一中学2022-2023学年高一下学期期中考试化学试题
湖南省常德市石门县第一中学2022-2023学年高一下学期期中考试化学试题广东省汕头市潮阳实验学校2022-2023学年高一下学期期中考试化学试题重庆市主城区六校2020-2021学年高一下学期期末联考化学试题(已下线)化学-2022年高考押题预测卷01(全国乙卷)江西省赣州市赣县第三中学2021-2022学年高一下学期5月月考化学试题陕西省安康中学2021-2022学年高一下学期第二次月考化学试题辽宁省抚顺市六校协作体2021-2022学年高一下学期期末考试化学试题河北省定州市第二中学2021-2022学年高一下学期期末考试化学试题湖南省长沙市宁乡市2021-2022学年高一下学期期末考试化学试题重庆市巫山县官渡中学2021-2022学年高二下学期期末考试化学试题湖北省襄阳市第四中学2022-2023学年高二上学期8月新起点考试化学试卷题河北省沧州市献县求实高级中学2021-2022学年高一下学期4月底月考化学试题河北省石家庄精英中学2022-2023高二上学期开学考试化学试题吉林省洮南市第一中学2021-2022学年高一下学期第三次月考化学试题重庆市杨家坪中学2022-2023学年高一下学期5月第二次月考化学试题河北昌秦皇岛市昌黎第一中学2023-2024学年高二上学期第五次调研考试化学试题
名校
解题方法
7 . 推理是一种重要的能力。打开分液漏斗活塞,进行如图所示的探究实验,对实验现象的预测及分析错误的是
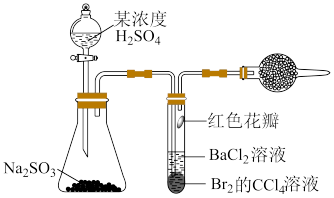
| A.试管内CCl4层溶液褪色,说明Br2具有氧化性 |
| B.试管中的红色花瓣褪色,说明SO2具有漂白性 |
| C.试管中产生大量气泡,说明Na2SO3被氧化产生SO3 |
D.一段时间后试管内有白色沉淀,说明有SO 生成 生成 |
您最近一年使用:0次
2021-01-25更新
|
2817次组卷
|
17卷引用:江西省赣州市十六县(市)十七校2020-2021学年高一下学期期中联考化学试题
江西省赣州市十六县(市)十七校2020-2021学年高一下学期期中联考化学试题山东省济宁市任城区2020-2021学年高一下学期期中考试化学试题(已下线)专题03 硫酸和硝酸专讲(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)江西省丰城市第二中学2023-2024学年高一上学期11月期中考试化学试题广东省2021年普通高中学业水平选择考适应性测试化学试题湖北省武汉市蔡甸区汉阳一中2020-2021学年高一下学期5月月考化学试题辽宁省庄河市高级中学2021-2022学年高二上学期开学考试化学试题(已下线)专题14 无机综合运用(选择题)-2022年高考化学二轮复习重点专题常考点突破练(已下线)第11讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第四章 非金属及其化合物 第21讲 硫酸 含硫物质的转化上海市复旦大学附属中学2022-2023学年高三下学期3月月考化学试题陕西西安三中2022-2023学年高一下学期第二次月考化学试题(已下线)第3讲 硫及其重要化合物(已下线)第12讲 硫及其化合物(已下线)考点15 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山西省大同市浑源七中2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
8 . 用如图所示实验装置进行相关实验,其中合理的是
| A.制备并收集NH3 | B.鉴别纯碱与小苏打 |
|
|
| C.进行喷泉实验 | D.收集NO气体 |
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-07更新
|
831次组卷
|
6卷引用:浙江省浙北G2联盟 2022-2023学年高一下学期4月期中联考化学试题
名校
解题方法
9 . 下列说法正确的是
| A.可用澄清石灰水鉴别CO2与SO2 |
| B. SO2能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性 |
| C. SO2能使紫色石蕊溶液先变红后褪色 |
| D. SO2的漂白性与氯水漂白原理不同 |
您最近一年使用:0次
2023-03-27更新
|
835次组卷
|
6卷引用:湖南省长沙市长郡中学2022-2023学年高一下学期期中考试化学试题
10 . 实验小组制备硫代硫酸钠(Na2S2O3·5H2O)并探究其性质。
资料:Na2S2O3·5H2O在中性溶液中较稳定,在酸性溶液中分解产生S、SO2。
I. 制备Na2S2O3·5H2O
(1)实验室有多种方法制备SO2,写出其中一种的化学方程式_______ 。
(2)装置B用于处理SO2尾气,离子方程式为_______ 。
(3)A中生成硫代硫酸钠的实质是:S+Na2SO3=Na2S2O3
①S是由SO2、H2O和_______ 反应得到的。
②实验过程中有大量CO2产生,化学方程式为_______ 。
(4)当装置A中溶液的pH约为7时应停止通入SO2,否则Na2S2O3的产率下降,其原因是_______ 。
Ⅱ. 探究Na2S2O3的性质
步骤i:取Na2S2O3晶体,溶解,配成0.2 mol/L溶液。
步骤ii:取4 mL溶液,向其中加入1 mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。
步骤ⅲ:继续滴加饱和氯水,浑浊度增大,最后消失,溶液变澄清。
(5)探究S产生的原因:(Na2S2O3中S元素的化合价分别为-2和+6)
提出假设:假设1:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素
假设2:空气中的O2氧化了-2价硫元素
假设3:酸性条件下Na2S2O3分解产生S
设计实验方案:

①向实验b的试管中加入_______ 。
②对比实验a、b,可得出的结论是_______ 。
(6)步骤iii中,溶液最终变澄清的原因是_______ (写化学方程式)。
资料:Na2S2O3·5H2O在中性溶液中较稳定,在酸性溶液中分解产生S、SO2。
I. 制备Na2S2O3·5H2O

(1)实验室有多种方法制备SO2,写出其中一种的化学方程式
(2)装置B用于处理SO2尾气,离子方程式为
(3)A中生成硫代硫酸钠的实质是:S+Na2SO3=Na2S2O3
①S是由SO2、H2O和
②实验过程中有大量CO2产生,化学方程式为
(4)当装置A中溶液的pH约为7时应停止通入SO2,否则Na2S2O3的产率下降,其原因是
Ⅱ. 探究Na2S2O3的性质
步骤i:取Na2S2O3晶体,溶解,配成0.2 mol/L溶液。
步骤ii:取4 mL溶液,向其中加入1 mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。
步骤ⅲ:继续滴加饱和氯水,浑浊度增大,最后消失,溶液变澄清。
(5)探究S产生的原因:(Na2S2O3中S元素的化合价分别为-2和+6)
提出假设:假设1:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素
假设2:空气中的O2氧化了-2价硫元素
假设3:酸性条件下Na2S2O3分解产生S
设计实验方案:

①向实验b的试管中加入
②对比实验a、b,可得出的结论是
(6)步骤iii中,溶液最终变澄清的原因是
您最近一年使用:0次
2022-08-10更新
|
1032次组卷
|
2卷引用:广东省茂名市第一中学2022-2023学年高一下学期期中考试化学试题