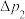1 .  在工业上常作催化剂和刻蚀剂。实验室中,先合成
在工业上常作催化剂和刻蚀剂。实验室中,先合成 ,再与
,再与 反应制备无水
反应制备无水 ,装置如图所示(加热及夹持仪器略)。
,装置如图所示(加热及夹持仪器略)。 的原理为
的原理为 ;
;
② 的熔点为-101℃,沸点为75.6℃,遇水剧烈分解为两种酸性气体;
的熔点为-101℃,沸点为75.6℃,遇水剧烈分解为两种酸性气体; 沸点为105℃。忽略共沸。
沸点为105℃。忽略共沸。
回答下列问题:
(1)仪器甲的名称为______ ,仪器乙中所装的最佳试剂为______ (填序号)。
a.98% b.70%
b.70% c.36.5%盐酸 d.70%
c.36.5%盐酸 d.70%
(2)打开 ,将三通阀调至
,将三通阀调至 ,接下来进行的操作是
,接下来进行的操作是______ ,一段时间后,加热装置C至60℃。仪器丙的作用为______ 。
(3)当C中出现较多液体后,关闭 、
、 。制得
。制得 的操作为:①调节三通阀的位置为
的操作为:①调节三通阀的位置为______ (填序号);②……;③加热E处硬质玻璃管。②的操作为______ 。 在溶液中的颜色变化,进行以下实验。
在溶液中的颜色变化,进行以下实验。
已知:水溶液中, 几乎无色,
几乎无色, 为黄色;
为黄色; 水解生成
水解生成 (棕黄色)。
(棕黄色)。
①从影响平衡移动因素的角度分析,加热前后,实验I中溶液颜色无明显变化的原因为______ 。
②设计实验证明实验Ⅲ中溶液呈黄色的原因是 :
:______ 。
 在工业上常作催化剂和刻蚀剂。实验室中,先合成
在工业上常作催化剂和刻蚀剂。实验室中,先合成 ,再与
,再与 反应制备无水
反应制备无水 ,装置如图所示(加热及夹持仪器略)。
,装置如图所示(加热及夹持仪器略)。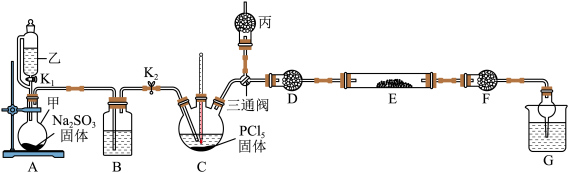
 的原理为
的原理为 ;
;②
 的熔点为-101℃,沸点为75.6℃,遇水剧烈分解为两种酸性气体;
的熔点为-101℃,沸点为75.6℃,遇水剧烈分解为两种酸性气体; 沸点为105℃。忽略共沸。
沸点为105℃。忽略共沸。回答下列问题:
(1)仪器甲的名称为
a.98%
 b.70%
b.70% c.36.5%盐酸 d.70%
c.36.5%盐酸 d.70%
(2)打开
 ,将三通阀调至
,将三通阀调至 ,接下来进行的操作是
,接下来进行的操作是(3)当C中出现较多液体后,关闭
 、
、 。制得
。制得 的操作为:①调节三通阀的位置为
的操作为:①调节三通阀的位置为
 在溶液中的颜色变化,进行以下实验。
在溶液中的颜色变化,进行以下实验。试剂 | 加热前溶液颜色 | 加热后溶液颜色 | |
实验Ⅰ |
| 棕黄色 | 深棕色 |
实验Ⅱ |
| 几乎无色 | 几乎无色 |
实验Ⅲ |
| 黄色 | 深黄色 |
 几乎无色,
几乎无色, 为黄色;
为黄色; 水解生成
水解生成 (棕黄色)。
(棕黄色)。①从影响平衡移动因素的角度分析,加热前后,实验I中溶液颜色无明显变化的原因为
②设计实验证明实验Ⅲ中溶液呈黄色的原因是
 :
:
您最近一年使用:0次
2024-05-21更新
|
376次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
名校
2 . 实验室可用下列装置(部分夹持仪器略去)制取SO2并验证其性质。_______ ,则气密性良好。
(2)装置A中反应的化学方程式为_______ 。
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有_______ (填“还原性”、“氧化性”或“漂白性”);经测定,产物中含有一种摩尔质量为104g/mol的盐,该盐的化学式为_______ 。
(4)试管D中反应的离子方程式为_______ 。
(5)实验结束时,关闭止水夹K,装置B的作用是_______ 。
(6)用图所示装置验证H2SO3酸性比H2CO3强。_______ ,Y为_______ ,Z为_______ 。
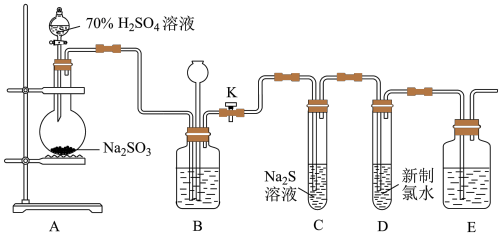
(2)装置A中反应的化学方程式为
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有
(4)试管D中反应的离子方程式为
(5)实验结束时,关闭止水夹K,装置B的作用是
(6)用图所示装置验证H2SO3酸性比H2CO3强。
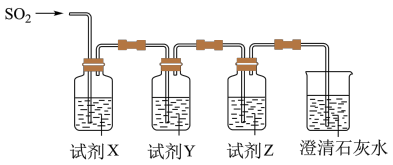
您最近一年使用:0次
3 . 某小组同学采用以下装置验证SO2的性质:
(1)写出圆底烧瓶中发生反应的化学方程式___________ 。
(2)经过实验,观察到如下实验现象:
①试管1中现象___________ 。
②试管2中现象___________ ,写出反应的化学方程式: ___________ 。
③试管3中现象___________ , 说明SO2具有漂白性,证明该漂白的可逆性的实验操作方法是___________ 。
(3)试管4中现象说明SO2还具有的性质是___________ ,反应离子方程式___________ 。
(1)写出圆底烧瓶中发生反应的化学方程式
(2)经过实验,观察到如下实验现象:
①试管1中现象
②试管2中现象
③试管3中现象
(3)试管4中现象说明SO2还具有的性质是
您最近一年使用:0次
名校
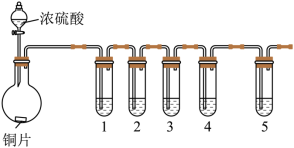
4 . 为探究不同价态硫元素之间的转化,设计了如下装置图(夹持装置略去)。下列说法正确的是
| A.①中未观察到蓝色固体,说明产物中不存在硫酸铜 |
B.②中溶液褪色,说明 具有漂白性 具有漂白性 |
C.③中淡黄色粉末变白,说明反应生成了 |
D.④中产生淡黄色沉淀,证明 被氧化 被氧化 |
您最近一年使用:0次
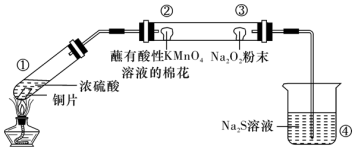
5 . 微型实验药品用量少,绿色环保。如图所示为探究SO2性质的微型实验,滤纸①~④分别浸泡了相关试剂,实验时向试管中滴入几滴浓硫酸。下列说法正确的是

| A.滤纸①先变红后褪色,体现了SO2具有漂白性和酸性氧化物的性质 |
| B.滤纸②、③褪色均证明SO2具有氧化性 |
| C.滤纸④上有黄色固体生成,证明SO2具有还原性 |
| D.若滤纸④上析出了0.096g固体,则在滤纸④上发生的反应转移了0.004mol电子 |
您最近一年使用:0次
名校
6 . 实验室利用SO2合成硫酰氯(SO2Cl2),并对H2SO3和HClO的酸性强弱进行探究。硫酰氯是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应,在丙中制取并收集少量的SO2Cl2:SO2(g)+Cl2(g)=SO2Cl2(l),该反应放热。装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。回答下列问题。___________ 。
(2)装置乙和丁中可以使用同一种试剂,该试剂为___________ 。仪器b中盛放的试剂的作用是___________ 。
选用下面的装置探究酸性:H2SO3>HClO。___________ →F(4个装置都使用)。能证明H2SO3的酸性强于HClO的实验现象为:___________ 和___________ 。
(4)E装置中发生的离子反应方程式:___________ 。

(2)装置乙和丁中可以使用同一种试剂,该试剂为
选用下面的装置探究酸性:H2SO3>HClO。

(4)E装置中发生的离子反应方程式:
您最近一年使用:0次
7 .  可用于食品工业、农业、染料业等,以下进行其性质的探究。
可用于食品工业、农业、染料业等,以下进行其性质的探究。
(1) 的制备
的制备
实验室可用 固体和75%硫酸制备
固体和75%硫酸制备 ,其化学方程式为:
,其化学方程式为:__________________________ 。
(2) 的收集
的收集
为收集纯净的 可用如图所示装置,则连接顺序为发生装置→
可用如图所示装置,则连接顺序为发生装置→_______ →e。 的性质探究
的性质探究
ⅰ)探究 与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示:
与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示: 的变化速率
的变化速率__________  。
。
②ab段变化及溶液的pH减小,表明 与水发生反应,其方程式为
与水发生反应,其方程式为_____________________ ,该反应的产物不稳定,可通过以下实验证明,请补充操作填在表格横线中。
若____________________ ,证明该反应产物不稳定。
ⅱ)探究 使品红溶液褪色的原因
使品红溶液褪色的原因
操作1:将 通入品红溶液中,品红溶液褪色。
通入品红溶液中,品红溶液褪色。 、
、 、
、____________________ 。
已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
④实验设计:小组结合以上信息,设计如下实验证明使品红褪色的微粒不是 请完成表格。
请完成表格。
 可用于食品工业、农业、染料业等,以下进行其性质的探究。
可用于食品工业、农业、染料业等,以下进行其性质的探究。(1)
 的制备
的制备实验室可用
 固体和75%硫酸制备
固体和75%硫酸制备 ,其化学方程式为:
,其化学方程式为:(2)
 的收集
的收集为收集纯净的
 可用如图所示装置,则连接顺序为发生装置→
可用如图所示装置,则连接顺序为发生装置→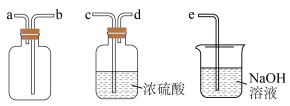
 的性质探究
的性质探究ⅰ)探究
 与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示:
与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示: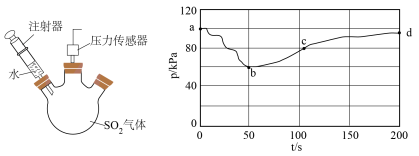
 的变化速率
的变化速率 。
。②ab段变化及溶液的pH减小,表明
 与水发生反应,其方程式为
与水发生反应,其方程式为操作 | 100s内压强变化/kPa |
待烧瓶中压强稳定后,将其置于热水浴中,重新测定压强变化 |
|
|
ⅱ)探究
 使品红溶液褪色的原因
使品红溶液褪色的原因操作1:将
 通入品红溶液中,品红溶液褪色。
通入品红溶液中,品红溶液褪色。
 、
、 、
、已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
④实验设计:小组结合以上信息,设计如下实验证明使品红褪色的微粒不是
 请完成表格。
请完成表格。操作2 | 现象 |
不褪色 |
您最近一年使用:0次
解题方法
8 . ( )
) 为无色、有强烈刺激性气味的气体,是大气主要污染物之一、某学习小组的同学为了探究
为无色、有强烈刺激性气味的气体,是大气主要污染物之一、某学习小组的同学为了探究 的某些性质,进行了如下实验,并检验
的某些性质,进行了如下实验,并检验 能否与氯化钡反应生成沉淀。
能否与氯化钡反应生成沉淀。___________ ,装置A中生成 的离子方程式为
的离子方程式为___________ ;加入碳酸钠粉末的目的是___________ 。
(2)装置B会观察到___________ ,证明 有漂白性。实验时,C出现白色沉淀,请写出相应化学方程式:
有漂白性。实验时,C出现白色沉淀,请写出相应化学方程式:___________ 。
(3)结合实验目的,分析装置中采用澄清石灰水而不采用氢氧化钠溶液的原因:___________ 。
( )氮肥厂的废水直接排放会造成环境污染。目前氨氮废水的处理方法主要有吹脱法、化学沉淀法、硝化反硝化生物法等。某氮肥厂的氨氮废水中氮元素多以
)氮肥厂的废水直接排放会造成环境污染。目前氨氮废水的处理方法主要有吹脱法、化学沉淀法、硝化反硝化生物法等。某氮肥厂的氨氮废水中氮元素多以 和
和 的形式存在,该厂技术团队设计的废水处理方案如下:
的形式存在,该厂技术团队设计的废水处理方案如下: 含有的方法是
含有的方法是___________ (写出所需试剂、操作及现象)。
(5) 是工业合成硝酸的重要原料,写出实验室制取
是工业合成硝酸的重要原料,写出实验室制取 的化学方程式:
的化学方程式:___________ 。
 )
) 为无色、有强烈刺激性气味的气体,是大气主要污染物之一、某学习小组的同学为了探究
为无色、有强烈刺激性气味的气体,是大气主要污染物之一、某学习小组的同学为了探究 的某些性质,进行了如下实验,并检验
的某些性质,进行了如下实验,并检验 能否与氯化钡反应生成沉淀。
能否与氯化钡反应生成沉淀。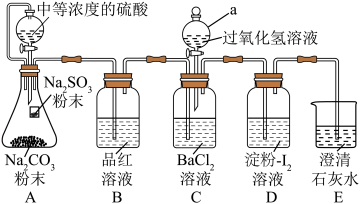
 的离子方程式为
的离子方程式为(2)装置B会观察到
 有漂白性。实验时,C出现白色沉淀,请写出相应化学方程式:
有漂白性。实验时,C出现白色沉淀,请写出相应化学方程式:(3)结合实验目的,分析装置中采用澄清石灰水而不采用氢氧化钠溶液的原因:
(
 )氮肥厂的废水直接排放会造成环境污染。目前氨氮废水的处理方法主要有吹脱法、化学沉淀法、硝化反硝化生物法等。某氮肥厂的氨氮废水中氮元素多以
)氮肥厂的废水直接排放会造成环境污染。目前氨氮废水的处理方法主要有吹脱法、化学沉淀法、硝化反硝化生物法等。某氮肥厂的氨氮废水中氮元素多以 和
和 的形式存在,该厂技术团队设计的废水处理方案如下:
的形式存在,该厂技术团队设计的废水处理方案如下: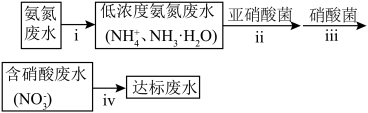
 含有的方法是
含有的方法是(5)
 是工业合成硝酸的重要原料,写出实验室制取
是工业合成硝酸的重要原料,写出实验室制取 的化学方程式:
的化学方程式:
您最近一年使用:0次
9 . 连四硫酸钠 是生物酶的修复剂,其与盐酸反应的离子方程式为:
是生物酶的修复剂,其与盐酸反应的离子方程式为: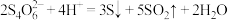 ,按如下装置制备足量
,按如下装置制备足量 并探究其性质,下列表述不正确的是
并探究其性质,下列表述不正确的是
 是生物酶的修复剂,其与盐酸反应的离子方程式为:
是生物酶的修复剂,其与盐酸反应的离子方程式为: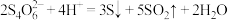 ,按如下装置制备足量
,按如下装置制备足量 并探究其性质,下列表述不正确的是
并探究其性质,下列表述不正确的是
A.Ⅱ中溶液由紫色变成红色一定能证明 是酸性氧化物 是酸性氧化物 |
B.Ⅲ中溶液褪色说明 有还原性 有还原性 |
| C.Ⅳ中溶液有白色沉淀生成 |
D.Ⅳ装置后连接浓 溶液可进行尾气处理 溶液可进行尾气处理 |
您最近一年使用:0次
名校
10 . 某小组用如下装置(夹持装置已略去)制备并探究SO2的性质。
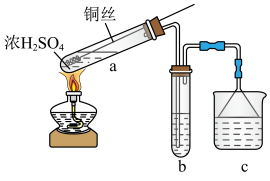
(1)制备SO2的化学方程式是___________ 。
(2)a中控制生成SO2多少的操作是___________ ;反应后a中若溶液颜色无色,试管底部有灰白色固体,确定产物中有CuSO4的操作是___________ 。
(3)b用于探究SO2的性质。
①b中为___________ 溶液时,可证明SO2有漂白性。
②b中为I2和淀粉混合溶液时,溶液蓝色褪去,可证明SO2有还原性,反应的化学方程式___________ 。
③b中为Na2S溶液时,出现淡黄色沉淀,迅速变为黄色溶液,经查阅资料黄色为多硫离子 (x=2~5)的颜色,此时反应中氧化产物和还原产物的物质的量之比为
(x=2~5)的颜色,此时反应中氧化产物和还原产物的物质的量之比为___________ 。随着反应进行,又出现淡黄色沉淀,溶液黄色消失,这是由于溶液中的 与SO2又继续反应了,写出反应的离子方程式
与SO2又继续反应了,写出反应的离子方程式___________ (资料:Na2S能与S反应生成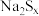 ,
,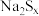 与酸反应生成S和H2S)。
与酸反应生成S和H2S)。
④b中为H2O2溶液时,反应后在溶液中可检验出 ,说明检验
,说明检验 的方法是
的方法是___________ 。有同学认为此法不能证明SO2和H2O2可以反应,理由是___________ ,更严谨的做法是应该在a和b之间加一个盛有___________ 的洗气瓶。
(4)c用于吸收SO2尾气,可选用的试剂是___________。

(1)制备SO2的化学方程式是
(2)a中控制生成SO2多少的操作是
(3)b用于探究SO2的性质。
①b中为
②b中为I2和淀粉混合溶液时,溶液蓝色褪去,可证明SO2有还原性,反应的化学方程式
③b中为Na2S溶液时,出现淡黄色沉淀,迅速变为黄色溶液,经查阅资料黄色为多硫离子
 (x=2~5)的颜色,此时反应中氧化产物和还原产物的物质的量之比为
(x=2~5)的颜色,此时反应中氧化产物和还原产物的物质的量之比为 与SO2又继续反应了,写出反应的离子方程式
与SO2又继续反应了,写出反应的离子方程式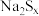 ,
,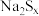 与酸反应生成S和H2S)。
与酸反应生成S和H2S)。④b中为H2O2溶液时,反应后在溶液中可检验出
 ,说明检验
,说明检验 的方法是
的方法是(4)c用于吸收SO2尾气,可选用的试剂是___________。
| A.澄清石灰水 | B.烧碱溶液 | C.纯碱溶液 | D.氨水 |
您最近一年使用:0次
2024-04-08更新
|
126次组卷
|
2卷引用:北京市第八十中学2023-2024学年高一下学期3月月考化学试题

 溶液+蒸馏水
溶液+蒸馏水