1 . 某无色溶液可能含有下列钠盐中的几种:
(1) A.氯化钠 B.硫化钠 C.亚硫酸钠 D.硫代硫酸钠 E.硫酸钠 F.碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体产生,此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题。(硫代硫酸钠: ,
,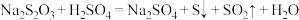 )
)
①不能使品红试液褪色,说明该气体中不含_______ (填分子式)。
②此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母,有几种写几种)。第一种情况是_______ ,第二种情况是_______ ,第三种情况是_______ ,第四种情况是_______ 。
(2)聚合硫酸铁(PFS)是一种性能优异的无机高分子絮凝剂,其化学式通常表示为 。某化工厂制备PFS并用其处理废水。
。某化工厂制备PFS并用其处理废水。
Ⅰ.用硫酸铜废液制备PFS

①试剂A为_______ 。
②“控温氧化”发生反应的离子方程式为_______ 。
③测定PFS样品中的 :取ag样品,溶解于
:取ag样品,溶解于 溶液中,用KF溶液掩蔽
溶液中,用KF溶液掩蔽 (使
(使 不能与
不能与 反应),再用
反应),再用 溶液反应,中和完全时消耗NaOH溶液体积为
溶液反应,中和完全时消耗NaOH溶液体积为 。agPFS样品中的
。agPFS样品中的
_______ mol。
Ⅱ.用石灰乳-PFS法处理含砷废水

已知:
i.常温下, 难溶,
难溶, 可溶;
可溶;
ii.常温下,溶液中含砷微粒的物质的量分数与pH的关系如图。

④ 溶液的pH
溶液的pH_______ 7(填“大于”、“小于”或“等于”)。
⑤“二级沉降”中,溶液的pH在8~10之间,PFS形成的 胶体粒子可以通过沉淀反应进一步减少溶液中的As含量,反应的离子方程式为
胶体粒子可以通过沉淀反应进一步减少溶液中的As含量,反应的离子方程式为_______ 。
⑥溶液的pH和m(Fe)/m(As)对As去除率的影响如图。某酸性含砷废水中As含量为20mg/L,为达到排放标准(As含量≤1mg/L),从节约成本的角度考虑,工业上选择的最佳条件是_______ (填序号)。

a.pH=8.2 m(Fe)/m(As)=5 b.pH=8.2 m(Fe)/m(As)=8
c.pH=9.0 m(Fe)/m(As)=5 d.pH=9.0 m(Fe)/m(As)=8
[m(Fe)/m(As)指PFS中Fe元素质量与对应废水中As元素质量之比]
(1) A.氯化钠 B.硫化钠 C.亚硫酸钠 D.硫代硫酸钠 E.硫酸钠 F.碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体产生,此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题。(硫代硫酸钠:
 ,
,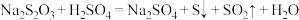 )
)①不能使品红试液褪色,说明该气体中不含
②此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母,有几种写几种)。第一种情况是
(2)聚合硫酸铁(PFS)是一种性能优异的无机高分子絮凝剂,其化学式通常表示为
 。某化工厂制备PFS并用其处理废水。
。某化工厂制备PFS并用其处理废水。Ⅰ.用硫酸铜废液制备PFS

①试剂A为
②“控温氧化”发生反应的离子方程式为
③测定PFS样品中的
 :取ag样品,溶解于
:取ag样品,溶解于 溶液中,用KF溶液掩蔽
溶液中,用KF溶液掩蔽 (使
(使 不能与
不能与 反应),再用
反应),再用 溶液反应,中和完全时消耗NaOH溶液体积为
溶液反应,中和完全时消耗NaOH溶液体积为 。agPFS样品中的
。agPFS样品中的
Ⅱ.用石灰乳-PFS法处理含砷废水

已知:
i.常温下,
 难溶,
难溶, 可溶;
可溶;ii.常温下,溶液中含砷微粒的物质的量分数与pH的关系如图。

④
 溶液的pH
溶液的pH⑤“二级沉降”中,溶液的pH在8~10之间,PFS形成的
 胶体粒子可以通过沉淀反应进一步减少溶液中的As含量,反应的离子方程式为
胶体粒子可以通过沉淀反应进一步减少溶液中的As含量,反应的离子方程式为⑥溶液的pH和m(Fe)/m(As)对As去除率的影响如图。某酸性含砷废水中As含量为20mg/L,为达到排放标准(As含量≤1mg/L),从节约成本的角度考虑,工业上选择的最佳条件是

a.pH=8.2 m(Fe)/m(As)=5 b.pH=8.2 m(Fe)/m(As)=8
c.pH=9.0 m(Fe)/m(As)=5 d.pH=9.0 m(Fe)/m(As)=8
[m(Fe)/m(As)指PFS中Fe元素质量与对应废水中As元素质量之比]
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
2 . 硫脲[CS(NH2)2](M=76)在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备Ca(HS)2,再与CaCN2溶液反应合成CS(NH2)2,实验装置如图所示(夹持及加热装置略)。

已知:CS(NH2)2易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
回答下列问题:
(1)盛装盐酸的仪器名称是_______ 。
(2)实验前先检查装置气密性,操作:
①在E中加水至浸没导管末端,……;
②微热A处三颈烧瓶,观察到E处导管末端有气泡冒出,移走酒精灯;
③一段时间后,E处导管末端形成一段水柱,且高度不变。
将操作①补充完整_______ 。
(3)检查装置气密性后加入药品,打开K2,装置B中盛装的试剂为_______ 。
(4)关闭K2,撤走搅拌器,打开K3,水浴加热D中三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度不高于80℃的原因是_______ ,D处合成硫脲的化学方程式为_______ 。

已知:CS(NH2)2易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
回答下列问题:
(1)盛装盐酸的仪器名称是
(2)实验前先检查装置气密性,操作:
①在E中加水至浸没导管末端,……;
②微热A处三颈烧瓶,观察到E处导管末端有气泡冒出,移走酒精灯;
③一段时间后,E处导管末端形成一段水柱,且高度不变。
将操作①补充完整
(3)检查装置气密性后加入药品,打开K2,装置B中盛装的试剂为
(4)关闭K2,撤走搅拌器,打开K3,水浴加热D中三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度不高于80℃的原因是
您最近一年使用:0次
名校
解题方法
3 . 用如图装置做以下两个实验:
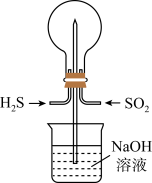
(1)常温下将H2S和SO2以物质的量之比为1∶1充满烧瓶,不久,烧瓶中能观察到的现象是_______ 。
(2)若用Cl2代替SO2,其他条件不变,发生反应的化学方程式为_______ 。
(3)若想使(2)中反应后,烧瓶内产生“喷泉”现象,引发的操作为_______ 。

(1)常温下将H2S和SO2以物质的量之比为1∶1充满烧瓶,不久,烧瓶中能观察到的现象是
(2)若用Cl2代替SO2,其他条件不变,发生反应的化学方程式为
(3)若想使(2)中反应后,烧瓶内产生“喷泉”现象,引发的操作为
您最近一年使用:0次
4 . 硫酸亚铁(FeSO4)工业上常用废铁屑和稀硫酸制备。实验室通过如图装置模拟其制备过程。请回答下列问题:
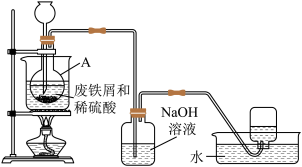
(1)进行实验之前需检查整套装置的_______ 。装置甲中仪器A的名称是_______ 。
(2)常温下废铁屑和稀硫酸反应较慢,而直接加热时温度过高又可能产生Fe3+等副产物,因此,采用水浴加热,并使用过量的 将可能产生的Fe3+还原成Fe2+。
将可能产生的Fe3+还原成Fe2+。 还原Fe3+的离子方程式为
还原Fe3+的离子方程式为_______ 。
(3)废铁屑中含有硫化物杂质,故反应中会生成少量的H2S气体。因此,装置乙中NaOH溶液的主要作用是_______ 。

(1)进行实验之前需检查整套装置的
(2)常温下废铁屑和稀硫酸反应较慢,而直接加热时温度过高又可能产生Fe3+等副产物,因此,采用水浴加热,并使用过量的
 将可能产生的Fe3+还原成Fe2+。
将可能产生的Fe3+还原成Fe2+。 还原Fe3+的离子方程式为
还原Fe3+的离子方程式为(3)废铁屑中含有硫化物杂质,故反应中会生成少量的H2S气体。因此,装置乙中NaOH溶液的主要作用是
您最近一年使用:0次
名校
解题方法
5 . 硫化氢(H2S)是一种有毒的臭鸡蛋气味气体,以下是利用 和FeS制备H2S并进行性质探究的实验装置图。
和FeS制备H2S并进行性质探究的实验装置图。
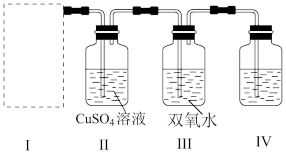
(1)在装置Ⅰ方框内选择合适的装置:___________ 。
A.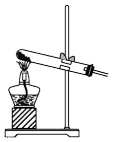 B.
B.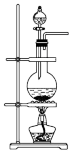 C.
C.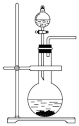 D.
D.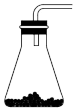 E.
E.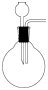
(2)滴加硫酸开始反应,按要求填写以下表格。
(3)上述装置的明显不合理地方是___________ 。
 和FeS制备H2S并进行性质探究的实验装置图。
和FeS制备H2S并进行性质探究的实验装置图。
(1)在装置Ⅰ方框内选择合适的装置:
A.
 B.
B. C.
C. D.
D. E.
E.
(2)滴加硫酸开始反应,按要求填写以下表格。
| 实验装置 | 装置中的试剂 | 实验预期现象 | 相关的离子方程式 |
| Ⅰ |  和FeS 和FeS | 黑色固体溶解,有气泡产生 |  |
| Ⅱ |  溶液 溶液 | 有黑色沉淀产生 | ① |
| Ⅲ | 双氧水 | ② | ③ |
| Ⅳ | ④ | 气体被吸收 | ⑤ |
您最近一年使用:0次
6 . 煤是我国重要的化石燃料,煤化工行业中产生的H2S也是一种重要的工业资源。
(1)煤液化过程中产生的H2S可生产硫酸,部分过程如图所示:
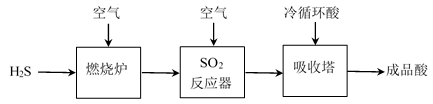
①SO2反应器中的化学方程式是_______ 。
②生产过程中的尾气需要测定SO2的含量符合标准才能排放。已知有V L(已换算成标准状况)尾气,通入足量H2O2吸收再加足量BaCl2溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到b g沉淀。H2O2吸收SO2的化学方程式是_______ ;尾气中SO2的含量(体积分数)的计算式是_______ 。
(2)H2S还可用于回收单质硫。含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,可实现空气脱硫,得到单质硫。FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S) 随时间t的变化如图:
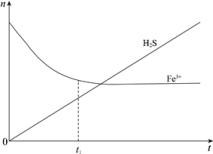
①由图中信息可知,0 ~ t1时,一定发生的反应是_______ (用离子方程式表示)。
②t1以后,溶液中n (Fe3+ ) 保持基本不变,原因是_______ 。
(1)煤液化过程中产生的H2S可生产硫酸,部分过程如图所示:

①SO2反应器中的化学方程式是
②生产过程中的尾气需要测定SO2的含量符合标准才能排放。已知有V L(已换算成标准状况)尾气,通入足量H2O2吸收再加足量BaCl2溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到b g沉淀。H2O2吸收SO2的化学方程式是
(2)H2S还可用于回收单质硫。含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,可实现空气脱硫,得到单质硫。FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S) 随时间t的变化如图:

①由图中信息可知,0 ~ t1时,一定发生的反应是
②t1以后,溶液中n (Fe3+ ) 保持基本不变,原因是
您最近一年使用:0次
解题方法
7 . X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是____________________ ;
②生成固体C的化学方程式是______________________ 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是__________________ ;
②向苛性钠溶液中通入少量的A,所发生反应的离子方程式是__________ ;
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是_____ 。
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是
②生成固体C的化学方程式是
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是
②向苛性钠溶液中通入少量的A,所发生反应的离子方程式是
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
您最近一年使用:0次
解题方法
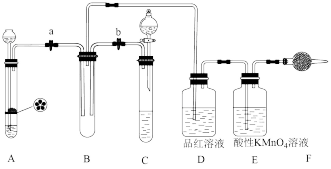
8 . 某课外学习小组的同学设计了如图所示的实验装置(夹持装置略),以验证 的氧化性、还原性和漂白性。
的氧化性、还原性和漂白性。
请回答下列问题:
(1)用Na2SO3固体和70%的浓硫酸反应制取SO2气体,应选用____________ (填“A”或“C”)装置作气体发生装置,不选用另一装置的理由是_______________________________ 。
(2)该课外学习小组的同学用FeS固体和稀硫酸反应制取H2S气体,反应的化学方程式为___________________________ 。
(3)SO2气体通过D装置时的现象是___________________________ ,通过E装置时的现象是__________________________ ;SO2与H2S在B装置中反应,现象是__________________________ 。
(4)F装置中盛有碱石灰,其作用是_______________________________ 。
 的氧化性、还原性和漂白性。
的氧化性、还原性和漂白性。请回答下列问题:
(1)用Na2SO3固体和70%的浓硫酸反应制取SO2气体,应选用
(2)该课外学习小组的同学用FeS固体和稀硫酸反应制取H2S气体,反应的化学方程式为
(3)SO2气体通过D装置时的现象是
(4)F装置中盛有碱石灰,其作用是

您最近一年使用:0次
14-15高三上·上海宝山·期末
解题方法
9 . 硫元素具有可变价态,据此完成以下有关含硫化合物性质的试题。
(1)将H2S气体通入FeCl3溶液中,现象是_____________________________ ;反应的离子方程式是______________________________________ 。
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验。
已知:电离平衡常数:H2S K1 =1.3×10-7;K2 = 7.1×10-15
H2SO3 K1 =1.7×10-2;K2 = 5.6×10-8
①根据上述实验,可以得出结论:在_________ 条件下,+4价硫的化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是______ (选填编号)。
A.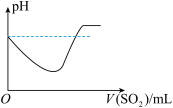 B.
B. 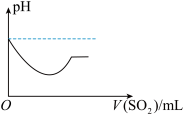
C.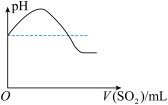 D.
D. 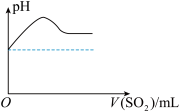
(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。 要证明Na2SO3具有还原性,应选用的试剂有______________ ,看到的现象是 ____________________ 。 要证明Na2SO3具有氧化性,应选用的试剂有___________________ ,反应的离子方程式是________________________________ 。
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应_____________________ 。
(1)将H2S气体通入FeCl3溶液中,现象是
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验。
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 K1 =1.7×10-2;K2 = 5.6×10-8
①根据上述实验,可以得出结论:在
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
A.
 B.
B. 
C.
 D.
D. 
(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。 要证明Na2SO3具有还原性,应选用的试剂有
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
您最近一年使用:0次
10-11高一下·湖北黄冈·期中
解题方法
10 . 下图所表示的是中学化学中一类常见的物质转化关系(反应生成的H2O均略去),试按要求回答问题:
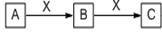
(1)若A为空气中含量最多的单质,C为一种红棕色的气体,则B与X的反应方程式为___________________________
(2)若A为有臭鸡蛋气味的气体,C为H2SO3的酸酐,则B为_______ ,1molA与a molX充分燃烧,若要求既生成B又生成C,则a的取值范围为_____________

(1)若A为空气中含量最多的单质,C为一种红棕色的气体,则B与X的反应方程式为
(2)若A为有臭鸡蛋气味的气体,C为H2SO3的酸酐,则B为
您最近一年使用:0次



