名校
1 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
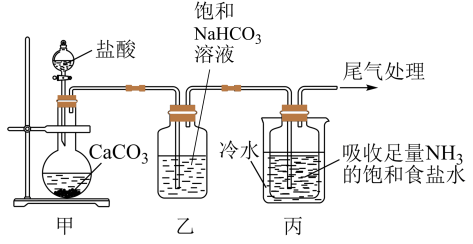
(1)装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为____ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、_______ ,最后一步发生反应的化学方程式为_______ 。
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
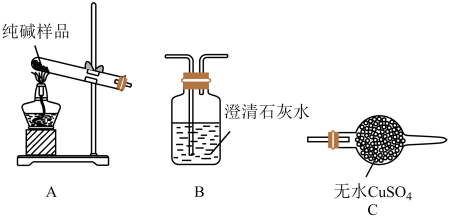
(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为_______ 。请另设计一个实验方案,测定纯碱样品的纯度(样品中只含有NaHCO3杂质)_______ 。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置乙的作用是
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
2022-08-21更新
|
474次组卷
|
2卷引用:陕西省西安市长安区第一中学2021-2022学年高一上学期期末考试化学试题
2 . 某兴趣小组研究二氧化碳与氢氧化钠溶液的反应。
(一)利用压强传感器和 传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)

(1)设计实验乙的目的是_______ 。
(2)图丙中曲线_______ (选填“I”或“II”)表示 和NaOH溶液的反应,写出该反应的离子反应方程式
和NaOH溶液的反应,写出该反应的离子反应方程式_______ 。
(3)两烧瓶中的压强在开始阶段均增大的原因是_______ 。
(二)测定 与NaOH溶液的反应后产物(碳酸钠和碳酸氢钠)混合物中碳酸钠的质量分数,按如图所示的实验流程进行实验:
与NaOH溶液的反应后产物(碳酸钠和碳酸氢钠)混合物中碳酸钠的质量分数,按如图所示的实验流程进行实验:

(4)有同学认为“加入适量盐酸”不好控制,应改为“加入过量盐酸”,便于操作且不影响测定的准确性,该观点_______ (填“正确”或“不正确"),其原因是_______ 。
(5)若实验中测得样品质量为46.4 g,蒸发后固体质量为40.95 g,则碳酸钠的质量分数为_______ (保留3位有效数字)。蒸发结晶过程中若有固体飞溅,测得碳酸钠的质量分数_______ (填“偏大”“偏小”或“无影响”)。
(一)利用压强传感器和
 传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
(1)设计实验乙的目的是
(2)图丙中曲线
 和NaOH溶液的反应,写出该反应的离子反应方程式
和NaOH溶液的反应,写出该反应的离子反应方程式(3)两烧瓶中的压强在开始阶段均增大的原因是
(二)测定
 与NaOH溶液的反应后产物(碳酸钠和碳酸氢钠)混合物中碳酸钠的质量分数,按如图所示的实验流程进行实验:
与NaOH溶液的反应后产物(碳酸钠和碳酸氢钠)混合物中碳酸钠的质量分数,按如图所示的实验流程进行实验:
(4)有同学认为“加入适量盐酸”不好控制,应改为“加入过量盐酸”,便于操作且不影响测定的准确性,该观点
(5)若实验中测得样品质量为46.4 g,蒸发后固体质量为40.95 g,则碳酸钠的质量分数为
您最近一年使用:0次
名校
3 . 某化学兴趣小组的同学准备探究钠及其化合物的相关性质,请按要求填空:
(1)Na、Na2O、Na2O2和NaOH久置在空气中最终都是变为______________ (填化学式);
(2)将一小块金属Na投入CuSO4溶液中,现象为________________________________ ;
(3)某同学向过氧化钠与水反应后的溶液中滴入几滴酚酞溶液,发现溶液变红,原因为________________________ (用离子方程式及必要的文字说明)。将带火星的木条伸入试管中,木条未复燃,向试管中加入少许黑色MnO2粉末,试管内剧烈反应产生大量气泡,该气体能使带火星的木条复燃,证明原试管中存在中间产物__________ ;并由此推测Na2O2和水的反应是分两步进行的,写出其第一步反应的化学方程式___________________ ;
(4)现有一种以NaHCO3为主要成分的食品膨松剂,由于存放时间较长,部分分解成Na2CO3粉末。为测定混合样品中NaHCO3的质量分数,按如图所示连接好装置,________ ,装入相应药品进行实验。

已知:碱石灰是固体氢氧化钠和氧化钙组成的混合物。
实验过程:将样品m1 g装入样品管B,测定实验前D装置的质量m2 g打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,以除去装置中的二氧化碳;关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_________________ ,待C中不再产生气泡,冷却至室温,拆下装置,再次称量D的质量为m3 g,则混合物中NaHCO3的质量分数为_______________ (用含m1 、m2
、m2 、m3
、m3 的代数式表示),若实验前该膨松剂受潮,则最终实验结果
的代数式表示),若实验前该膨松剂受潮,则最终实验结果___________ (填“偏大”、“偏小”或“不变”)。
(1)Na、Na2O、Na2O2和NaOH久置在空气中最终都是变为
(2)将一小块金属Na投入CuSO4溶液中,现象为
(3)某同学向过氧化钠与水反应后的溶液中滴入几滴酚酞溶液,发现溶液变红,原因为
(4)现有一种以NaHCO3为主要成分的食品膨松剂,由于存放时间较长,部分分解成Na2CO3粉末。为测定混合样品中NaHCO3的质量分数,按如图所示连接好装置,

已知:碱石灰是固体氢氧化钠和氧化钙组成的混合物。
实验过程:将样品m1 g装入样品管B,测定实验前D装置的质量m2 g打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,以除去装置中的二氧化碳;关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
 、m2
、m2 、m3
、m3 的代数式表示),若实验前该膨松剂受潮,则最终实验结果
的代数式表示),若实验前该膨松剂受潮,则最终实验结果
您最近一年使用:0次
4 . 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、极易水解,可用作肥料、灭火剂、洗涤剂等。实验室用如图所示装置制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备。

(1)结合上述实验装置,写出制备氨基甲酸铵的化学方程式:_____ 。该反应为_____ (填“吸热”或“放热”)反应。
(2)液体石蜡鼓泡瓶的作用是_____ ,冰水的作用是_____ 。
(3)从反应后的混合物中分离出产品的实验方法是_____ 。
(4)氨基甲酸铵极易水解,产物是碳酸氢铵和一种弱碱,请写出其水解反应方程式:_____ 。
(5)某实验小组通过上述实验装置进行实验,得到了一份只含有少量碳酸铵杂质的氨基甲酸铵固体产品。为验证氨基甲酸铵的水解产物有 ,该实验小组计划用上述样品进行实验。请补充以下实验设计方案:取少量固体样品于试管中,加入蒸馏水至固体溶解,得到无色溶液,
,该实验小组计划用上述样品进行实验。请补充以下实验设计方案:取少量固体样品于试管中,加入蒸馏水至固体溶解,得到无色溶液,_____ 。(限选试剂:蒸馏水、BaCl2溶液、澄清石灰水、AgNO3溶液)
(6)氨基甲酸铵可用作肥料,其肥效比尿素_____ (填“强”或“弱”)。

(1)结合上述实验装置,写出制备氨基甲酸铵的化学方程式:
(2)液体石蜡鼓泡瓶的作用是
(3)从反应后的混合物中分离出产品的实验方法是
(4)氨基甲酸铵极易水解,产物是碳酸氢铵和一种弱碱,请写出其水解反应方程式:
(5)某实验小组通过上述实验装置进行实验,得到了一份只含有少量碳酸铵杂质的氨基甲酸铵固体产品。为验证氨基甲酸铵的水解产物有
 ,该实验小组计划用上述样品进行实验。请补充以下实验设计方案:取少量固体样品于试管中,加入蒸馏水至固体溶解,得到无色溶液,
,该实验小组计划用上述样品进行实验。请补充以下实验设计方案:取少量固体样品于试管中,加入蒸馏水至固体溶解,得到无色溶液,(6)氨基甲酸铵可用作肥料,其肥效比尿素
您最近一年使用:0次
解题方法
5 . 碳酸钠是一种重要化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,其步骤如下:①将氯化钠固体溶于水,并加入NH4HCO3粉末;②在30 ~ 50 °C条件下加热;③过滤,得到晶体A;④将晶体A在300°C加热,最后得到碳酸钠。已知:在铵盐的浓溶液中碳酸氢钠的溶解度较小。回答下列问题:
(1)步骤②中的加热方式是_______ 。
(2)写出生成晶体A的化学方程式_______ 。
(3)步骤④中“300° C加热”所选用的仪器是_______ (填标号)。
(4)下列有关碳酸钠和碳酸氢钠的叙述正确的是_______。
(5)世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法,其流程为:流程I是向NaCl(s)中加浓H2SO4并加热到600 -700℃,获得Na2SO4(s) ;流程II是Na2SO4(s)中加木炭、石灰石并加热到1000℃,获得Na2CO3(s)。其中流程II的反应分步进行:①Na2SO4+4C Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为
Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为_______ ;Na2S在流程II中所起的作用有_______ (填编号)。
a.催化剂 b.中间产物 c.氧化产物 d.还原产物
(6)检验产品中是否有杂质碳酸氢钠:称取w1g样品于坩埚中,充分加热后,得到w2g残留固体。若含碳酸氢钠杂质,则w1_______ w2(选填“>”、“<”或“=”)。
(1)步骤②中的加热方式是
(2)写出生成晶体A的化学方程式
(3)步骤④中“300° C加热”所选用的仪器是

(4)下列有关碳酸钠和碳酸氢钠的叙述正确的是_______。
| A.常温下,向相同浓度的碳酸钠和碳酸氢钠溶液中各滴入2滴酚酞试液,前者红色更深 |
| B.碳酸钠的热稳定性弱于碳酸氢钠 |
| C.常温下,相同浓度的碳酸钠和碳酸氢钠分别与足量的等浓度盐酸反应,前者反应更剧烈 |
| D.在两支试管里分别加入碳酸钠固体和碳酸氢钠固体各1g,再各滴入几滴水,前者试管底部变热,后者变冷 |
 Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为
Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为a.催化剂 b.中间产物 c.氧化产物 d.还原产物
(6)检验产品中是否有杂质碳酸氢钠:称取w1g样品于坩埚中,充分加热后,得到w2g残留固体。若含碳酸氢钠杂质,则w1
您最近一年使用:0次
名校
6 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为_______ ;装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3.装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为_______ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、_______ ,最后一步发生反应的化学方程式为_______ 。
Ⅱ.测定所得产品的组成和纯度
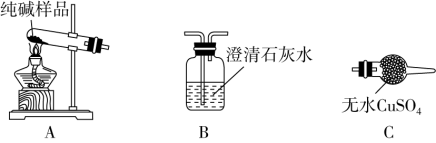
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成表格:
(5)测定该纯碱样品的纯度:称取m1 g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2 g。则该纯碱样品的纯度为_______ 。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3.装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成表格:

| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
名校
7 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
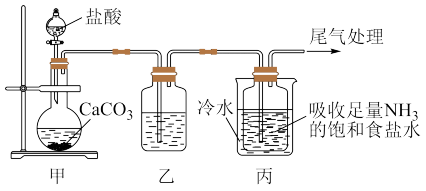
(1)装置乙中盛放的试剂为_______ ,它的作用是_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中总反应的化学方程式为_______ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______ 、洗涤固体、_______ ,最后一步发生反应的化学方程式为_______ 。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置乙中盛放的试剂为
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中总反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
8 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡就。某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
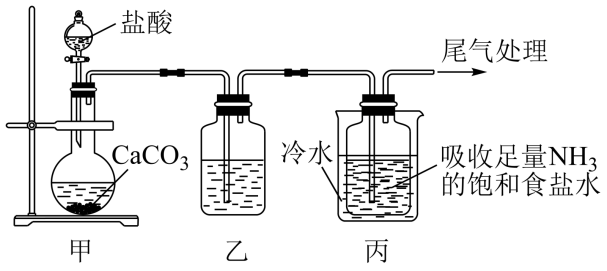
(1)装置乙中盛放的试剂为___ ,它的作用是___ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中总反应的化学方程式为:NaCl+CO2+NH3+H2O NaHCO3↓+___。
NaHCO3↓+___。___
(3)可用__ (填一种实验操作)的方法将生成的NaHCO3晶体从溶液中分离出来。
Ⅱ.测定所得产品的组成和纯度
(4)请设计实验,检验纯碱样品中是否混有NaHCO3或NaCl。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置乙中盛放的试剂为
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中总反应的化学方程式为:NaCl+CO2+NH3+H2O
 NaHCO3↓+___。
NaHCO3↓+___。(3)可用
Ⅱ.测定所得产品的组成和纯度
(4)请设计实验,检验纯碱样品中是否混有NaHCO3或NaCl。
| 实验操作 | 实验现象 | 实验结论 |
| 样品中不含NaHCO3 | ||
| 样品中含NaCl |
您最近一年使用:0次
名校
解题方法
9 . 膨松剂在面包制作过程中发生反应产生气体,使面包变得松软。已知某膨松剂含碳酸氢钠、碳酸氢铵中的一种或两种,化学兴趣小组对该膨松剂进行如下探究:
【查阅资料】:碱石灰不与氨气反应,常用于吸收水蒸气和二氧化碳;常用浓硫酸吸收氨气。
实验一:检验膨松剂成分
在玻璃管中加入该膨松剂,按下图连接好装置(铁架台略去,下同)。点燃酒精灯:
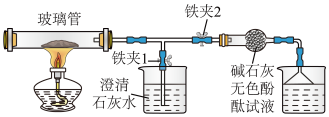
(1)关闭铁夹2,打开铁夹1,观察到现象:___________ ,说明产物中有二氧化碳;
(2)打开铁夹2,关闭铁夹1,观察到的现象:___________ ,说明产物中有氨气;
(3)充分加热后,玻璃管中仍有固体,结论:该膨松剂的成分是___________ (化学式)。
实验二:测定膨松剂受热产生气体的量
用下图装置测定该膨松剂样品产生的二氧化碳气体的质量(整套装置气密性良好,各装置中气体吸收剂足量)
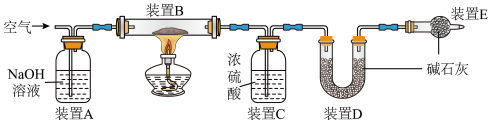
(4)将8g膨松剂装入装置B中,通过测定实验前后装置___________ (填字母序号)的质量,其质量差即为样品产生的二氧化碳气体的质量。加热前,先对已连接好的装置A、B和C通一段时间的空气,再连接上装置D、E;加热过程中,装置C的作用是___________ ;停止加热后,应继续通入空气一段时间的目的是___________ 。
(5)测定氨气的质量:将上图装置中___________ (填字母)的连接顺序对调。另取8g膨松剂装入装置B中,通过测定实验前后装置C的质量,其质量差即为样品产生的氨气的质量。
【解释与结论】同学们进一步对实验结果进行分析后,认为该膨松剂质量良好。
【反思与评价】实验II中,若没有装置E,造成测定结果可能会___________ (填“偏大”、“不变”或“偏小”)
【查阅资料】:碱石灰不与氨气反应,常用于吸收水蒸气和二氧化碳;常用浓硫酸吸收氨气。
实验一:检验膨松剂成分
在玻璃管中加入该膨松剂,按下图连接好装置(铁架台略去,下同)。点燃酒精灯:

(1)关闭铁夹2,打开铁夹1,观察到现象:
(2)打开铁夹2,关闭铁夹1,观察到的现象:
(3)充分加热后,玻璃管中仍有固体,结论:该膨松剂的成分是
实验二:测定膨松剂受热产生气体的量
用下图装置测定该膨松剂样品产生的二氧化碳气体的质量(整套装置气密性良好,各装置中气体吸收剂足量)

(4)将8g膨松剂装入装置B中,通过测定实验前后装置
(5)测定氨气的质量:将上图装置中
【解释与结论】同学们进一步对实验结果进行分析后,认为该膨松剂质量良好。
【反思与评价】实验II中,若没有装置E,造成测定结果可能会
您最近一年使用:0次
2021-01-01更新
|
361次组卷
|
2卷引用:山东省青岛第五十八中学2020-2021学年高一上学期期中考试化学试题
解题方法
10 . 膨松剂是一种食品添加剂。它在面包制作过程中发生反应产生气体,使面包变得松软,膨松剂产生气体的量是检验膨松剂品质的一项重要指标。已知某膨松剂含碳酸氢钠、碳酸氢铵中的一种或两种,某化学兴趣小组对该膨松剂进行了探究。
探究Ⅰ:检验膨松剂的成分:在硬质玻璃管中加入该膨松剂,按如图所示连接好装置(装置气密性良好,且装置内空气已排尽)。
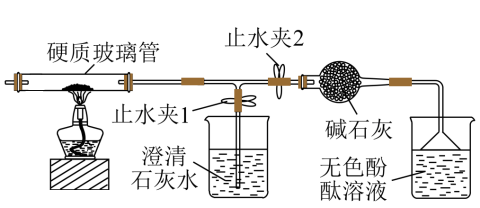
【观察与分析Ⅰ】点燃酒精灯。
(1)关闭止水夹2,打开止水夹1,澄清石灰水变浑浊,说明产物中有二氧化碳,该反应的化学方程式为_______ 。
(2)打开止水夹2,关闭止水夹1,观察到的现象是____ ,说明产物中有氨气。
(3)充分加热后,硬质玻璃管中_____ (填“有”或“无”)固体剩余。
【实验结论】该膨松剂是碳酸氢钠和碳酸氢铵的混合物。
探究Ⅱ:测定该膨松剂受热产生气体的质量:用如图所示装置测定该膨松剂样品产生的二氧化碳和氨气的质量(装置气密性良好,各装置中气体吸收剂足量)。
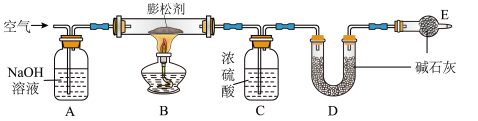
【观察与分析Ⅱ】(4)通过测定实验前后装置D的质量,其质量差即为样品产生二氧化碳的质量,装置C的作用是___ ,装置D的作用是______ ,若没有装置E,会造成测定结果______ (填“偏大”“不变”或“偏小”)。
(5)实验过程中必须向装置内通入空气,装置A的作用是除去空气中的______ (填名称)。停止加热后,继续通入空气一段时间,目的是______ 。
(6)若对装置C、D、E连接顺序进行调整,即可用于测定另一份同质量的相同样品受热分解产生的氨气的质量。则装置C、D、E连接顺序为________ ,通过测定实验前后装置C的质量,其质量差即为样品产生氨气的质量。
【拓展研究】(7)若将产生的氨气通过灼热的氧化铜会生成红色固体、无色液体和气体单质三种物质,则该反应的化学方程式为_____ 。
探究Ⅰ:检验膨松剂的成分:在硬质玻璃管中加入该膨松剂,按如图所示连接好装置(装置气密性良好,且装置内空气已排尽)。

【观察与分析Ⅰ】点燃酒精灯。
(1)关闭止水夹2,打开止水夹1,澄清石灰水变浑浊,说明产物中有二氧化碳,该反应的化学方程式为
(2)打开止水夹2,关闭止水夹1,观察到的现象是
(3)充分加热后,硬质玻璃管中
【实验结论】该膨松剂是碳酸氢钠和碳酸氢铵的混合物。
探究Ⅱ:测定该膨松剂受热产生气体的质量:用如图所示装置测定该膨松剂样品产生的二氧化碳和氨气的质量(装置气密性良好,各装置中气体吸收剂足量)。

【观察与分析Ⅱ】(4)通过测定实验前后装置D的质量,其质量差即为样品产生二氧化碳的质量,装置C的作用是
(5)实验过程中必须向装置内通入空气,装置A的作用是除去空气中的
(6)若对装置C、D、E连接顺序进行调整,即可用于测定另一份同质量的相同样品受热分解产生的氨气的质量。则装置C、D、E连接顺序为
【拓展研究】(7)若将产生的氨气通过灼热的氧化铜会生成红色固体、无色液体和气体单质三种物质,则该反应的化学方程式为
您最近一年使用:0次



